H2SO4 является высокотоксичным веществом. Он легко растворяется в воде и вступает в контакт с другими химическими веществами. В чистом виде он сильно поглощает воду и может распространяться в газообразной форме в случае аварии на производстве или при транспортировке. Серная кислота в высоких концентрациях взрывоопасна.
Введение
Серная кислота является важнейшим продуктом химической промышленности. Среди минеральных кислот, производимых химической промышленностью, серная кислота занимает первое место по производству и потреблению. На это есть две причины. Его дешевизна по сравнению со всеми другими кислотами и его свойства. Серная кислота применяется в различных отраслях экономики, поскольку обладает рядом особых свойств, облегчающих ее техническое использование. Серная кислота не дымит, в концентрированном виде не разъедает черные металлы, может образовывать многочисленные устойчивые соли и является дешевым сырьем для различных отраслей промышленности. В настоящее время крупнейшими потребителями серной кислоты являются фосфорная промышленность и производство азотных интродуктов, включая сульфат аммония, песок и высокие фосфаты. Простой высокий фосфат производится путем переработки серной кислоты с апатитом и фосфатом. Использование неорганических удобрений помогает повысить урожайность культур и содержание питательных веществ. Кроме того, серная кислота используется для производства некоторых кислот (фосфатной, гидрохлоридной, ацетатной), сульфатов, искусственных волокон, лаков, красок, пластикатов, моющих средств, лекарственных препаратов, пестицидов, цветных и редких металлов и производства редких металлов. Эстеры. Он используется для подготовки металлических поверхностей к нанесению гальванических покрытий, для очистки нефтепродуктов в качестве электролитов в кислотных аккумуляторах и в машиностроении. В металлургической промышленности серная кислота и ее соли используются в производстве стальных изделий. Перед использованием вещества подробно изучаются его физические и химические свойства. После этого ограничения на использование вещества становятся очевидными.
Серная кислота H2SO4 является сильной битиновой кислотой и имеет самую высокую степень окисления серы (+6). При нормальных условиях темная серная кислота представляет собой тяжелую маслянистую жидкость, бесцветную и без запаха. В технике серная кислота обозначается как смесь серной кислоты SO3 с водой. Если молекулярный голос SO3:H2O равен 1, то это раствор SO3 серной кислоты (олеум). Плотность реактивной серной кислоты обычно составляет 1,84 г/см3 и приблизительно равна
95% H2SO4. Температура плавления моногидрата, который затвердевает только при температуре ниже -20°C, составляет 10,37°C, а теплота плавления — 10,5 кДж/моль. При нормальных условиях это очень вязкая жидкость с очень высокой диэлектрической проницаемостью (E = 100 при 25°C). Стандартная энтальпия образования равна DN = 298 кДж/моль. Типичная энергия Гиббса образования DG = 298 кДж/моль. Типичная энтропия образования S = 298 Дж/моль-К. Типичный молекулярный нагрев cap = 298 дж/моль-к.
Серная кислота является сильной бастоновой кислотой и растворяется в два этапа.
H2SO4 = H + + HSO4 — первая стадия.
HSO4 = H + + SO42 — вторая стадия
В растворах высокой плотности разложение серной кислоты на второй стадии незначительно.
Серная кислота является очень мощным обезвоживающим агентом. Он поглощает влагу из воздуха (гигроскопичен) и удаляет воду из кристаллогидратов.
h2SO4 содержащий + cuso4*5H2O синий = cuso4 белый + 5H2O,.
(обугленное дерево и бумага):.
H2SO4CONC. + C12H22O = 12C + 11H2O,.
H2SO4CONC. + C2H5OH = CH2 = CH2 + H2O
Серная кислота обладает всеми свойствами сильной кислоты:.
(a) взаимодействуя с основными оксидами, например.
Способы получения серной кислоты
Даже в XIII веке серную кислоту добывали в небольших количествах при термическом разложении серной кислоты FESO4, так что один из сортов серной кислоты до сих пор называется серным маслом, но серная кислота уже давно не производится. Время. Серная кислота.
Сегодня серная кислота производится двумя способами. Это нитрит, существующий уже более 200 лет, и контактная кислота, завоеванная промышленностью в конце и начале XX века.
В зависимости от того, как происходит процесс окисления SO2 с помощью SO3, осуществляются два основных метода производства серной кислоты. В контактном методе производства серной кислоты процесс окисления SO2 в SO3 происходит на твердом катализаторе. На последней стадии процесса триоксид серы преобразуется в серную кислоту. Это можно упростить с помощью уравнения реакции SO3 + H2O = H2SO4.
Если процесс протекает по азотному методу (башня), то в качестве переносчиков кислорода используются оксиды азота. Окисление диоксида серы происходит во влажной фазе, и конечным продуктом является серная кислота: SO2 + N2O3 + H2O = H2SO4 + 2NO
Сегодня в промышленности для производства серной кислоты в основном используется контактный метод, который позволяет применять более мощные аппараты.
Характеристика исходного сырья
Сырьем для производства серной кислоты является серосодержащее соединение, из которого можно получить диоксид серы. Около 80% серной кислоты в промышленности производится природной серой и черной (сульфатной) металлургией. Отходящие газы цветной металлургии занимают важное место в балансе сырья. Некоторые отрасли промышленности используют сероводород в качестве сырья. Он образуется при вымывании серы во время переработки нефти.
Исходным реагентом для получения серной кислоты является соединение, содержащее элементарную серу и серу, из которого можно получить либо диоксид серы. Традиционно дядя и железо (бог) являются основными источниками сырья. Около половины серной кислоты получают из серы, а треть — из металлических минералов. Отходящие газы цветной металлургии, содержащие диоксид серы, также играют важную роль в балансе сырья. В то же время выхлопные газы являются самым дешевым сырьем, с низкими оптовыми ценами также на кордон, в то время как сера является самым дорогим сырьем. Поэтому, чтобы сделать производство серной кислоты из серы целесообразным, необходимо разработать системы, в которых затраты на обработку значительно ниже, чем затраты на обработку серебра или выхлопных газов.
Аналогичным образом выбирается коммерческое качество масла (правая часть диаграммы). Так, 20% масла имеет температуру кристаллизации (-11ºC), а 65% масла (-0,35ºC).
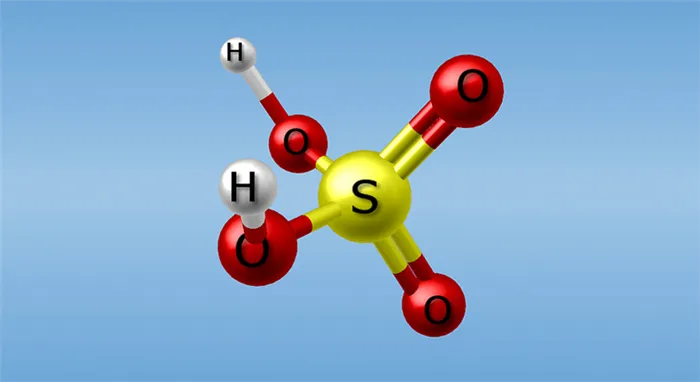
Формула и физические свойства
Серная кислота, одно из основных соединений промышленности, имеет химический тип H2SO4. Его молекула состоит из четырех атомов кислорода, двух атомов водорода и одного атома серы. Эта густая маслянистая жидкость без запаха, в чистом виде бесцветна и имеет характерный «медный» вкус. Его плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают грубому продукту желтоватый или коричневато-желтый цвет.

Соединение кипит при температуре +296°C и плавится при +10,3°C Его кристаллы гигроскопичны и активно вытягивают воду из всего, что их окружает, бумаги, дерева и сахара. Теплота удержания влаги при растворении настолько велика, что смесь кипит и искрится. Поэтому кислота добавляется в воду для перемешивания, а не против. Древнее название «сера» относится к 18 и 19 векам. Сера для пороха добывалась из разложения на серном заводе в Пиллидже. Кристаллический гидрат его соли до сих пор называется витриолом.
Природный гипс — кристаллический гидрат сульфата кальция — давно известен врачам и строителям. Садоводы и огородники любят сульфат меди — это ценный помощник в борьбе с различными вредителями и болезнями растений. Сульфат щавелевой кислоты необходим для производства красок и дубления кожи. Сульфат натрия или «глауберова соль» используется в химической промышленности, при обработке древесины и в медицине (как слабительное и желчегонное средство для людей и животных).
Сульфат бария или «бариевая кашица» обладает уникальной способностью взаимодействовать с рентгеновскими лучами, удерживая их. Это большое преимущество при исследовании полых органов в человеческом теле.
Способы промышленного производства
Сырьем служит природный минерал коричневый огонь, «серный огонь». Сегодня ее заменила основная сера или ее соединения: сероводород, соль — сульфат, сульфат и газовые отходы от термоэлектрических установок, работающих на медленной нефти. Производство включает в себя различные последовательные этапы.
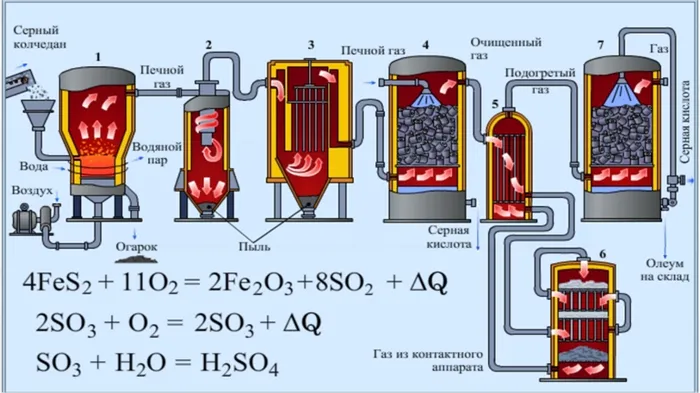
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
В общем объеме минеральных кислот, производимых сегодня химической промышленностью, H2SO4 занимает видное место. При этом он является самым дешевым, технологичным и не разрушает черные металлы в концентрированном состоянии.
Камерный метод получения
В Средние века алхимики составляли сульфаты в так называемой камерной процедуре. Они использовали специальную большую камеру размером с камеру, запаянную свинцом. Поверхности стен были покрыты защитным слоем сульфата свинца в результате окисления. При сжигании смеси, состоящей из сернистой серы и нитрата калия в присутствии воздуха, образуется твердый остаток оксидов азота и солей калия с выделением газа оксида серы (III).
Он поглощался водой в камере, давая низкопрочный продукт, который нуждался в дальнейшей конденсации. После открытия каталитических свойств оксидов азота камерный метод уступил место менее энергозатратной и эффективной технологии производства.
Современные способы синтеза
«Едва ли найдется другое вещество, искусственно экспортируемое и часто применяемое в технике», — так гениальный русский ученый Д.И. Менделеев объясняет значение серной кислоты. Сегодня для получения диоксида серы используются два метода окисления.
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
В контактном методе смесь реагентов проходит через твердый катализатор, который прикрепляется к слою и увеличивает его поверхность. Нитрозный метод предполагает распыление воды или разбавленной кислоты с сырьем или разбавленной кислотой в башенный реактор. Первый метод более производителен и компактен, дает продукт более высокой чистоты при меньших затратах и постепенно вытесняет конкурентов по нитрификации.

Обнаружен ряд ускорителей окисления. Наиболее эффективны оксиды платины, ванадия V2O5 и железа Fe2O3. Однако первые являются дорогостоящими и быстро загрязняются примесями мышьяка в газовой фазе SO2. Для поддержания каталитической активности оксидов железа требуется температура выше 600°C. Ванадиевые катализаторы считаются наиболее экономичными и используются в производстве.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди самых сильных минеральных кислот. Его активность легко характеризуется высокой полярностью молекулярных связей водород-кислород и, следовательно, хрупкостью. Это придает H2SO4 особые свойства, а также некоторые свойства, общие для всех соединений этого класса, например, взаимодействие кислоты с металлом. Среди основных химических свойств стоит упомянуть следующие
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Особые свойства концентрата обусловлены структурными свойствами типа серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной степени окисления четвертого порядка. Таким образом, он может принимать только электроны, что придает соединению высокие окислительные свойства. Некоторые из них заслуживают внимания:.
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Вторая стадия (химическое взаимодействие) называется динамической стадией или динамической областью процесса, а две другие — диффузионной областью процесса.
Сырьевые источники для производства серной кислоты
Сырьем для производства серной кислоты являютсясульфидная руда. Например, кремнезем (FeS2) или сульфатной металлургии (флотационная металлургия). Содержание серы в нем колеблется между 40 и 54%. В нашей стране только 1/4 всей серной кислоты производится флотационной металлургией. Серная руда, содержащая медь и цинк. Он также может быть использован в качестве сырья.
Сера. Используется либо природная сера, либо сера из природного газа или процессов нефтепереработки.
Сульфид водорода. Сероводород используется в качестве побочного продукта в нефтегазовой нефтехимической и нефтеперерабатывающей промышленности. Образование серной кислоты из сероводорода называют «жидким катализом».
Кислотный деготь (или отходы серной кислоты).
Природные сульфаты Гипс (CaSO4-2H2O), безводный (CaSO4).
Промышленные сорта серной кислоты
В нашей стране серная кислота производится в следующих качествах
- техническая (купоросное масло), примерно 92,5% H2Итак.4;
- моногидрат, примерно 98,5% H2Итак.4;
- олеум, примерно 18,5% свободного SO3 в моногидрате;
- нитрозная или башенная, примерно 75% H2Итак.4.
Также производятся специальные виды серной кислоты (реактивная, аккумуляторная и т.д.).
Способы получения серной кислоты
Серная кислота производится двумя основными способами
Контакт. Этот метод основан на том, что этап окисления SO2 затем3 проводили с использованием твердого катализатора. Полученная серная кислота характеризуется высокой концентрацией и чистотой.
Азот. Здесь окисление SO2 затем3 образуется под действием нитрозов, которые представляют собой оксиды азота, поглощенные серной кислотой.
Нитритный метод был разработан раньше контактного метода. Первым был так называемый камерный метод. Она включала в себя сжигание серы, смешанной с нитратом калия, в свинцовой камере.
Затем свинцовая камера была заменена башней, а в качестве сырья использовался сульфид пирита. Этот метод также известен как метод башни.
Сегодня нитратный процесс уже неудовлетворителен, так как серная кислота загрязнена примесями, а концентрация кислоты не превышает 75%. Поэтому метод требует очистки и концентрации конечного продукта. Без дальнейшей переработки он может быть использован только в производстве удобрений.








