Результирующие реакции фенолятПод воздействием кислот легко разлагается. Даже слабая кислота, например, угольная кислота, вытесняет фенол из фенолятов. Следовательно, ! Соли фенола являются солями слабой карболовой кислоты и расщепляются карбоновой кислотой:
Фенолы
Фенолы — это гидроксисоединения, в молекулах которых OH-группы непосредственно присоединены к бензольному ядру.
В зависимости от числа OH-групп различают моноатомные фенолы (например, вышеупомянутый фенол и крезолы) и полиатомные. Среди многоатомных фенолов два атомных являются наиболее распространенными:
Как видно из приведенных выше примеров, фенолам характерны структурные изомеры (изомерия положения гидроксильной группы).
В фенолах Под влиянием электронной системы p бензольного кольца для атома кислорода предпочтительна гибридизация sp 2. В этом случае одна из неподеленных электронных пар находится на негибридизованной p-орбитали и может участвовать в связи с ароматической p-системой.
Электронные эффекты группы OH. Гидроксигруппа проявляет отрицательный индуктивный эффект (-I -эффект) по отношению к углеводородному радикалу и действует как замещающий акцептор электронов в спиртах. В фенолах, где группа OH расположена на sp 2 атоме углерода, она также проявляет положительный мезомерный эффект (+ M ), обеспечивая неподеленную пару кислородных электронов в сопряжении p-системы бензольного кольца ( аниме.2.3.1 ). Из-за большей подвижности p-электронов эффект + M сильнее эффекта — I, т.е. гидроксигруппа в фенолах является электронодонорным заместителем (отрицательный заряд атома кислорода является в феноле ниже, чем у одноатомных спиртов).
Сравните распределение электронной плотности (зарядов на атомах) в молекулах метанола. и фенола.
Реакции в связи O-H
Наиболее типичными реакциями гидроксисоединений при разрыве связи O-H являются следующие
Реакции, в которых атомы водорода замещаются металлом (кислотные свойства),
реакции замещения атома водорода на кислотный остаток (образование сложных эфиров),
реакции удаления водорода при окислении и дегидрировании.
Легкость протекания этих реакций и структура образующихся продуктов зависят от строения углеводородного радикала и взаимного влияния атомов.
Реакционная способность одноатомных спиртов в реакциях по связи O-H:
CH 3 OH > первичные > вторичные > третичный
Если группы OH в многоатомных спиртах находятся рядом с атомами углерода, то расщепление связи OH-H происходит легче, чем в одноатомных спиртах, из-за взаимного влияния этих групп (-I взаимодействие одной группы OH с другой).
Многоатомные спирты с не смежными группами OH обладают свойствами, аналогичными свойствам моноатомных спиртов (взаимное влияние групп OH отсутствует).
Фенолы более активны, чем спирты, в большинстве реакций OH-связывания, поскольку эта связь более полярна из-за смещения электронной плотности от атома кислорода к бензольному кольцу (которое содержит неподеленную пару электронов атома кислорода в системе p-связи).
Фенолы являются более сильными кислотами, чем спирты и вода, поскольку участие неподеленной пары кислородных электронов, соединенных с p-электронной системой бензольного кольца, увеличивает полярность связи O-H.
Если группы OH в многоатомных спиртах находятся рядом с атомами углерода, то расщепление связи OH-H происходит легче, чем в одноатомных спиртах, из-за взаимного влияния этих групп (-I взаимодействие одной группы OH с другой).
Содержание
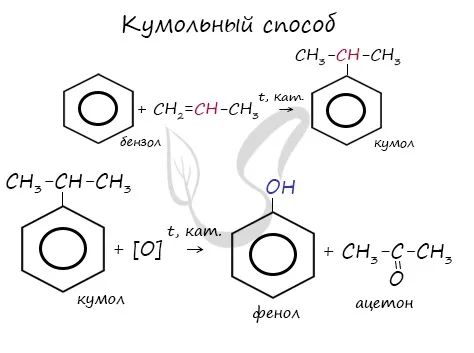
С 2006 года производство фенола был произведен в промышленных масштабах тремя способами:
- Кумольный метод. Этим способом получают более 95 % всего производимого в мире фенола. В водопаде барботажной колонны кений некаталитически окисляется воздухом до гидропероксида кения (ГПК). Полученный HPC разлагается при катализе серной кислотой с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
- Около 3 % всего фенола получают окислениемтолуола, с промежуточным образованием бензойной кислоты.
- Весь остальной фенол выделяют из каменноугольной смолы.
Пилотные испытания производственных установок фенола прямое окисление бензола оксидом азота и кислотное расщепление гидропероксида бутилтриптилбензола.
Фенол также может быть получен путем восстановления хинона.
Химические свойства
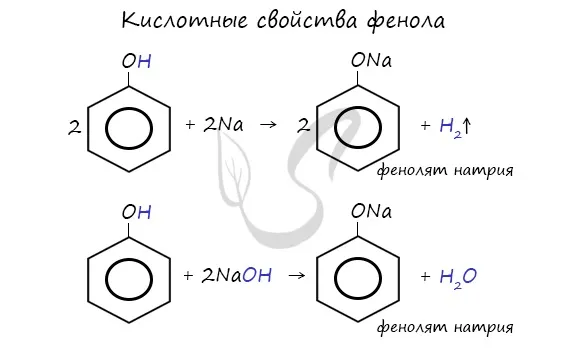
- Обладает слабыми кислотными свойствами, при действии щелочей образует соли — феноляты (например, фенолят натрия — C6H5ONa):
- Вступает в реакции электрофильного замещения по ароматическому кольцу. Гидрокси-группа, являясь одной из самых сильных донорных групп, увеличивает реакционную способность кольца к этим реакциям, и направляет замещение в орто- и пара-положения. Фенол с лёгкостью алкилируется, ацилируется, галогенируется, нитруется и сульфируется. .
- Взаимодействие с металлическим натрием:
- Взаимодействие с бромной водой (качественная реакция на фенол):
C6H5OH + 3Br2 (аква) → C6H2(Br)3OH + 3HBr образуется белое твердое вещество 2,4,6 Трибромофенол
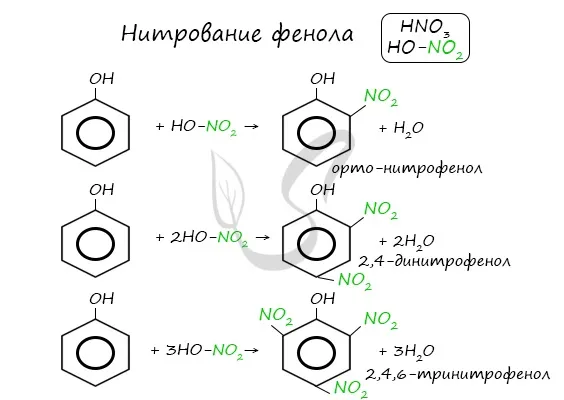
- Взаимодействие с концентрированной азотной кислотой:
- Взаимодействие с хлоридом железа (III)(качественная реакция на фенол):
6C6H5OH + FeCl3 → Fe(C6H5OH)6CI3 образует трихлоридфенолят Трихлорид железа (III) (III) (фиолетового цвета).
В 2006 году общемировой объем потребления составил фенола имеет следующий вид:
- 44 % фенола потребляется для производства кфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол;
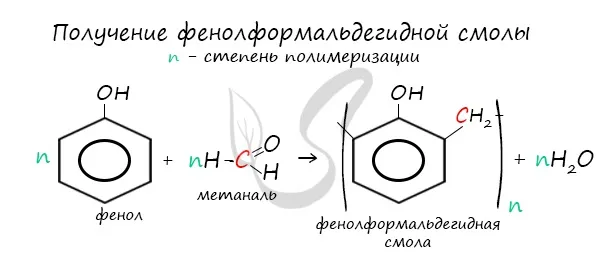
- 30 % фенола потребляется для производства к фенолформальдегидных смол;
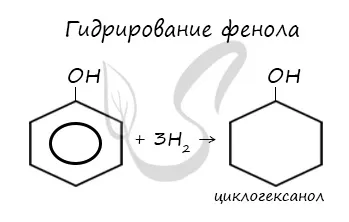
- 12 % фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон — нейлона и капрона;
- остальные 14 % расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ — полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолы), фармацевтические препараты (аспирин), антисептики (в сухом виде) и пестициды. Решение 1.4 % фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство.
Фенол и его производные отвечают за консервирующие свойства табака. Также фенол используется в качестве консерванта в вакцинах. Примером его использования в качестве антисептика является препарат Орасепт.
Его кислотные свойства сильнее, чем у фенола, потому что нитрогруппы удаляют электронную плотность с бензольного кольца и еще больше поляризуют связь O-H.
Фенолы
Фенолы — это оксигенированные ароматические соединения, молекулы которых содержат одну или несколько гидроксильных групп (OH), соединенных с бензольным кольцом.
Номенклатура фенолов
Атомы углерода в молекуле фенола начинайте в таком порядке, чтобы заместители занимали наименьшие номера (шли по кратчайшему пути). Обычно принято использовать тривиальное название «.фенол».
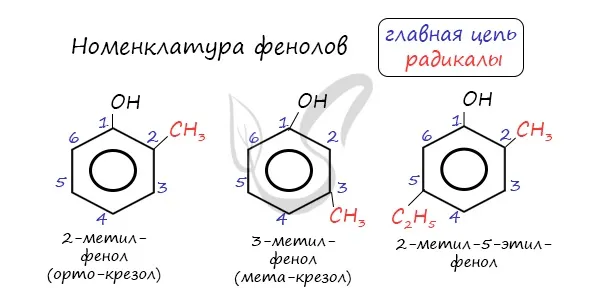
Следует помнить, что гидроксильная группа является ориентационной группой класса I (орто-, пара-ориентированной). Поэтому реакции галогенирования и нитрования происходят в орто- и пара-положениях.
Получение фенолов
При гидролизе галогенбензолов происходит обмен: Гидроксигруппа занимает место атома галогена.
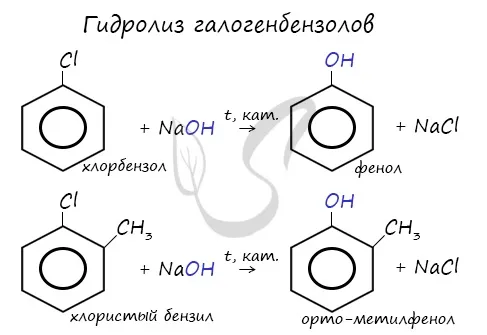
Этот процесс используется для производства 95 % всех галогенированных бензолов. фенола. В этой реакции кений (изопропилбензол) окисляется, в результате чего образуется фенол и ацетон.
Химические свойства фенолов
Щелочные металлы (Li, Na, K) могут вытеснять водород из фенолов с образованием солей — фенолятовал. В отличие от алифатических одноатомных спиртов, фенолы может реагировать со щелочами (KOH, LiOH, NaOH)
Реакция фенола с водой, содержащей бром, является качественным: выпадает белая суспензия — трибромистый остатокфенола.
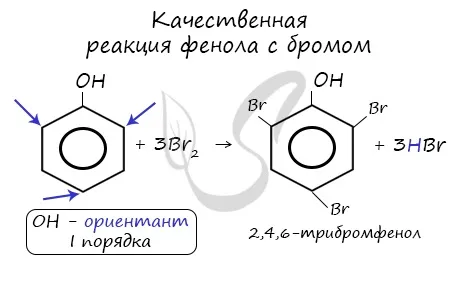
Реакция между фенолом В зависимости от типа замещения получается белый остаток тромида и азотной кислоты. В бензольном кольце появляется новый радикал — нитрогруппа. Важно отметить, что группа OH фенола является ориентирующим агентом класса I: замещение происходит в орто-, пара-положении.
При гидрогенизации двойные связи бензольного кольца разрываются, в результате чего образуется циклогексанол.
В промышленности широко используется реакция поликонденсации с формальдегидом. фенола Реакция формальдегида с формальдегидом с образованием смолоподобных полимеров (фенолфоформальдегидные смолы) и вода.
© Беллевич Юрий Сергеевич 2018-2022 гг.
Эта статья была написана Юрием Сергеевичем Беллевичем и является интеллектуальной собственностью Юрия Сергеевича Беллевича. Воспроизведение, распространение (включая копирование на другие сайты и интернет-ресурсы) или иное использование информации и объектов без предварительного разрешения правообладателя преследуется по закону. Для получения разрешения на использование данного материала и лицензии на него, пожалуйста, свяжитесь с Юрий Беллевич .
В промышленности широко используется реакция поликонденсации с формальдегидом. фенола Реакция формальдегида с формальдегидом с образованием смолоподобных полимеров (фенолфоформальдегидные смолы) и вода.
IV . Качественная реакция! — обнаружение фенола
Для обнаружения фенолов Используется качественная реакция с хлоридом железа(III). Один атом фенолы Монатомные соединения дают устойчивый сине-фиолетовый цвет из-за образования железосодержащих комплексных соединений.
Видео эксперимент » Качественная реакция на фенол »
Образование фиолетового цвета при добавлении раствора FeCl3 служит качественной реакцией. на фенол:
Для фенолов Реакции связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неделимой пары электронов в системе сопряжения.
Теги: фенолы
Мне нравится ваш сайт. Но в этом году я встретил в других источниках утверждение, что «фенол Он НЕ меняет цвет маркера», хотя в учебниках разных уровней говорится, что «фенол он разделяется на катионы водорода. » КАК это было доказано? Только при реакции со щелочью? Я не в состоянии проверить это экспериментальным путем, но я был уверен, что. р-р фенола «достаточно кислоты» и изменит цвет лития. КАК это делается?
1. Подобно кислотам фенол В водных растворах он разделяется в зависимости от типа кислоты: на фенолят-ионы и ионы водорода. Фенол растворяется обратимо, НО… сила его кислотных свойств достаточна, чтобы изменить цвет индикатора (в растворе) фенола лакмус краснеет).
Старинное название фенола — Карболовая кислота.
2. его кислотные свойства фенола Реагирует с активными металлами и их гидроксидами с образованием…. фенолятов (солей фенола).
3. соли фенолов легко разлагаются кислотами, даже слабыми, такими как угольная кислота. Из этого следует, что фенол — более слабая кислота, чем H2CO3.
C6H5ONa + CO2 + H2O → C6H5ON + NaHCO3
4. соли фенола гидролизуются как соли слабой кислоты и сильного основания.








