Активно реагирует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфаты бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Оксид бария используется для приготовления особого вида стекла, применяемого для покрытия урановых стержней. Одно из наиболее часто используемых стекол имеет следующий состав (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). Фосфат также используется в производстве стекла для атомной промышленности. бария.
Что такое барий
(Барий, от греч. barium), Ba — химический элемент 2 группы (устаревший химический элемент II группы периодической таблицы элементов), ат. н. 56, ат. м 137,34. Это серебристо-белый металл. В соединениях он имеет степень окисления +2. Природный барий состоит из семи стабильных изотопов, среди которых преобладает изотоп 138Ba (71,66 %). В 1774 году шведский химик К. Шееле открыл барий в виде оксида.
Металлический барий Оно было присвоено барию в 1808 году английским химиком Г. Дэви. Содержание бария в земной коре составляет 5 x 10 % и не встречается в свободном виде в природе. Промышленно используемые минералы включают кобальт, виттерит и менее распространенный виттерит. барит Веттерит, реже — витерит.
Физические свойства бария
Кристаллическая решетка бария Кубический, с центром объема и периодом a = 5,019 A, плотность 3,76 г/см3, tпл 710° C; tтемпература кипения 1637 -1640°С, температурный коэффициент линейного расширения (температура 0 — 100°С) 1,9 — 10 градусов, удельная теплоемкость 0,068 кал/г — градусов, удельное электрическое сопротивление 6 — 10 — 5 Ом — см, твердость по Бринеллю 4,2, по шкале Мооса 2.
Барий — это мягкий, серебристо-белый металл с бледно-желтым оттенком, имеющий символ Ba. Он имеет умеренный удельный вес и является очень хорошим проводником электричества. Трудно улучшить барий, Поэтому большинство его свойств пока неизвестны.
Когда барий Хранящийся при комнатной температуре, он имеет кубическую структуру, является очень мягким металлом и быстро расширяется при нагревании. Элемент бария имеет температуру плавления 1000 К или 730 °C или 1340 °F, в то время как температура кипения при бария составляет 2170 К или 1900 °C или 3450 °F.
Интересный факт о барие: Из соединений бария Наиболее ценным элементом является титанат бария — Один из самых важных сегнетоэлектриков.
Сульфат представляет интерес в медицине. бария. Он используется в медицине благодаря своей способности поглощать рентгеновские лучи.бариева Он используется при рентгенографии желудочно-кишечного тракта.
Химические свойства бария
Его химические свойства сходны со свойствами кальция, стронция и радия. Он быстро окисляется на воздухе. При нагревании на воздухе легко воспламеняется и горит. Сильно разлагает воду.
Образует гидрид водорода Ван2. Сочетается непосредственно с азотом, серой и галогенами. Основное сырье для производства бария и его соединения барит, который восстанавливается углеродом в пламенных печах.
Полученный растворимый сульфид перерабатывается в соли других металлов. бария полученный растворимый сульфид перерабатывается в соли других металлов.
Барий немного тверже свинца и мягче цинка. Свободный блестит серебристо-белым цветом, но при контакте с воздухом теряет блеск и появляется сначала коричневато-желтая, а затем сероватая пленка — смесь оксида, пероксида и нитрида: ВаО, ВаО2 и Ба3N2 .
При образовании всех трех веществ выделяется большое количество тепла. Самый стабильный пероксид бария ВаО2 образуется из оксида при нагревании до 500 °C, но при 800 °C BaO2 разлагается на оксид и кислород, который раньше использовался для извлечения кислорода из воздуха.
Пероксид стронция SrO2 гораздо сложнее и менее стабильна, чем WAO2. Пероксиды, такие как BaO, могут быть получены под действием кислорода под давлением и при высоких температурах.4.
Взаимодействие металлов низких подгрупп с водородом происходит при нагревании и приводит к образованию твердых гидридов ионного типа: СаН2, SrH2, BaH2
Барий — относительно распространенный элемент. Он является компонентом многих минералов, которые трудно растворяются. Его наиболее важными физическими соединениями являются BaCO3 и тяжелый полевой шпат.
Барий химически менее активен, чем кальций и стронций и реагирует в то время как у неметаллов они более выражены. Даже при нормальной температуре он реагирует с оксидом углерода (IV). он реагирует с оксидом углерода (IV):
При высоких температурах Ba восстанавливает оксид углерода (II):
Оксид бария BaO с водой дает щелочную (баритовая вода):
а пероксид бария ВаО2 Он используется для получения перекиси водорода в обратной реакции:
Равновесие немного смещается вправо, также под воздействием кислот, таких как карбоновая кислота:
В следующей таблице приведены химические свойства бария.
| Символ бария | В следующей таблице приведены химические свойства бария: |
| Для явления карбоновой кислоты в периодической таблице приведены следующие свойства. | Барий является пятым элементом группы 2 периодической таблицы. |
| Атомный номер бария | Атомный номер бария 56. |
| Атомный вес Ba или молекулярная масса Ba | Атомная масса бария составляет 137,327 г/моль. |
| Молекулярная формула бария | Молекулярная формула бария Ba +2 |
Поскольку металл нестабилен на воздухе, его хранят под слоем парафина. Сульфат бария для рентгеновской дифракции BaSO4 нерастворим ни в воде, ни в слабой соляной кислоте (как в желудочном соке) и используется в радиологии из-за своей низкой растворимости.
Металлический барий — Сильный восстановитель. Он был использован для восстановления хлорида америция (1100°) и фторида кария (1300°) для получения элементов америция (N 95) и кария (N 96). При высокой температуре барий он восстанавливает оксид углерода и высвобожденный углерод реагирует с барием с образованием карбида BaS>2>.
Природный барий состоит из смеси семи стабильных изотопов: 130 Ba, 132 Ba, 134 Ba, 135 Ba, 136 Ba, 137 Ba, 138 Ba. Последний является наиболее распространенным (71,66 %). Известны также радиоактивные изотопы. бария, Самым важным из них является 140 Ba. Он образуется при распаде урана, тория и плутония.
Основное сырье для производства бария — баритовпредставляет собой концентрат (80-95 % BaSO4), который, в свою очередь, получается из флотации барита. Сульфат бария а затем восстанавливается коксом или газом:
Сульфид далее восстанавливается до гидроксида при нагревании. бария Ba(OH)2 или под действием CO2 на нерастворимый карбонат бария BaCO3который затем превращается в монооксид углерода под действием углекислого газа бария BaO (закалка при 800 °C для Ba(OH)2 и выше 1000 °C для BaCO3):
Металлический барий восстанавливается из оксида восстановлением алюминием в вакууме при 1200-1250 °C:
Очищают барий Вакуумная дистилляция или зонная плавка.
Химические свойства
Барий является щелочноземельным металлом. Быстро окисляется на воздухе барий быстро окисляется с образованием смеси оксидов бария BaO и нитрид бария Ba3N2При небольшом нагревании он легко воспламеняется. Энергия реагирует С водой образует гидроксид бария Ba(ОН)2:
Активно реагирует с разбавленными кислотами. Многие соли бария нерастворимы или малорастворимы в воде: сульфаты бария BaSO4, сульфит бария BaSO3, карбонат бария BaCO3, фосфат бария Ba3(PO4)2. Сульфид бария BaS, в отличие от сульфида кальция CaS, хорошо растворим в воде.
Он легко реагирует с галогенами, образуя галогениды.
При нагревании с водородом образует гидрид бария BaH2который, в свою очередь, реагирует с гидридом лития LiH с образованием комплекса LiBaH.3.
При нагревании он вступает в реакцию с аммиаком:
Нитрид бария Ba3N2 При нагревании он вступает в реакцию с CO с образованием цианида:
С жидким аммиаком он образует темно-синий раствор, из которого выделяется аммиакаль Ba(NH3)6который светится золотистым светом и легко образуется при отщеплении NH3. В присутствии платинового катализатора аммониевая соль разлагается до амида. бария:
Карбид бария BaC2 Он может быть получен путем нагревания BaO с углеродом в электродуговой печи.
Барий восстанавливает оксиды, галогениды и сульфиды многих металлов до соответствующего металла.
Качественный и количественный анализ
Качественно в решениях барий обнаруживается путем выпадения в осадок солей сульфата бария BaSO4который отличается от соответствующих сульфата кальция и сульфата стронция чрезвычайно низкой растворимостью в неорганических кислотах.
Родизонат натрия, осажденный из нейтральных солей бария Характерный красновато-коричневый осадок родизоната. бария. Реакция очень чувствительна и специфична и позволяет определить 1 часть иона бария в 210000 частей по массе раствора 4 .
Соединения бария окрашивает пламя в желтовато-зеленый цвет (длина волны 455 и 493 нм).
Количественно барий определяется гравиметрически как BaSO4 или BaCrO4.
Физическое свойство, такое как пластичность, не препятствует барию разлетелись от удара. Твердость этого металла составляет 1,25 по шкале Мооса. Магазин бария требует определенной среды. Эта среда обеспечивается парафином или слоем парафина, которым покрыт металл.
Качественный и количественный анализ
Качественно в решениях барий обнаруживается путем выпадения в осадок солей сульфата бария BaSO4который отличается от соответствующих сульфата кальция и сульфата стронция чрезвычайно низкой растворимостью в неорганических кислотах.
Родизонат натрия, осажденный из нейтральных солей бария Характерный красновато-коричневый осадок родизоната. бария. Реакция очень чувствительна и специфична и позволяет определить 1 часть иона бария на 210 000 частей по массе раствора.
Соединения бария Он окрашивает пламя в желтовато-зеленый цвет (длина волны 455 и 493 нм).
Количественно барий определяется гравиметрически как BaSO4 или BaCrO4.
Применение
Металлический барий, часто используется в алюминиевых сплавах в качестве геттера в высоковакуумном электронном оборудовании.
Оксид бария, В твердом растворе оксидов других щелочноземельных металлов — кальция и стронция (CaO, SrO) — он используется в качестве активного слоя катодов косвенного накала.
Барий добавляется в металлы для жидкостного охлаждения (сплавы натрия, калия, рубидия, лития и цезия) вместе с цирконием для снижения агрессивности этих металлов в трубопроводах и металлургии.
Сегментированные и пьезоэлектрические
Титанат бария Используется как диэлектрик при производстве керамических конденсаторов и как материал для пьезоэлектрических микрофонов и пьезокерамических излучателей.
Фторид бария Используется в виде монокристаллов в оптике (линзы, призмы).
Пероксид бария Он используется в фейерверках и в качестве окислителя. Нитраты бария и хлорат бария используется в пиротехнике для окрашивания пламени (зеленый огонь).
Хромат бария используется для производства водорода и кислорода с помощью термохимического процесса (цикл Ок-Ридж, США).
Пероксид бария вместе с оксидами меди и редкоземельными металлами, а также солями карпа бария, используется для синтеза сверхпроводящей керамики, работающей при температурах жидкого азота и выше.
Оксид бария используется для приготовления особого вида стекла, применяемого для покрытия урановых стержней. Одно из наиболее часто используемых стекол имеет следующий состав (оксид фосфора — 61 %, BaO — 32 %, оксид алюминия — 1,5 %, оксид натрия — 5,5 %). Фосфат также используется в производстве стекла для атомной промышленности. бария.
Химические источники энергии
Фторид бария используется в твердотельных фторсодержащих батареях в качестве компонента фторсодержащего электролита
Оксид бария используется в высокоэффективных медно-оксидных батареях в качестве компонента активной массы (оксид бария-окись меди).
Сульфат бария используется в производстве свинцово-кислотных аккумуляторов в качестве наполнителя активной массы отрицательного электрода.
Медицинское применение
Сульфат бария, Нерастворимый и нетоксичный. Он используется в качестве рентгеноконтрастного вещества при медицинских исследованиях желудочно-кишечного тракта.
Металлические ценности барий в слитках с чистотой 99,9 % составляет около 30 долларов за 1 кг.
Биологическая роль и токсичность
Биологическая роль бария не была изучена в достаточной степени. Он не включен в список основных микроэлементов.
Все водорастворимые соединения являются бария очень токсичны. Из всех солей хлорид является наиболее опасным, поскольку он хорошо растворим в воде. бария Опасен хлор, а также нитраты, нитриты, фториды, йодиды, бромиды, сульфаты, хлориды и перхлориды. Водорастворимые соли бария быстро всасываются в кишечнике. Смерть может наступить в течение нескольких часов из-за паралича сердца.
Симптомы острого отравления солью барияСлюнотечение, жжение во рту и пищеводе. Боль в животе, спазмы, тошнота, рвота, диарея, высокое кровяное давление, неровный пульс, судороги, позднее паралич, бледность лица и конечностей (холодные конечности), обильный холодный пот, мышечная слабость, особенно в конечностях, вплоть до того, что отравившийся не может пошевелить головой. Нарушения походки и речи вследствие паралича мышц глотки и языка. Одышка, головокружение, шум в ушах, нарушения зрения.
При тяжелом отравлении смерть наступает внезапно или в течение одного дня. Тяжелое отравление наступает после приема внутрь 0,2-0,5 г соли. бария, Смертельная доза 0,8-0,9 г.
Первая помощь должна быть оказана путем промывания желудка 1%-ным раствором сульфата натрия или сульфата магния. Клизма с 10% раствором тех же солей. Пероральный прием раствора тех же солей (20,0 частей соли на 150,0 частей воды) по столовой ложке каждые 5 минут. Рвота для удаления нерастворимого сульфата, образующегося в желудке. бария. Внутривенно с 10-20 мл 3% раствора сульфата натрия. Подкожно — камфора, кофеин, лобелин — по показаниям. Тепло в ногах. В слизистых супах и молоке.
- Барий (Ba)
- Азид бария (Ba(N3)2) Тринидрид бария
- Амид бария (Ba(NH2)2) Амид бария
- Арсенид бария (Ba3As2) Барий мышьяковистый
- Аурат бария (BaAuO22) Аурат бария
- Ацетат бария (Ba(CH3COO)2) Барий уксуснокислый
- Бромат бария (Ba(BrO3)2) Барий бромноватокислый
- Бромид бария (BaBr2) Барий бромистый
- Вольфрамат бария (BaWO4) Барий вольфрамовокислый
- Гексаборид бария (BaB6) Барий бористый
- Гексацианоферрат II бария (Ba2Fe(CN)6) Гексацианоферроат бария
- Гидрид бария (BaH2) Барий водородистый
- Гидроксид бария (Ba(OH)2) Едкий барий
- Гидросульфид бария (Ba(HS)2) Сернистый барий кислый
- Гидрофосфат бария (BaHPO4) Фосфорнокислый барий кислый
- Гипонитрит бария (BaN2O2) Барий азотноватистокислый
- Дигидрофосфат бария (Ba(H2PO4)2) Барий фосфорнокислый однозамещённый
- Дитионат бария (BaS2O6) Барий дитионовокислый
- Йодат бария (Ba(IO3)2) Барий йодноватокислый
- Йодид бария (BaI2) Барий йодистый
- Карбид бария (BaC2) Барий углеродистый
- Карбонат бария (BaCO3) Барий углекислый
- Манганат бария (BaMnO4) Барий марганцовистокислый
- Молибдат бария (BaMoO4) Барий молибденовокислый
- Нитрат бария (Ba(NO3)2) Барий азотнокислый
- Нитрид бария (Ba3N2) Барий азотистый
- Нитрит бария (Ba(NO2)2) Барий азотистокислый
- Оксалат бария (BaC2O4) Барий щавелевокислый
- Оксид бария (BaO) Барий окись
- Оксид иттрия-бария-меди (YBa2Cu3O7−x) YBCO
- Перманганат бария (Ba(MnO4)2) Барий марганцовокислый
- Пероксид бария (BaO2) Перекись бария
- Пероксодисульфат бария (BaS2O6(O2)) Барий надсернокислый
- Перхлорат бария (Ba(ClO4)2) Барий хлорнокислый
- Пирофосфат бария (Ba2P2O7) Барий фосфорнокислый пиро
- Селенат бария (BaSeO4) Барий селеновокислый
- Селенид бария (BaSe) Барий селенистый
- Силикат бария (BaSiO3) Барий кремнекислый
- Сульфат бария (BaSO4) Барий сернокислый
- Сульфид бария (BaS) Барий сернистый
- Сульфит бария (BaSO3) Барий сернистокислый
- Тиосульфат бария (BaSO3S) Гипосульфит бария
- Тиоцианат бария (Ba(SCN)2) Барий роданистый
- Титанат бария (BaTiO3) Барий титановокислый
- Формиат бария (C2H2BaO4) Барий муравьинокислый
- Фосфат бария (Ba3(PO4)2) Барий фосфорнокислый
- Фосфид бария (Ba3P2) Барий фосфористый
- Фторид бария (BaF2) Барий фтористый
- Хлорат бария (Ba(ClO3)2) Барий хлорноватокислый
- Хлорид бария (BaCl2) Барий хлористый
- Хромат бария (BaCrO4) Барий хромовокислый
- Цианид бария (Ba(CN)2) Барий цианистый
- Цирконат бария (BaZrO3) Барий цирконивокислый
Барий — относительно распространенный элемент. Он является компонентом многих минералов, которые трудно растворяются. Его наиболее важными физическими соединениями являются BaCO3 и тяжелый полевой шпат.
Металл из минералов ?
В получении бария Лидером является Китай (более 50 %).
Существует множество применений бария и его соединений.
| Соединение бария | Приложения |
| Хроматы и соли марганца | Добавки для производства резины и бумаги. Хорошие пигменты |
| Титан | Хороший ферроэлектрик |
| Оксиды, пероксиды, гидроксиды | В пиротехнике; в производстве перекиси водорода |
| Перхлорат | Отличный влагопоглотитель |
| Цианид платины | Для производства флуоресцентных экранов |
| Цирконат | Обладает хорошими огнеупорными свойствами; используется в керамике |
| Сульфид | Для производства соли бария |
| Ацетат | Для окрашивания ситца и шерстяных тканей |
Активный металл используется для производства печатной продукции. Металл является компонентом антифрикционного сплава.

Барий — относительно распространенный элемент. Он является компонентом многих минералов, которые трудно растворяются. Его наиболее важными физическими соединениями являются BaCO3 и тяжелый полевой шпат.
Процесс получения
Он используется в качестве основного сырья в производственном процессе. бария Он используется в качестве основного сырья в производственном процессе. баритовконцентрат состоит на 80-95 % из сульфата (или сульфата железа). бариевыСерная кислота (то же, что и серная кислота). барий). Концентрат получают путем флотации (обогащения) барита — минерала, известного как «тяжелый меч».

Для последующего снижения бариевоЗатем сульфат восстанавливается в процессе производства либо с помощью кокса, либо с помощью газа. Затем сульфат нагревают для гидролиза с образованием гидроксида каустика. барита — бариевоГидроксид. Альтернативно (вместо нагревания и гидролиза) сульфид преобразуется в в бариевыв нерастворимый карбонат под действием углекислого газа.
Следующим шагом является преобразование полученного вещества в бариевыy оксид BaO. Для этого его прокаливают. Температура, необходимая для прокаливания карбоната, составляет более 1000 градусов Цельсия, тогда как для гидроксида достаточно 800 градусов Цельсия.
Последний этап в процессе производства металлических бария — это электролиз расплавленного бариевобезводный хлорид. Вещество распадается на составляющие его компоненты — барий и хлор отделяются друг от друга. Химическое уравнение, отражающее этот шаг, максимально простое.

Этот металл используется в различных отраслях промышленности. В электровакуумном оборудовании он играет роль блеска или, проще говоря, газопоглотителя. В металлургии и производстве охлаждающих жидкостей используется в качестве антикоррозийного агента.
Помимо этого, барию Его можно найти в следующих приложениях:
- оптической;
- пиротехнической;
- медицинской и других.
Конечно, это далеко не все варианты применения.
Воздействие на человека
Несмотря на широкое применение, это, конечно, не все области применения, но и не во всех случаях. бария используется в самых разных областях, его биологическая роль до сих пор малоизвестна. Он не классифицируется как жизненно важный микроэлемент. Напротив, его воздействие на организм человека может быть смертельно опасным.
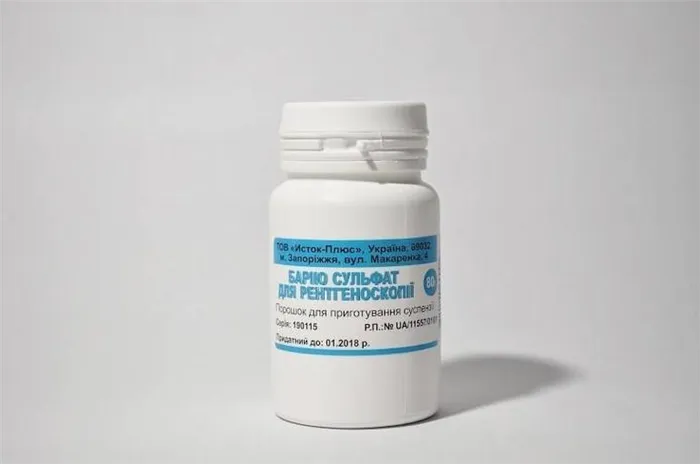
В медицине он используется только бариевыВ медицинской сфере это единственный сульфат, который нетоксичен и нерастворим. С точки зрения бариевыx Соединения, растворимые в воде, очень токсичны. Абсолютно все они токсичны и вредны для человеческого организма.
В зависимости от степени отравления бариевыЧеловек может умереть в течение нескольких часов (максимальный летальный период при остром отравлении составляет один день), поэтому при контакте с такими соединениями следует соблюдать особую осторожность и использовать их только по назначению.








