Кипит при 184 0 C, замерзает при -6 0 C. При окислении становится красновато-коричневым. Молярная масса составляет 93 г/моль. Его плотность при 20 0 °C составляет 1,02173 г/см3 .
Анилин — Aniline
Если не указано иное, данные о материале относятся к нормальному состоянию (при 25 °C 77 °F, 100 кПа).
Анилин — это органическое соединение формулы C6ЧАС5NH2. Он состоит из фенильной группы, присоединенной к аминогруппе, анилин — простейший ароматический амин. Это промышленно важный коммерческий химический продукт и универсальный исходный материал для синтеза тонких химических веществ. В основном используется для производства прекурсоров полиуретана, красителей и других промышленных химикатов. Как и большинство летучих аминов, он имеет запах тухлой рыбы. Он очень огнеопасен и горит дымным пламенем, характерным для ароматических соединений. 6
В химическом отношении он является богатым электронами производным бензола и поэтому быстро реагирует в реакции электрофильного ароматического замещения. Он также подвержен окислению: в то время как свежеочищенный анилин представляет собой почти бесцветное масло, воздействие воздуха приводит к постепенному потемнению образца (до желтого или красного цвета) из-за образования сильно окрашенных окисленных примесей. Анилин может быть диазотирован для получения соли диазония, которая затем может подвергаться различным реакциям нуклеофильного замещения.
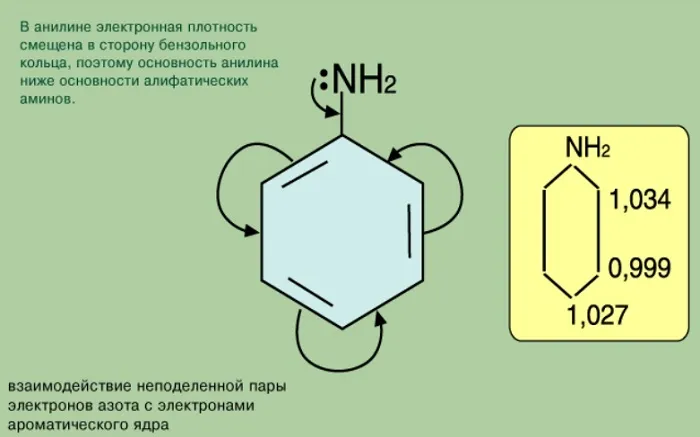
Как и другие амины, анилин является основой (K ах = 4,6) и нуклеофилен, хотя он является более слабым основанием и нуклеофилом, чем структурно сходные алифатические амины.
Содержание
Анилин представляет собой слегка пирамидальную молекулу с гибридизацией азота между sp 3 и zr 2. Это приводит к тому, что неразделенная пара азота оказывается на гибридной sp. x орбитали с высоким значением p. Аминогруппа в анилине более плоская (т.е. это «меньшая пирамида»), чем у алифатического амина, из-за связи одиночной пары с арильным заместителем. Наблюдаемая геометрия отражает компромисс между двумя конкурирующими факторами: 1) стабилизация неделимой N-пары на орбиталях со значительным s-символом способствует пирамидализации (орбитали с s-символом имеют более низкую энергию), и 2) расфокусировка неделимой N-пары в арильном кольце способствует плоскостности (неделимая пара на чистой p-орбитали приводит к лучшему перекрыванию с орбиталями p-системы бензольного кольца). 7
В соответствии с этими факторами, замещение анилины с электронодонорными группами имеет более пирамидальную форму, в то время как как анилины с электроноакцепторными группами более плоские. В прототипе анилине Некоммутативная пара составляет около 12% от символа s, что соответствует гибридизации sp 7.3. 7 (Для сравнения, алкиламины обычно имеют неподеленную пару на орбиталях, близких к sp 3).
Пирамидальный угол между связью C-N и биссектрисой угла H-N-H составляет 142,5°. 8 (Для сравнения, это значение для более пирамидального метиламина составляет ~ 125°, в то время как плоский азот, например формамид, имеет угол 180°). Расстояние C — N соответственно короче. В анилине Длина связи C — N составляет 1,41 Å, 9 по сравнению с 1,47 Å для циклогексиламина, 10 что указывает на частичную π-связь между N и C. 11
Производство
Промышленное производство анилина состоит из двух этапов. Сначала бензол нитруется концентрированной смесью азотной и серной кислот при температуре 50-60 °C для получения нитробензола. Затем нитробензол гидрируют в присутствии металлических катализаторов (обычно при температуре 200-300 °C): 12
Восстановление нитробензола до анилина впервые была проведена в 1842 году Николаем Зининым с использованием неорганического сульфида в качестве восстановителя (реакция Зинина). Восстановление нитробензола до анилина также была проведена в рамках восстановления Антуаном Бешампом в 1854 году с использованием железа в качестве восстановителя (восстановление Бешампа).
В качестве альтернативы анилин можно получить фенол из аммиака и фенол из кумола. 6
Коммерчески доступны три качества анилина: анилиновсинее масло, которое является чистым анилин; анилиноволивковое масло для красного цвета, которое представляет собой смесь равных количеств анилина и орто- и пара-толуидины, и анилиноволивковое масло на шафранин, который содержит анилин и орто- и пара-толуидином и получают путем перегонки фуксинового расплава (échappés). 13
Связанный анилин производные
Известно много аналогов анилина, в которых фенильная группа является дополнительно замещенной. К ним относятся толуидины, ксилидины, хлороанилины, аминобензойные кислоты, нитроанилины, и многие другие. Их часто получают путем нитрования замещенных ароматических соединений и последующего восстановления. Этот подход используется, например, для превращения толуола в толуидины и хлорбензола в 4-хлоранилин. 6 В качестве альтернативы арилгалогениды можно обогатить водным или газообразным аммиаком, используя комбинацию Бухвальда-Хартвига или реакцию Ульмана. 14
При остром отравлении анилином, важна правильная последовательность оказания первой помощи. Начинать следует с прекращения приема яда внутрь:
I . Основные свойства
Снижение электронной плотности у атома азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин является более слабым основанием, чем ненасыщенные амины и аммиак.
Поэтому анилин Он реагирует только с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует гидроксид с водой, а его водный раствор не окрашивает литий в синий цвет.
Анилин с водой не реагирует и не изменяет цвет индикатора.
Видеоэксперимент «Исследование среды раствора анилина»
Соли анилина, в отличие от анилина, хорошо растворим в воде.
II . Особые свойства анилина
Реакции с аминогруппой
1. взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами с образованием фениламмониевых солей, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
Видеоэксперимент «Взаимодействие анилина с соляной кислотой»
Анилин, который практически нерастворим в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин Он хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин он будет свободно выпадать в осадок:

Реакции с бензольным ядром
Аминогруппа как заместитель типа I облегчает реакции замещения в бензольном ядре с заместителями в орто- и пара-положениях к аминогруппе.
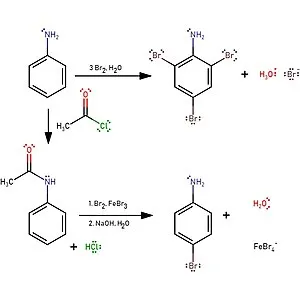
При бромировании анилин Легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине. анилин легко окисляется.
1. галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброма.анилина. Эта реакция может быть использована для качественного и количественного определения анилина:
Качественная реакция на анилин!
2. сульфонирование
Сульфаниловая кислота является важным промежуточным продуктом для синтеза фармацевтических препаратов (сульфаниламидных составов).
III . Окисление анилина
Анилин легко окисляется различными окислителями и образует различные соединения, поэтому он темнеет при хранении.
Когда известь Ca(Cl)OCl в водном растворе воздействует на анилина возникает сильное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоэксперимент: «Окисление с анилина с раствором отбеливателя — качественная реакция
При взаимодействии анилина С помощью хромовой извести (смесь концентрированной серной кислоты и дихромата калия K2Cr2O7) образует черный осадок, называемый черным. анилином (краситель «анилиновый черный»).
Черный анилин Используется как сильный краситель (для окрашивания тканей и мехов в черный цвет). Обычно ткань сначала погружают в окисляющий раствор. Полученный черный анилин оседает в порах волокон. Он нерастворим в воде, устойчив к воздействию мыла и света.
Видеоэксперимент: «Окисление с анилина с раствором дихромата калия — производство красителей
Анилин реагирует с сильными кислотами с образованием фениламмониевых солей, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
I . Основные свойства
Снижение электронной плотности у атома азота приводит к снижению способности отщеплять протоны от слабых кислот.
Анилин является более слабым основанием, чем ненасыщенные амины и аммиак.
Поэтому анилин Он реагирует только с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует гидроксид с водой, а его водный раствор не окрашивает литий в синий цвет.
Анилин с водой не реагирует и не изменяет цвет индикатора.
Соли анилина, в отличие от анилина, хорошо растворим в воде.
II . Особые свойства анилина
Реакции с аминогруппой
1. взаимодействие с кислотами (образование солей)
Анилин реагирует с сильными кислотами с образованием фениламмониевых солей, которые растворимы в воде, но нерастворимы в неполярных органических растворителях:
Видеоэксперимент «Взаимодействие анилина с соляной кислотой»
Анилин, который практически нерастворим в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси.
Солянокислый анилин Он хорошо растворим в воде. Если к такому раствору добавить достаточное количество щелочи, то анилин он будет свободно выпадать в осадок:

Реакции с бензольным ядром
Аминогруппа как заместитель типа I облегчает реакции замещения в бензольном ядре с заместителями в орто- и пара-положениях к аминогруппе.
При бромировании анилин Легко образует 2, 4, 6 — тризамещенные продукты реакции. По той же причине. анилин легко окисляется.
1. галогенирование
Анилин энергично реагирует с бромной водой с образованием белого осадка 2,4,6-триброма.анилина. Эта реакция может быть использована для качественного и количественного определения анилина:
Качественная реакция на анилин!
2. сульфонирование
Сульфаниловая кислота является важным промежуточным продуктом для синтеза фармацевтических препаратов (сульфаниламидных составов).
III . Окисление анилина
Анилин легко окисляется различными окислителями и образует различные соединения, поэтому он темнеет при хранении.
Когда известь Ca-(Cl)-OCl смешивается с водным раствором анилина возникает сильное фиолетовое окрашивание.
Качественная реакция на анилин!
Видеоэксперимент: «Окисление с анилина с раствором отбеливателя — качественная реакция
При взаимодействии анилина С помощью хромовой извести (смесь концентрированной серной кислоты и дихромата калия K2Cr2O7) образует черный осадок, называемый черным. анилином (краситель «анилиновый черный»).
Черный анилин Используется как сильный краситель (для окрашивания тканей и мехов в черный цвет). Обычно ткань сначала погружают в окисляющий раствор. Полученный черный анилин оседает в порах волокон. Он нерастворим в воде, устойчив к воздействию мыла и света.
Напротив, электронная плотность увеличивается в бензольном кольце, более выраженно в орто- и пара-положениях. Аминогруппа является ориентатором I типа (донором электронов).
Физические и химические свойства
Формула анилина — C6H5NH2 содержит аминогруппу, поэтому вещество называется фениламин. Его также называют аминобензолом, поскольку он содержит бензольную группу.
Что касается его физических свойств анилин — Это бесцветная маслянистая жидкость, легко растворимая в воде. Имеет неприятный аммиачный запах. При горении горит ярким, коптящим пламенем. Температура кипения анилина составляет 184,4 °C. Он огнеопасен и может образовывать взрывоопасные соединения при нагревании выше 70 °C. В воздухе анилин он легко окисляется и становится красновато-коричневым.
Благодаря своим химическим свойствам, он реагирует с сильными неорганическими кислотами (соляной, серной, фосфорной) и образует соли.
Применение
Анилин — одно из первых органических соединений, полученных искусственным путем. Его открытие привело к созданию многих успешных производств.
В промышленности
Промышленное использование анилина охватывает самые разные отрасли — от производства ракетного топлива до чистки обуви.
Анилин и его соединения используются в промышленности:
- полиуретанов (конструкционные материалы, тепло- и звукоизоляция);
- ускорителей для вулканизации на основе натурального и синтетических каучуков (шины, резинотехнические изделия, резиновая обувь);
- красителей для тканей;
- эпоксидных полимеров;
- взрывчатых веществ;
- ингибиторов коррозии металлов;
- моторного топлива;
- смол, лаков.
Красители на основе анилина Они придают интенсивный цвет натуральным и синтетическим тканям, коже, шерсти и шкурам. Однако основным недостатком этого красителя является выгорание на солнце и низкая водостойкость.

Анилин и его соединения являются сырьем для производства композитных промежуточных продуктов. В дополнение к их основному применению, анилин используется в производстве гербицидов, пестицидов, фунгицидов, печатных красок, фотографических реактивов и парфюмерии.
В медицине
Анилин является исходным материалом для фармацевтической промышленности. Препараты, изготовленные на его основе, обладают следующими эффектами:
- обезболивающее, жаропонижающее — анальгин, бутадион;
- антимикробное — этазол, сульфален, сульгин, сульфаниламид, бисептол;
- нейролептическое — аминазин, пропазин.
Производные анилина они входят в состав лекарственных красителей. Метиленовый синий обладает антисептическим и обезболивающим действием. Горечавка фиолетовая используется как антибактериальное, антгельминтное и противовоспалительное средство для местного применения. Фуксин используется для местного лечения гнойничковых и грибковых заболеваний кожи и себореи. Красители используются в бактериологических исследованиях для окрашивания микроорганизмов.
Действие на организм человека
Анилин — это сильный яд, который очень токсичен для человека. Отравление чаще всего происходит при всасывании вещества через дыхательные пути, неповрежденную кожу и слизистые оболочки — ротовую полость, глаза. Небольшое количество может попасть в желудок.
В основном он выводится из организма через почки. Остальная часть выводится через дыхательную систему.
Анилин является гемотоксином, т.е. вреден для крови человека. Механизм анилиновотравления является образование метгемоглобина, разрушение красных кровяных телец. Нарушается транспорт кислорода, что приводит к повреждению центральной нервной системы.
В дополнение к инактивации гемоглобина, токсичность анилина наблюдается развитие острой дыхательной, сердечно-сосудистой, почечной и печеночной недостаточности.
Накапливается анилин в печени и жировой ткани, создавая депо. Горячий душ, сауна, баня и употребление алкоголя могут привести к тому, что токсин из депо снова попадет в кровь, ухудшая состояние даже через две недели.









