Гидроксид калия — КОН — также представляет собой твердое белое вещество, которое хорошо растворяется в воде и выделяет много тепла.
Щелочи: понятие, свойства и применение
Щелочи — это растворимые в воде и сильные основания. Сегодня химическая теория Бронстеда-Лоури и Льюиса определяет кислоты и основания. Согласно этой теории, кислота — это вещество, способное отнимать протоны, а основание — вещество, способное поставлять пары электронов OH. Можно сказать, что основания — это соединения, которые при растворении в воде образуют анионы только типа OH-. Проще говоря, щелочь — это соединение, состоящее из металла и гидроксид-иона.
Щелочи обычно содержат гидроксиды щелочных и щелочноземельных металлов.
Все щелочи являются основаниями, но не наоборот, если исходить из определений «основание» и «щелочь».
Правильное химическое название щелочи — гидроксид (гидроокись). Гидроксид натрия и гидроксид калия. Также часто используются исторически сложившиеся названия. Из-за того, что щелочи разрушают материалы органического происхождения — кожу, ткань, бумагу, дерево, их называют едкими. Каустическая сода, едкий барий. Однако химики определяют «едкую щелочь» как гидроксиды щелочных металлов: лития, натрия, калия, любида и цезия.
Свойства щелочей
Щелочи белые, твердые, гигроскопичные и растворимые в воде. Растворение воды сопровождается активным тепловым излучением. Они реагируют с кислотами, образуя соли и воду. Эта реакция нейтрализации является наиболее важной из всех свойств щелочей. Кроме того, гидроксиды реагируют с кислотными оксидами (образуя кислородсодержащие кислоты), переходными металлами и растворами солей.
Гидроксиды щелочей растворимы в метиловом и этиловом спирте и выдерживают температуру до +1000°C (кроме гидроксида лития).
Алкария является активным химическим реагентом, который поглощает не только водяной пар, но и молекулы углекислого газа, а также диоксид серы, водорода и диоксид азота. Поэтому гидроксиды следует хранить в герметичных контейнерах. Например, доступ воздуха к емкостям со щелочью должен быть осажден через хлорозаборную трубку. В противном случае после хранения на воздухе химический реактив будет заражен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
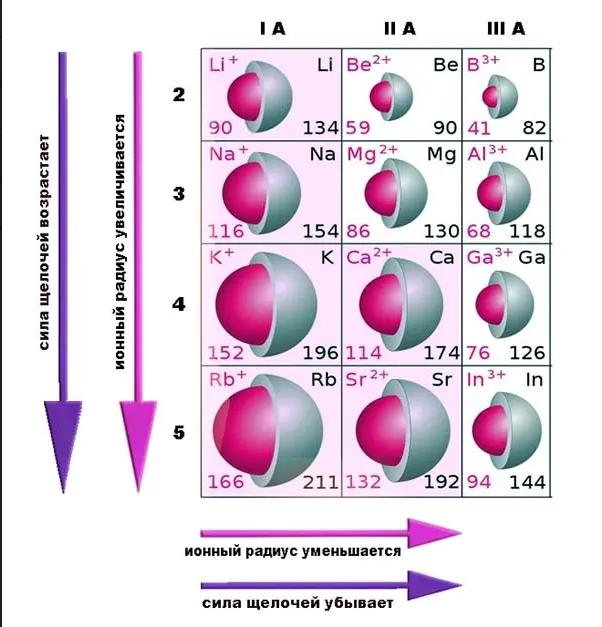
Сравнение щелочей по химической активности увеличивается по мере продвижения сверху вниз по ряду таблицы medeleaf.
Не рекомендуется хранить растворы щелочи в емкостях с печью и стеклянными фонтанами, так как концентрированные щелочи могут разрушить стекло, а всплески щелочи могут даже разрушить фарфор и платину, вызывая пригорание печи и крана. Щелочи обычно хранятся в полиэтиленовых контейнерах.
Алиса, а не кислота, вызывает самые сильные ожоги, так как ее труднее смыть с кожи и она проникает глубоко в ткани. Щелочи следует промывать неконцентрированным раствором уксусной кислоты. Для их обработки следует использовать средства защиты. Ожоги щелочью требуют немедленной медицинской помощи!
Применение щелочей
— В качестве электролита. — Для производства удобрений. — Медицина, химическая и косметическая промышленность. — Разведение рыбы для стерилизации озер.
В магазине Primechemicalsgroup вы можете найти самые популярные щелочи по льготным ценам.
Едкий натр
Самая популярная и востребованная алиса в мире.
Используется в качестве катализатора и реагента для химических реакций в пищевой промышленности, при производстве масел в нефтепереработке, при использовании жиров в производстве косметики и моющих средств.
Едкое кали
Используется в производстве мыла, удобрений для напитков, электролитов для батарей, аккумуляторов и синтетического каучука. Он также используется в качестве пищевой добавки для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
В медицине он используется как отличный адсорбент, антацид и средний индукционный компонент для вакцин на лекарствах. Он также используется в очистных сооружениях и процессах производства чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, известная у нас на родине как «стертая известь». Используется для дезинфекции, смягчения, производства удобрений, каустической соды, хлора и строительных материалов. В качестве пищевой добавки, как реагент при производстве сахара, в пищевой промышленности, для защиты древесины и деревянных строений от паразитов и огня.
Гидроокись лития

В качестве сырья в химической промышленности, в производстве смазочных материалов и электролитов, а также для поглощения вредных газов в стекольной, керамической и радиотехнической промышленности.
Гидроокись бария
Используется в качестве катализатора в химической промышленности и в пищевой промышленности для очистки жиров и сахара.
Щелочные стабилизаторы используются в аналитической химии. Его можно приобрести у нас.
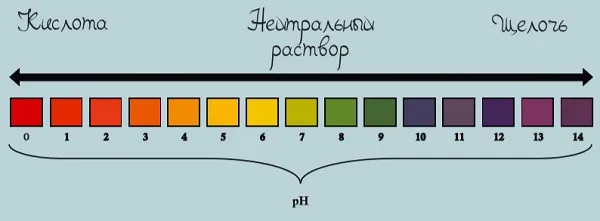
Если pH раствора равен 7, то раствор нейтрален, поскольку концентрация водородных ионов равна концентрации гидроксид-ионов. Примером нейтрального раствора является чистая вода.
Скачать:
lxxvi Московская химическая олимпиада.
Экспериментальный раунд 22 марта 2020 года.
Основа, сортировка, физические и химические свойства, подготовка, применение
Выполнено учащимися 8 класса.
Дарья Дмитриевна Ткаченко
Основание — это соединение, которое может образовывать ковалентную связь с протоном (основание Бронстеда) или с незаполненной орбиталью в другом соединении (основание Льюиса). В узком смысле основание — это основной гидроксид — сложное вещество, при распаде которого в водном растворе образуется тип аниона — только гидроксид-ион.
Особыми случаями оснований являются щелочи и щелочноземельные гидроксиды, а также другие элементы, такие как Tholl. Щелочи считаются основаниями, которые хорошо растворимы в воде.
Значение слова «основание» сформировалось в XVII веке и впервые было введено в химию французским химиком Гийомом-Франсуа Рюлем в 1754 году. Они превращаются в кристаллические соли только в сочетании с определенными веществами. Рюль предположил, что эти вещества действуют как «основания» для образования солей в твердой форме.
Единая теория кислот и оснований была впервые представлена шведским физическим химиком С. Аррениусом в 1887 году. В контексте своей теории Аррениус определил расщепление как кислоту, в которой при расщеплении образуются протоны H+, а расщепление как основу расщепленной материи. Образуются гидроксид-ионы OH. Однако теория Аррениуса имела слабые стороны. Например, он не учитывал влияние растворителей на острое усреднение и не мог быть применен к неводным растворам.
В 1924 году Э. Франклин создал теорию растворителей. В соответствии с этим, данная основа определяет соединения, которые увеличивают количество анионов, образующихся при разложении растворителя.
Основание в теории Брёнстеда — Лоури
Протонная теория кислот и оснований, разработанная независимо друг от друга датским ученым Й. Бронстедом и британским ученым Т. Лоури в 1923 году, описывает основания по Бронстеду как соединения или ионы, которые могут нанимать (отвлекать) протоны кислот. Следовательно, кислота Бронстеда является донором протонов, и взаимодействие между кислотой и основанием сводится к переносу протонов. Когда основание БрунстедаВ реагирует с кислотой, например, с водой, основание превращается в spy bh + кислота и связывает основание.
Согласно электронной теории, предложенной американским физическим химиком Г. Льюисом в 1923 году, основание — это вещество, которое может отдать пару электронов для соединения с кислотой Льюиса. Основания Льюиса — это амины R 3 N, спирты ROH, эфиры ROR, тиолы RSH, сульфаты RSR, анионы и соединения с P-связью. В зависимости от орбиталей, участвующих в реакции, основания Льюиса в этих формулах подразделяются на пары n-, s- и p-электронов, соответственно.
Понятия оснований в теориях Льюиса и Бронстеда-Лоури совпадают. Согласно обеим теориям, основания отдают пару электронов для образования связи. Разница лишь в том, где используется эта пара электронов. Основание Бронстеда образует связь между протоном и основанием Льюиса, при этом каждая частица имеет пустую орбиталь. Таким образом, существенное различие между этими теориями связано с понятием кислоты, а не основания.
Bf 3 + (C 2 H 5) 2 o
Теория Льюиса не дает количественной оценки способности основания реагировать с кислотой Льюиса. Однако при оценке высокого качества широко применяется принцип Пирсона о твердых кислотах и мягких основаниях, которые должны реагировать с твердыми основаниями, а мягкие кислоты — с твердыми кислотами и мягкими основаниями. Согласно Пирсону, твердые основания — это основания с центром низкой поляризации и большим количеством электронов. Напротив, мягкие основания — это высокопористые основания с высоким содержанием пулов и низким содержанием электронов. Твердые и мягкие кислоты обладают теми же свойствами, что и твердые и мягкие основания, соответственно, за исключением того, что каждая из них является допустимой частицей.
Используется в качестве катализатора и реагента для химических реакций в пищевой промышленности, при производстве масел в нефтепереработке, при использовании жиров в производстве косметики и моющих средств.
Химия что такое основания
Основания или гидроксиды — это соединения металлов с гидроксигруппами OH (одна или несколько групп OH каждого металла Mon, т.е. Mon или M(OH)n). Гидроксигруппа OH представляет собой ион, нагрузка которого равна 1 — и жизнеспособность которого равна I.
В названии основания есть два слова: KOH — гидроксид калия. Переменная энергичность металла обозначается латинским числом в скобках: cr(oh).3 — Гидроксид хрома (III).
Чтобы составить тип гидроксида из названия соединения, необходимо знать нагрузку катиона металла m n +. Количество гидроксильных групп в формуле равно значению этой нагрузки: m(oh)n. Большое количество катионов металлов находится в панели растворимости.
Например, в гидроксиде калия формула — КОН, поскольку заряд иона калия равен 1+, K+. В гидроксиде бария ион бария Ba2+, формула — Ba(OH).2.
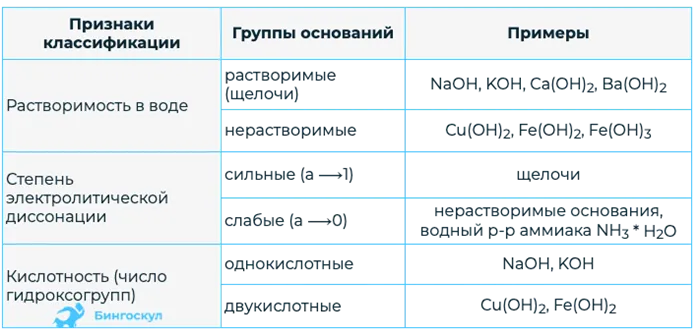
Щелочи — это растворимые в воде основания (LiOH, NaOH, KOH, Ba(OH)2Ca(OH)2 ). Щелочи обладают высокой коррозионной активностью и вызывают ожоги. При работе с ними необходимо соблюдать особую осторожность, соблюдая правила техники безопасности, надевать очки и перчатки.
Щелочные растворы определяются с помощью индикаторов.

Это органические красители, которые меняют цвет в зависимости от состава раствора. Например, бесцветный раствор фенолфталеина станет ярко-красным в щелочном растворе. Раствор фиолетового камня в щелочном растворе становится синим, а раствор оранжевого метилового оранжевого — ярко-желтым.
Нерастворимые основания — это вещества, которые практически не растворяются в воде. Гидроксид железа(III), гидроксид меди(II) и гидроксид магния.
Основные оксиды — это оксиды, которым соответствует основание. Если элемент образует несколько оксидов, то оксид, соответствующий низшей степени окисления, является основным оксидом. Например, CrO и MnO являются основными оксидами.
Основной оксид получается путем вычитания необходимого количества молекул воды из основной формулы. Например, основные оксиды Na2O, CaO и Fe2O3(a) 2NaOH-H2O = Na2O-β) Ca(OH)2 -Н2(O = CaO-γ) 2Fe(OH)3 -3Н2O = Fe2O3.

Получение оснований
Растворимое основание получают путем.
(a) Реакция щелочных и щелочноземельных оксидов с водой: BaO + H2O = Ba(OH)2
(b) Взаимодействие активных металлов (электроотрицательность ниже 1,2) с водой: 2 Li + 2H2O = 2LiOH + H2 ↑;
c) электролиз растворов солей, например, хлорида натрия — когда раствор пропускают постоянный ток, на катоде выделяется водород, а на аноде — хлор, в результате чего в растворе остается гидроксид натрия: 2NaCl + 2H2O → электролиз → H2 ↑ + 2NaOH + Cl2 ↑.
Нерастворимое основание получается в результате реакции обмена между растворимой солью и щелочью: CuCl2 + 2NaOH = Cu(OH)2 ↓+ 2NaCl.
Рассмотрим этот процесс на примере соляной кислоты HCl. Когда соляная кислота соединяется с водой, она распадается на ионы водорода (H+) и ионы хлора (CI). Поскольку молекулы воды также содержат водород, общее количество ионов водорода в растворе увеличивается по мере разложения соляной кислоты.
Получение

Физико-химические свойства основы делают ее незаменимым веществом во всех областях химической технологии.
- в добыче полезных ископаемых и металлургии;
- в производстве потребительских товаров, косметической, пищевой и фармацевтической продукции;
- в производстве красителей, бытовой химии и удобрений;
- в топливной и химической промышленности;
- в строительстве и многих других областях.

Наиболее широко используются щелочи, но нерастворимые основания также применяются в производстве полимеров, на очистных сооружениях, в медицине и электротехнике.
Задания
Какие соединения из ряда KOH, Ra(OH2), BeO, P2O5, HBrO3 и Al(OH3) являются
-
- амфотерным оксидом;
- едкой щелочью;
- кислотным оксидом;
- нерастворимым основанием;
- гидроксидом щелочноземельного металла?
2. какое основание из каждой пары является самым сильным?
-
- Ca(OH)2 или Mg(OH)2;
- Ba(OH)2 или Ca(OH)2;
- Ra(OH)2 или CsOH;
- Sr(OH0)2 или Al(OH)3;
- KOH или LiOH.
3. какое соединение образуется в результате реакции Zn(OH)2 + H2SO4? Напишите его молекулярное и ионное уравнения.
4. какое соединение является продуктом реакции между гидроксидом натрия и оксидом азота (V)? Напишите уравнения в молекулярной и ионной форме.
5.Какое доказательство дает реакция между гидроксидом калия и сульфатом магния? Напишите его уравнение.
6. Составьте молекулярные и ионные уравнения реакций, позволяющих осуществить превращения
Нерастворимые основания — это вещества, которые практически не растворяются в воде. Гидроксид железа(III), гидроксид меди(II) и гидроксид магния.
Основания
Этот видеоролик знакомит студентов с классом соединений, называемых основаниями. В нем рассматриваются состав, номенклатура, классификация и свойства наиболее распространенных оснований, объясняется, как определить растворимость основания в воде с помощью таблицы растворимости, и учащимся демонстрируется очень интересный мультфильм, показывающий изменение цвета индикатора в щелочном растворе.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам из комплекта, необходимо приобрести его в каталоге и добавить в личный кабинет.


Конспект урока «Основания»
Он содержит металл и кислород.
Основания — это композитные материалы, состоящие из атомов металла и гидроксильных групп. Гидроксигруппа представляет собой группу OH.
Его степень окисления O(-2), H(+1), поэтому общий заряд этого иона составляет (1-). Другими словами, гидроксидная группа представляет собой ионный комплекс, также называемый гидроксид-ионом.

Состав основания может быть выражен формулой Me(OH)n где Me — металл, а n — количество OH-групп.
Если заряд иона металла равен 1+, то одна группа OH связана с ионом металла. Типом этих оснований является MeOH; когда заряд иона металла равен 2+, две группы OH связываются с ионом металла. Тип этих оснований — Me(OH)2 и т.д.
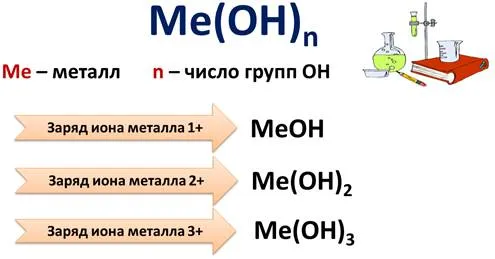
Названия оснований состоят из слова гидроксид + название металла в общей капле. Например, КОН — гидроксид калия, Ba(OH)2 -гидроксид бария, Al(OH).3 -Гидроксид алюминия.
При изменении степени окисления металла за названием в скобках следует латинская цифра, обозначающая числовое значение степени окисления. Примеры: Cu(OH)2 -гидроксид меди(II), Fe(OH)3 -гидроксид железа (III), Mn (OH)2 Гидроксид марганца (II).
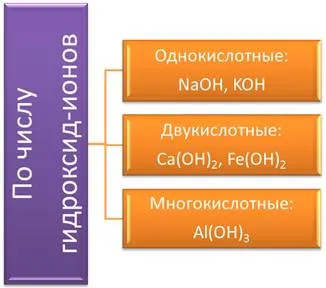
Основания различаются по количеству гидроксид-ионов: одно кислотное основание и один гидроксид-ион (NaOH, KOH) — два кислотных основания и два гидроксид-иона (Ca(OH)).2Fe(OH) — многокислотное основание с тремя или более гидроксид-ионами (Al(OH))3).
По растворимости в воде основания делятся на водорастворимые или щелочные и нерастворимые в воде. Растворимые основания — это основания, образованные из металлов группы IA и некоторых металлов группы IIA. NaOH, Ba(OH)2и KOH; растворимые основания хорошо растворяются в воде и не образуют осадка, тогда как нерастворимые основания образуют осадок и нерастворимы в воде. Например, Cu(OH)2, Al(OH)3, Fe(OH)2 .
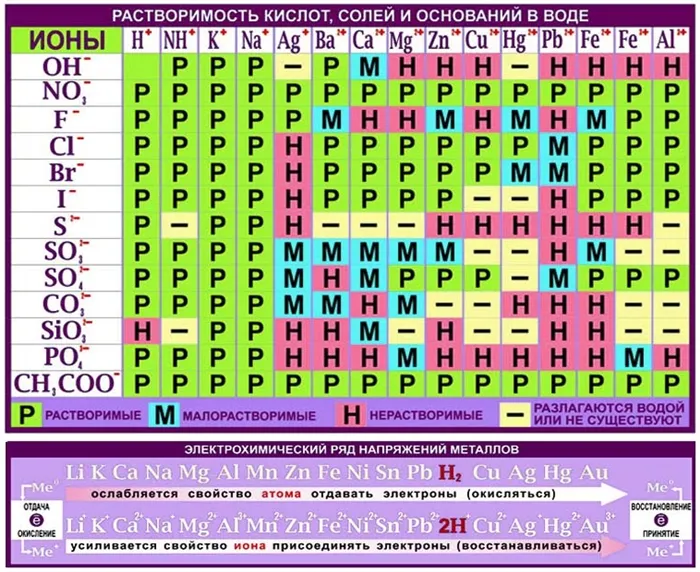
Таблицы растворимости можно использовать для определения того, растворимо или нерастворимо основание в воде. Если сечения ионов металла и гидроксида, приведенные в таблице, являются P водорастворимыми. означает, что основание нерастворимо в воде.
Таблица растворимости









