Метод получения азотной кислоты путем обменной реакции был открыт более трехсот пятидесяти лет назад немецким химиком и фармацевтом Глаубером. В результате взаимодействия нитрата калия с серной кислотой Глаубер получил «spiritus nutri» — «дух селитры». В России в старину азотную кислоту называли «азотной копченой водкой».
Применение азотной кислоты в жизни
В современном мире кислоты используются повсеместно, и азотная кислота не является исключением. Медицина, пищевая промышленность, машиностроение и многие другие отрасли не могут без них обойтись. В этой статье мы расскажем вам, что такое азотная кислота и где она чаще всего используется.
Азотная кислота представляет собой бесцветную жидкость, иногда желтоватого цвета, которая может возникнуть при воздействии горячей температуры (выделяется оксид азота). Его необходимо хранить в герметичном контейнере, так как он бурно реагирует с кислородом. Жидкость начинает сильно дымиться (если концентрация кислоты составляет от 86 до 95%, цвет дыма белый, если выше 95% — красный).
Азотная кислота реагирует с большинством металлов, превращая их в оксиды и нитраты. Он также хорошо растворим в воде.
Как получить азотную кислоту
Тип этого реактива нам известен еще со школьной скамьи. HNO3 получают в несколько этапов:
- Сначала происходит окисление синтетического аммиака с применением катализатора;
- В результате реакции выделяются нитрозные газы;
- Вода полностью впитывается;
- Происходит процесс выделения и концентрирования азотной кислоты.
Применение
Азотная кислота широко используется в различных областях:

- Медицина. Антисептик с вяжущими свойствами, один из основных ингредиентов лекарств, которые помогают бороться с болезнями кожи (например, является эффективным средством для удаления бородавок), реактив, участвующий в синтезе фармакологических веществ — все это создается с помощью азотной кислоты.
- Сельское хозяйство. На основе HNО3 производят амидные, аммиачные и нитратные удобрения, которые помогают повысить урожайность. Азотные соли применяются также в животноводстве: они входят в состав лекарственных препаратов для животных.
- Ракетно-космическом производстве. Азотная кислота, которую можно купить тут, применяется для производства ракетного топлива.
- Военное дело. Без участия данного вещества невозможно создать нитрирующий реагент, который является важным компонентом взрывчатки.
- В производстве смазочных материалов и автозапчастей, а также металлургии. Азотная кислота является одним из основных ингредиентов, которые входят в состав машинного масла. Также с ее помощью осуществляется травление и растворение металлов.
- В химической промышленности. Она используется при производстве пластмассы, органических красителей и др.
- Быт. Поскольку азотная кислота является агрессивным реактивом, напрямую она в быту не применяется. Однако данное вещество входит в состав специальных средств, которые помогают эффективно очистить ювелирные украшения от налета. Она также применяется при капельном поливе: даже 60%-ного раствора хватает, чтобы растворить осадок, который появляется в капельной системе.
Кислоты широко используются в Беларуси, так как многие процессы просто невозможны без их участия. Важно помнить, что это опасные и едкие вещества, поэтому при работе с реактивами необходимо соблюдать меры предосторожности.
Азотная кислота не является стабильной, она разлагается под воздействием тепла и света на оксид азота (IV), кислород и воду, поэтому храните ее в прохладном и темном месте.
Общее описание
Формула азотной кислоты — HNO3。 Это сильная бесцветная кислота с сильным запахом. Свободно растворяется в воде. Он имеет низкую температуру плавления (-41°C) и кипения (82,6°C). Плотность кислоты составляет 1,52 г/см3 .

Рисунок 1: Азотная кислота.
Концентрированная азотная кислота выделяет ядовитые газы — оксиды азота. Азотная кислота окисляет органические вещества: разрушает бумагу, натуральную ткань, вызывает ожоги кожи.
Азотная кислота образуется в небольших количествах в дождевой воде во время разрядов молнии.
Получение
Азотная кислота была впервые получена алхимиками из селитры и железного купороса путем термической реакции:
В современной химии существуют лабораторные и промышленные методы получения азотной кислоты. В лаборатории кислоту получают путем нагревания смеси азотной и концентрированной серной кислоты:
В промышленности азотная кислота производится путем окисления аммиака. Процесс осуществляется в три этапа.
Сначала аммиак окисляется до оксида азота (II) с помощью платиновых катализаторов:
Оксид азота (II) или монооксид окисляется до оксида азота или оксида азота (IV):
Последним этапом является поглощение диоксида азота из воды при избытке кислорода:
Все реакции выделяют тепло, т.е. являются экзотермическими. Последние две реакции являются обратимыми, поэтому конечная концентрация чистой азотной кислоты низкая (45-58 %).
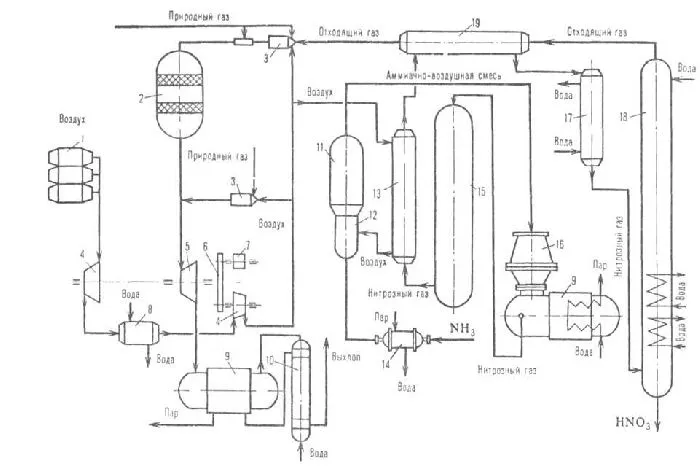
Рисунок 2. Промышленный завод по производству азотной кислоты.
Для увеличения концентрации в реакции оксида азота (IV) с водой равновесие смещается за счет увеличения давления. Также разбавленную азотную кислоту можно смешать с серной кислотой и нагреть. Азотная кислота испаряется и конденсируется.
Немецкий алхимик Иоганн Рудольф Глаубер изобрел лабораторный метод получения азотной кислоты в 17 веке.

Рисунок 3: Иоганн Рудольф Глаубер.
Применение
Используется азотная кислота:
- при производстве удобрений;
- в изготовлении взрывчатых веществ;
- в качестве окислителя ракетного топлива;
- для травления печатных форм в типографии;
- при изготовлении красок и лаков;
- в производстве лекарств;
- для определения золота в сплавах;
- для получения органических соединений.
Азотная кислота токсична. При контакте с кожей он разрушает белки и оставляет долго не заживающие шрамы.
Проглотив концентрацию азотной кислоты (63%) и три опухоли (плотность) соляной кислоты, можно получить «аква-гиа». Золото (AU) и платина (PT) могут быть растворены.
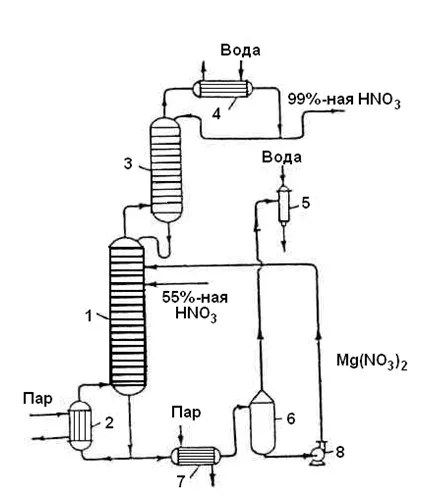
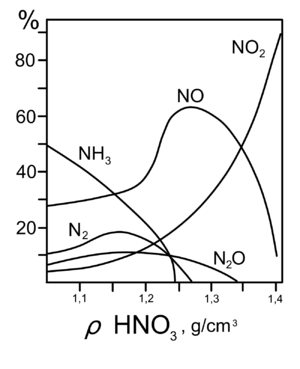
Получение концентрированной азотной кислоты
3.3 Технологическая схема производства высокоплотной азотной кислоты прямого состава.
Для производства взрывчатых веществ, некоторых пластмасс и красителей. Требуется кислота высокой плотности (98) %. Азотная кислота такой концентрации может быть получена двумя способами
РассмотрениеСвойства. Первый метод — рассмотрение производства из разреженных Мы рассмотрим особенности первого метода, основанного на разреженной азотной кислоте.Путем дистилляции воды Может быть принята редкая азотная кислота68% растворПоскольку речь идет о концентрации, образуется аневризмальная смесь. Это означает, что с помощью этого метода нельзя получить раствор с концентрацией выше 68%. Следовательно, конденсация происходит не за счет испарения растворителя, а за счет использования мер по удалению воды (WA). В качестве очистителей воды используются следующие вещества
РассмотрениеХарактеристики второго метода — Непосредственный состав. Суть прямого состава заключается в том, что процесс протекает по уравнению реакции.
Диоксид азота фактически поглощается разреженной (55%) азотной кислотой. Процесс проводится в самообласти при T = 90ºC и P = 5 МПа. Самоходка производит SO — так называемый азот HNO3— Нет.2и до 25% Нет2Нет, до 25% Нет. После промывки диоксидом азота, 97-98% HNO3.
Следует отметить, что непосредственный состав имеет высокие энергетические затраты, требуя высокого давления, расхода пара, кислорода и воды.
Экономически выгоднее производить плотную азотную кислоту из разреженной азотной кислоты.
Однако сегодня важна и прямая композиция.
Выделим основные этапы (или задачи) получения концентрированной азотной кислоты из нитритного газа.
1- Охлаждение нитритного газа
2- Окисление нет.2 (Уравнение 3.1)
3- Близость азотной кислоты (уравнение 3.2)
4- охлаждение нитритного газа
Производство 5-нитроли (уравнение 3.3)
Расщепление 6-нитроли (уравнение 3.4)
8-Приготовление жидкости n2o4 (Уравнение 3.5)
9-Окисление кислородом (окончательное уравнение)
11-Нейтрализация апостолов (это делается после приема нитроли).
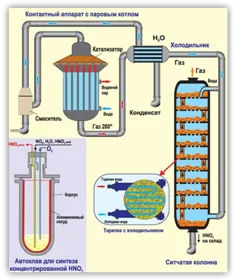
Схема получения концентрированной азотной кислоты методом прямого синтеза.
Технологическая схема производства концентрированной азотной кислоты прямым синтезом
Поток концентрированной азотной кислоты с прямым составом жидкого оксида азота показан на рисунке 14.
Рисунок 14.Технологическая схема производства концентрированной азотной кислоты прямого состава:.
1 — быстрое охлаждение — 2 — охлаждение — 3 — окислительная башня — 4 — окислитель — 5 — домашнее охлаждение — 6 — абсорбционная колонна — 7 — смеситель — 8 — отбеливающая колонна.
Описание системы.
Газообразная закись азота поступает в морозильную камеру 1, где охлаждается до 40°C и образуется 3% азотная кислота. Затем газ поступает в холодильник 2, где производится 30% азотная кислота. Часть кислоты направляется в смеситель 7, а другая часть распыляется в окислительную колонну 3. Нитритный газ подается в окислительную башню 3, где распыляется азотная кислота. В результате образуется 60% азотная кислота, часть которой направляется в смеситель 7, а часть используется для окисления азотнокислого газа в устройстве 4. 98% азотная кислота. Азотная кислота из окислителя 4 направляется в смеситель 7, а газ азотной кислоты направляется в охладитель рассола 5, где охлаждается до (-10)ºС. Затем нитритный газ направляется в абсорбционную колонну, орошаемую 98%-ной азотной кислотой, где он поглощает оксид азота (IV) с получением нитолов. Газы, не поглощенные в верхней части колонны, направляются в систему очистки отходящих газов, а полученный нитрол направляется в отбеливающую колонну8 для десорбции.2. Отбеленная 98% азотная кислота охлаждается в охладителе 10 и передается в резервуар для хранения.
Газообразный концентрированный оксид азота из отбельной колонны охлаждается и концентрируется в конденсаторе 11, а конденсатор 11 охлаждается рассолом при (-1 (0) °C для охлаждения. Затем они поступают в смеситель 7, где смесь, состоящая из (68-80) % N2o4,. (26-10,5)% HNO3 и (6-9,5) % H2O.
Эта смесь подается в автоклав 9 и кислород при давлении 5 МПа. Образовавшуюся концентрированную азотную кислоту забирают со дна автоклава, объединяют с нитролеумом из абсорбционной колонны 6 и направляют в отбеливающую колонну 8.
Однако смесь одного объема концентрированной азотной кислоты и трех объемов концентрированной соляной кислоты, известная как «королевская вода», обладает самым сильным окислительным действием.
Азотная кислота и её соли

В этом видеоролике студенты узнают о промышленных и лабораторных методах получения азотной кислоты, ее физических и химических свойствах и увидят разницу в химических свойствах между разбавленной и концентрированной азотной кислотой. Кроме того, имеется материал о применении азотной кислоты и ее солей — нитратов, об открытии азотной кислоты, а для систематизации знаний в конце курса обобщен материал темы.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам из комплекта, необходимо приобрести его в каталоге и добавить в личный кабинет.

Конспект урока «Азотная кислота и её соли»
Азотная кислота и ее соли
Азотная кислота — бесцветная жидкость, «дымящаяся» на воздухе и окрашенная в желтый цвет оксидом азота (IV), имеет сильный резкий запах, кипит при 83°C и смешивается с водой в любых пропорциях.

Азот и водород являются промышленным сырьем, используемым в производстве азотной кислоты. Азот превращается в аммиак, который затем окисляется в насыщенном кислородом воздухе в присутствии катализатора до монооксида азота (II), который затем окисляется до монооксида азота (IV), образующегося при растворении оксида азота. азота (IV) в присутствии кислорода в воде и на воздухе.
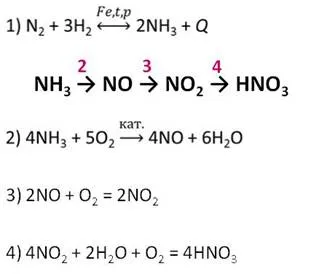
В лабораторных условиях азотная кислота может быть получена действием концентрированной серной кислоты на твердый нитрат натрия при небольшом нагревании.
Метод получения азотной кислоты путем обменной реакции был открыт более трехсот пятидесяти лет назад немецким химиком и фармацевтом Глаубером. В результате взаимодействия нитрата калия с серной кислотой Глаубер получил «spiritus nutri» — «дух селитры». В России в старину азотную кислоту называли «азотной копченой водкой».
В водном растворе азотная кислота проявляет все свойства кислоты. Являясь сильной моноосновной кислотой, на первой стадии она разделяется на ионы водорода и анионы кислотного остатка.
Как и другие кислоты, азотная кислота реагирует с основными и амфотерными оксидами. Например, при реакции оксида магния с азотной кислотой образуется нитрат магния и вода — при реакции оксида алюминия с азотной кислотой образуются соли — нитрат алюминия и вода.

Азотная кислота реагирует как с растворимыми, так и с нерастворимыми основаниями. В результате взаимодействия гидроксида натрия с азотной кислотой образуются нитрат натрия и вода, а гидроксид меди(II) реагирует с азотной кислотой с образованием нитрата меди(II) и воды.

Азотная кислота реагирует со слабыми кислотами. Например, в результате реакции карбоната натрия с азотной кислотой образуется нитрат натрия, диоксид углерода и вода.

Азотная кислота является одним из самых мощных окислителей, поскольку азот имеет высшую степень окисления +5, окисляя многие простые и сложные вещества.
Поэтому концентрированная азотная кислота реагирует почти со всеми металлами в ряду до и после активности водорода, за исключением золота и платины. Поскольку окислителями концентрированной азотной кислоты являются остаточные ионы кислоты, а не ионы водорода, водород не выделяется во время реакции с металлом.
Концентрированная азотная кислота окисляет многие органические вещества. Например, трубка накаливания, помещенная в пробирку с нагретой концентрированной азотной кислотой, освещается сильным пламенем.
Промышленное производство, применение и действие на организм
Азотная кислота является одним из самых объемных продуктов в химической промышленности.
Производство азотной кислоты
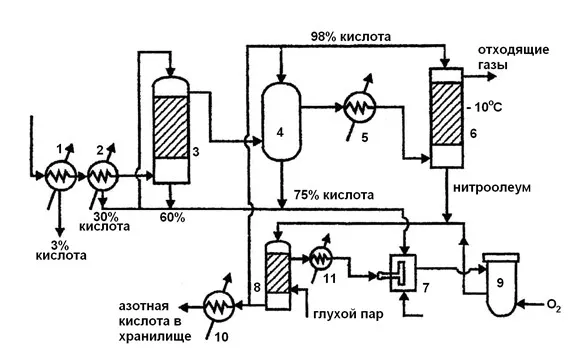
Современный метод его производства основан на контактном окислении синтетического аммиака на платиново-родиевом катализаторе (процесс Оствальда) в смеси оксидов азота (азотнокислый газ) и их дальнейшем поглощении в воде.
» />
Концентрация азотной кислоты, получаемой в этом процессе, составляет от 45% до 58%, в зависимости от конструкции процесса.
Впервые азотная кислота была получена алхимиками путем нагревания смеси азотной кислоты и железного купороса.
«/>
Чистая азотная кислота была впервые получена Иоганном Рудольфом Глаубером путем обработки нитрата концентрированной серной кислотой.
«/>
Дальнейшая перегонка позволяет получить так называемую «копченую азотную кислоту», которая практически не содержит воды.
Применение
- в производстве минеральных удобрений;
- в военной промышленности (дымящая — в производстве взрывчатых веществ, как окислитель ракетного топлива, разбавленная — в синтезе различных веществ, в том числе отравляющих);
- крайне редко в фотографии — разбавленная — подкисление некоторых тонирующих растворов;
- в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
- в производстве красителей и лекарств (нитроглицерин)
- в ювелирном деле — основной способ определения золота в золотом сплаве;
Действие на организм
Азотная кислота и ее пары чрезвычайно токсичны. Пары раздражают дыхательные пути, а сама кислота оставляет на коже долго незаживающие раны. Воздействие на кожу приводит к характерному пожелтению кожи вследствие ксантопротеиновой реакции. При нагревании или воздействии света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (коричневый газ). ПДК азотной кислоты в воздухе на рабочем месте NO2 2 мг / м








