2. алкилирование аммиака и аминов. Когда аммиак реагирует с алкилгалогенидами, образуется первичная соль. амина, из которого под действием щелочи образуется первичный амин. Этот амин амин способен вступить в реакцию с новой частью галоалкана и образовать вторичный амина:
Амины и аминокислоты
Амины — это производные аммиака (NH3), в молекуле которых один, два или три атома водорода замещены углеводородными радикалами.
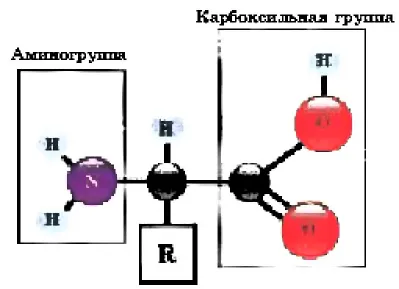
Аминокислоты — это строительные блоки макромолекул, белков. Структурно они представляют собой органические карбоновые кислоты, в которых по крайней мере один атом водорода замещен водородным радикалом. на аминогруппу.
На странице -> решение задач по химии Концентрированное решение задач и упражнения с решенными примерами по всем темам химии.
Амины и аминокислоты
Амины — это класс соединений, которые являются органическими производными аммиака, в которых один, два или три атома водорода замещены органическими группами. Характерной особенностью является наличие фрагмента R-N.
Аминокислоты — это органические амфотерные соединения, представляющие собой карбоновые кислоты.сильные группы – СООН и аминогрСоединения NH2-карбоновых кислот. Аминокислоты можно рассматривать как карбоновые кислоты, в которых атом водорода замещен в радикале аминогруппой.
Амины
Амины — это производные аммиака, в молекулах которых один или несколько атомов водорода замещены углеводородными радикалами.
В зависимости от количества углеводородных радикалов в молекуле амина, они классифицируются как первичные амины. амина, Они делятся на первичные, вторичные и третичные (рис. 17):
Заместители могут быть одинаковыми или разными.
Можно также предположить, что первичный амины производные углеводородов, в которых атом водорода заменен на атом NH2 — аминогрuppu. В зависимости от типа корня амины Они могут быть чистыми, ненасыщенными или ароматическими. Например, C6H5 — NH2 фениламин или анилин.
структура. аминов, как молекула аммиака, имеют аминогрuppa — атом азота, содержащий неподеленную электронную пару. Из-за неделимой электронной пары. амины как аммиак, проявляют основные свойства.
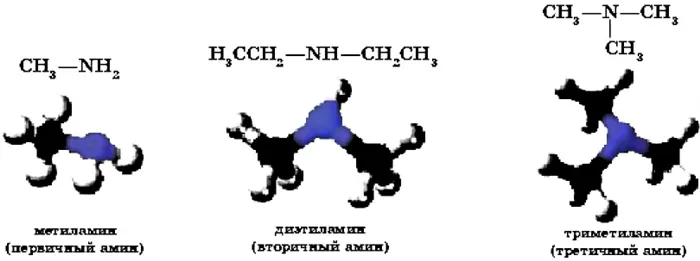
Рисунок 17. амины
Изомеры и номенклатура. Для аминов Структурные изомеры характеризуются: (a) изомерией углеродного скелета
(b) Изомерия положения функциональной группы.
первичные, вторичные и третичные амины, содержащие одинаковое число атомов углерода, являются изомерами друг друга:
Названия аминов производные от названий соответствующих углеводородных радикалов с добавлением суффикса -. амин .
Физические свойства. Крупнейший алифатический амины (C1—C3) газы с запахом аммиака, C4—C9 — жидкости с сильным, неприятным рыбным запахом. выше амины — Твердые вещества. Простейший амины растворимы в воде, растворимость увеличивается с ростом размера углеводородного радикала. аминов уменьшается .
Амины образуются при разложении органических остатков, содержащих белки. Ряд аминов образуется у людей и животных из аминокислот.
Химические свойства. Свойства аминов определяются наличием атома азота в их составе аминогратом, атом азота которого содержит неподеленную пару электронов. В водном растворе и в присутствии кислот эта электронная пара взаимодействует с положительно заряженным ионом водорода и связывает его по донорно-акцепторному механизму.
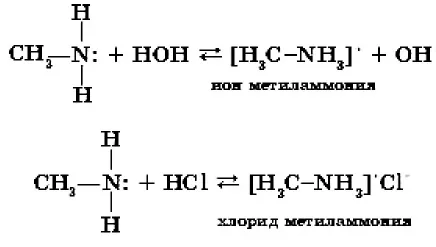
Следовательно, амины, Как и аммиак, они проявляют основные свойства. Их водные растворы окрашивают раствор лития в синий цвет, а раствор фенолфталеина — в фиолетовый. Однако по сравнению с аммиаком, амины являются более сильными основаниями. Поскольку они отличаются от аммиака только наличием углеводородных радикалов в их молекулах, атом азота, очевидно, подвергается воздействию этих радикалов.
Амины горят на воздухе (вспомните условия, при которых горит аммиак): 4CH3NH2 + 902 → 4CO2↑ + 10H2O + 2N2↑
Применение. Метиламин CH3NH2 Аммоний используется в качестве побочного продукта при синтезе фармацевтических препаратов и красителей.
структура. аминов, как молекула аммиака, имеют аминогрuppa — атом азота, содержащий неподеленную электронную пару. Из-за неделимой электронной пары. амины как аммиак, проявляют основные свойства.
Подготовка к ЕГЭ по химии. Амины.
Амины — это органические производные аммиака NH3в молекуле которого один, два или три атома водорода замещены углеводородными радикалами:
Простейшим представителем является метиламин:
Самый простой пример — метил: атом азота находится в состоянии sp 3 -гибридизации, поэтому молекула имеет тетраэдрическую форму.
Кроме того, атом азота имеет два неспаренных электрона, что объясняет его свойства. аминов как органических оснований.
КЛАССИФИКАЦИЯ АМИНОВ.
В зависимости от количества и типа радикалов, присоединенных к атому азота:
Алифатические
Ароматические
НОМЕНКЛАТУРА АМИНОВ.
1. в большинстве случаев имена аминов образованы от названий углеводородных радикалов и суффикса амин . Различные радикалы расположены в алфавитном порядке. Когда корни одинаковые, используются приставки di и tri.
2. Первичные амины часто называют производными углеводородов, в которых один или несколько атомов водорода замещены в молекуле. на аминогруппы -NH2.
В этом случае аминогрuppa обозначается в названии префиксом амино- :
Для смешанных аминов, которые содержат алкильные и ароматические радикалы, в качестве основы обычно берется название первого представителя ароматики. аминов анилин .
Символ N- предшествует названию алкильного радикала, чтобы указать, что радикал присоединен к атому азота и не является заместителем на бензольном кольце.
ИЗОМЕРИЗАЦИЯ АМИНОВ
1) Углеродный скелет, начинающийся с C4H9NH2:
CH 3 — CH — CH2— NH 2 изо-бутиламин (1-амин-2-метилпропан)
2) положения аминогруппы , начиная с С3H7NH2:
CH 3 — CH — CH2-C H 3 2-аминобутан (втор-бутиламин)
3) Изомерия между формулами аминов — первичный, вторичный, третичный:
ФИЗИЧЕСКИЕ СВОЙСТВА АМИНОВ.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами аналогичной молекулярной массы. Например:
Третичные амины Они не образуют ассоциативных водородных связей (нет группы N-H) и поэтому имеют более низкую температуру кипения, чем первичные и вторичные изомеры. аминов:
н -Гексиламин
По сравнению со спиртами, алифатические спирты являются амины Алифатические спирты имеют более низкую температуру кипения, потому что водородная связь в спиртах сильнее:
При комнатной температуре только низшие алифатические спирты являются амины CH3NH2ПРИ ТЕМПЕРАТУРЕ ОКРУЖАЮЩЕЙ СРЕДЫ (CH3)2NH и (CH CH NH) находятся при комнатной температуре, только низшие алкиленовые спирты находятся при комнатной температуре.3)3N — газы (с запахом аммиака), средние гомологи — жидкости (с сильным рыбным запахом), верхние гомологи — твердые вещества без запаха.
Ароматические амины — бесцветные жидкие или твердые вещества с высокой температурой кипения.
Амины способны образовывать водородные связи с водой:
Краткое описание документа:
Амины — это органические производные аммиака NH3, в молекуле которых один, два или три атома водорода замещены углеводородными радикалами: R-NH2, R2NH, R3N
Атом азота находится в состоянии гидратации sp 3, поэтому молекула имеет форму тетраэдра.
Кроме того, атом азота имеет два неспаренных электрона, что объясняет его свойства. аминов как органических оснований
1. в большинстве случаев имена аминов Названия образованы от названий углеводородных радикалов и суффикса амин. Различные радикалы расположены в алфавитном порядке. Когда корни одинаковые, используются приставки di и tri.
CH3-NH2 Метиламин СH3CH2-NH2 Этиламин
CH3-CH2-NH-CH3 метилэтилатамин (CH3)2NH Диметиламин
2. Первичные амины часто называют производными углеводородов, в которых один или несколько атомов водорода замещены в молекуле. на аминогруппы -NH2.
В этом случае аминогрuppa заменяется в имени префиксом амино- :
CH3-CH2-CH2-NH2 1-аминопрпропан H2N-CH2-CH(NH2)-CH3 1,3-диаминобутан
Для смешанных аминов, которые содержат алкильные и ароматические радикалы, в качестве основы обычно берется название первого представителя ароматики. аминов анилин .
Символ N- перед названием алкильного радикала указывает на то, что радикал присоединен к атому азота, а не к заместителю на бензольном кольце.
E — неизвестный элемент W(O) = Ar(O) * n / M(X2O3) * 100% 47% = 16 * 3 / 2x + 48 * 100% 94x + 2256 = 4800 X = 27 — это Al2O3 ответ — алюминий.
Химические свойства
По химическим свойствам амины похожи на аммиак.
1. взаимодействие с водой — образование замещенных гидроксидов аммония

Вспомните взаимодействие между аммиаком и водой:
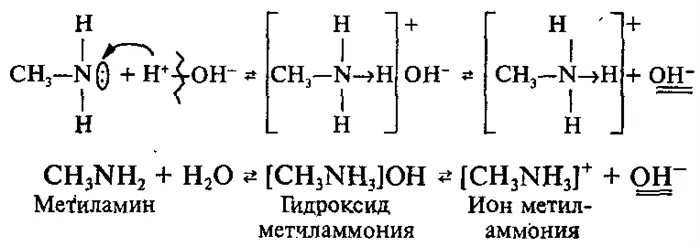
Раствор аммиака в воде обладает слабощелочными (основными) свойствами. Причина основных свойств аммиака заключается в том, что атом азота имеет неделимую пару электронов, участвующих в образовании донорно-акцепторной связи с ионом водорода. По той же причине амины они также слабы основаниями. Амины являются органическими веществами. основания:
Растворимые амины — более сильные основания, чем аммиак.
2. взаимодействие с кислотами — образование солей (реакции нейтрализации).
![]()
Как основание Аммиак образует аммониевые соли с кислотами:
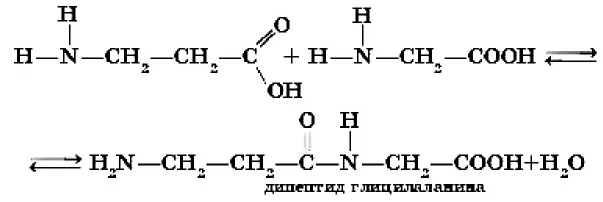
Аналогично, при реакции с аммиаком в присутствии аммиака в присутствии аммиака. аминов с кислотами образуются замещенные аммониевые соли:

Щелочи, как более сильные основания, вытесняют аммиак и амины из их солей:
3.Горение аминов
Амины являются горючими веществами. Продукты сгорания аминов, Амины, как и другие азотистые органические соединения, являются продуктами сгорания, например, углекислого газа, воды и свободного азота:

Способы получения
1. взаимодействие спиртов с аммиаком при нагревании в присутствии Al.2О3 аммиака в аммиаке в присутствии аммиака в присутствии катализатора. См. примеры по теме «Спирты».

2:

Полученный первичный амин может реагировать с избытком алкилгалогенидов и аммиака с образованием вторичных амин:
Третичный может быть получен аналогичным образом. амины.
Химические свойства
Основные свойства анилина выражены лишь очень слабо, так как на них влияет бензоильное ядро. на аминогруппу.
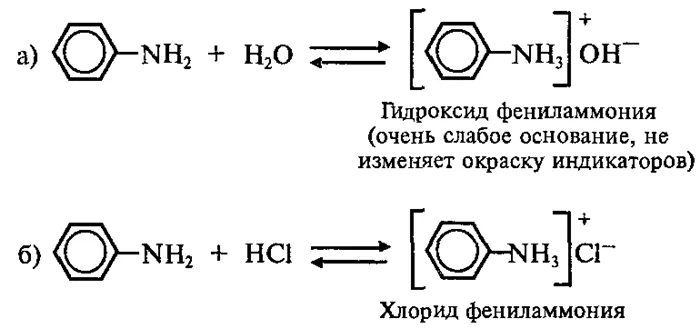
1 Реакции с бензолом и винилиденбензолом 1.Реакции с бензолом и винилиденбензолом аминогруппы
2 Реакции с бензольным кольцом
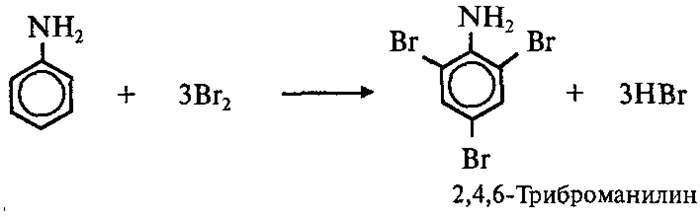
Аминогруппа как первый тип заместителя облегчает реакции замещения в бензольном кольце, заместители возникают в орто- и пара-положениях. к аминогруппе:
А поскольку аммиак не имеет электронодонорной группы, он является самым слабым. основанием, чем метиламин (азот имеет более отрицательный заряд и поэтому легче принимает H+).
В этом списке есть много полезных продуктов, которые не следует исключать из своего рациона. Мы все разные — у некоторых сильнее Некоторые люди реагируют на одну пищу, другие — на другую. Кроме того, чувствительность к пище может меняться со временем; например, многие люди с возрастом испытывают трудности с перевариванием молочных продуктов.
Если у вас возникает вздутие живота от здоровой пищи (например, цельного зерна и овощей), уменьшите количество съеденного. Затем начните добавлять эти продукты в свой рацион и увеличивайте дозу в течение нескольких недель, чтобы ваша пищеварительная система привыкла к новым продуктам.
Распространенными причинами повышенного вздутия живота у детей являются:
- Жареная и жирная пища.
- Газированные напитки.
- Бобовые.
- Овощи: брокколи, брюссельская капуста, белокочанная, цветная капуста, огурцы, зеленый перец, лук, горошек, редис.
- Фрукты: абрикосы, бананы, дыни, персики, груши, чернослив и сырые яблоки.
- Пшеница и пшеничные отруби.
Ведение дневника питания и симптомов может помочь выявить в рационе ребенка продукты, вызывающие вздутие живота. Затем обсудите диету с педиатром.
Питье большого количества воды и регулярные физические упражнения могут помочь уменьшить симптомы метеоризма у ребенка.
Как избавиться от газообразования?
Чтобы устранить проблему, необходимо определить ее фактическую причину. Однако следующие рекомендации могут помочь облегчить дискомфорт.
- Диета при вздутии живота должна включать чай из мяты перечной или ромашки, имбирь, куркуму, анис, фенхель, тмин, кориандр. Эти травы и специи помогают уменьшить газообразование. А чай из одуванчика способствует выведению воды.
- Капсулы с маслом мяты перечной являются естественным спазмолитиком и эффективны при запорах – помогают мышцам кишечника расслабиться.
- Антациды снимают воспаление в пищеварительном тракте и помогают легче выводить газы. Антациды часто включают активный ингредиент симетикон, который группирует более мелкие пузырьки газа вместе. Симетикон также принимают отдельно.
- Добавки магния помогают нейтрализовать желудочную кислоту и расслабить мышцы кишечника. Магний обладает естественным слабительным эффектом, который полезен время от времени, но может вызвать привыкание, если его принимать слишком часто.
- Пробиотики восстанавливают баланс микрофлоры кишечника, способствуют перевариванию пищи и поглощают избыток газов.
Если вы чувствуете вздутие, помассируйте живот справа налево, чтобы выпустить застрявший воздух.
В большинстве случаев вздутие живота и дискомфорт в брюшной полости не требуют медицинского лечения. Коррекция пищевых привычек может улучшить состояние. Однако если частота или тяжесть симптомов увеличивается, особенно если они сопровождаются потерей веса, диареей, рвотой или изжогой, следует немедленно обратиться к гастроэнтерологу для обследования.
Следите за дополнительной информацией и подписывайтесь на рассылку.
При воспроизведении данного материала активная ссылка на источник обязательна.








