Это можно объяснить расщеплением и химической связью. Достижение темы напоминает нам о межмолекулярных HF и водородных связях, которые делают эту кислоту самой слабой. Пока мы примем это как исключение: HF — самая слабая из этих кислот, а HI — самая сильная.
Сколько элементов в таблице Менделеева: 118 или 126?
Одной из самых популярных картин в мире является картина Менделеева. Название химического вещества указано в каждой ячейке. На их разработку было затрачено много усилий. В конце концов, это не просто список веществ. Они классифицируются в соответствии с их свойствами и характеристиками. И легко увидеть, как много информации содержится в картине Менделеева.
Менделеев не был первым ученым, решившим структурировать данные. Многие люди пробовали это. Никто не смог объединить их все в одну таблицу. Датой открытия периодического закона можно считать 17 февраля 1869 года. В этот день Менделеев представил свое творение — целую систему элементов, классифицированных в соответствии с их атомным весом и химическими свойствами.
Стоит отметить, что в одну счастливую ночь, когда он работал, блестящая идея не была доведена до сведения ученых. Это действительно работало около 20 лет. Он много раз смотрел на карту данных и изучал ее свойства. В это же время работали другие ученые.
От его имени химик Канизаро предложил теорию атомных величин. Он утверждал, что именно данные могут расставить все материи в правильном порядке. Более того, ученые Чантуркуа и Ньюлендса, работавшие в разных частях света, пришли к выводу, что, расположив элементы в соответствии с их атомным весом, они начнут объединяться дальше по другим свойствам.

Почему была выбрана именно таблица Менделеева?
В 1869 году вместе с Менделеевым были опубликованы примеры других картин. Однако сегодня мы не помним даже имен их авторов. Как это произошло — все связано с превосходством ученых над конкурентами.
- Таблица имела большее количество открытых элементов, чем у других.
- Если какой-то элемент не подходил по атомному весу, ученый помещал его на основе других свойств. И это было правильным решением.
- В таблице было много пустых мест. Менделеев сделал пропуски осознано, забрав тем самым частичку славы тех, кто в будущем найдет эти элементы. Он даже дал описание некоторых еще неведомых веществ.
Самым важным достижением является то, что этот стол не разрушается. Она так искусно создана, что будущие открытия обогатят ее.
Сколько элементов в таблице Менделеева
Каждый человек хотя бы раз в жизни видел этот стол. Однако точное количество веществ назвать сложно. Два возможных правильных ответа — 118 и 126. Давайте рассмотрим, почему это происходит.
Люди открыли в природе 94 элемента. Они ничего с ними не делали. Следует изучать только их свойства и характеристики. Большинство из них были в оригинальном настольном журнале.
Остальные 24 элемента были созданы в лаборатории. Таким образом, их общее число достигло 118. Остальные восемь элементов — это просто выдуманные вариации. Их только предстоит изобрести или приобрести. Таким образом, пока можно смело называть как 118-элементный вариант, так и 126-элементный.
От его имени химик Канизаро предложил теорию атомных величин. Он утверждал, что именно данные могут расставить все материи в правильном порядке. Более того, ученые Чантуркуа и Ньюлендса, работавшие в разных частях света, пришли к выводу, что, расположив элементы в соответствии с их атомным весом, они начнут объединяться дальше по другим свойствам.
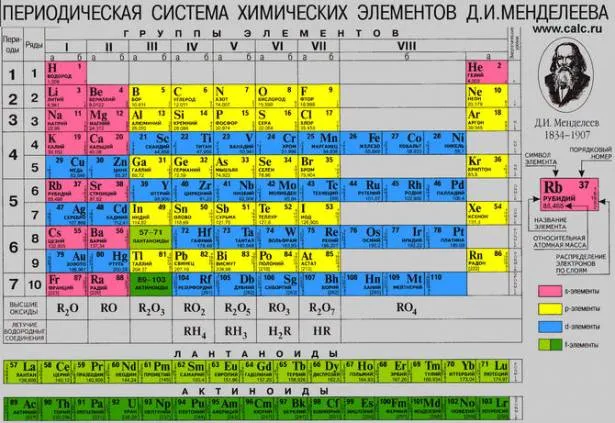
Классический вид периодической таблицы Менделеева
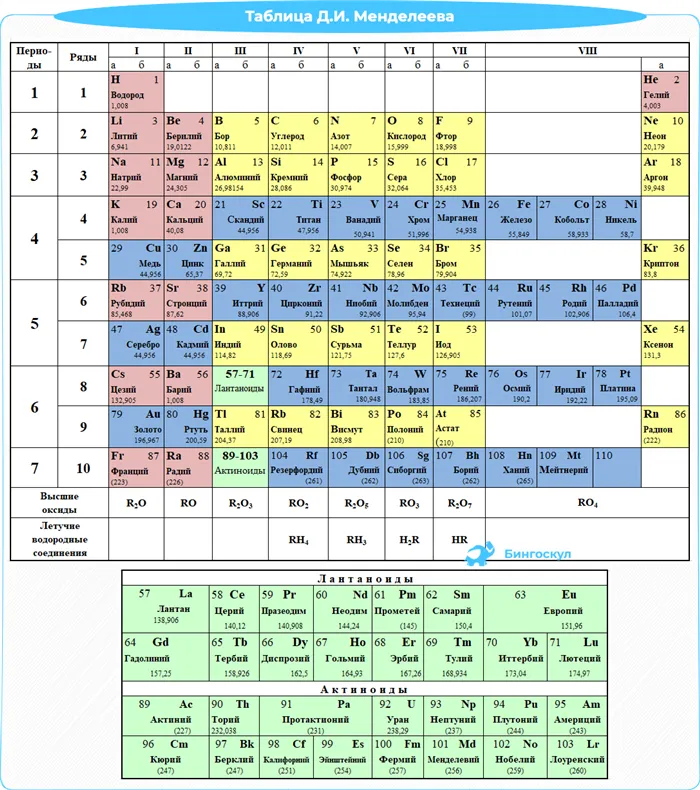
Ниже приведена таблица, имеющаяся в CHEMISTRYAPPLICATION, входящей в лицензионный пакет.
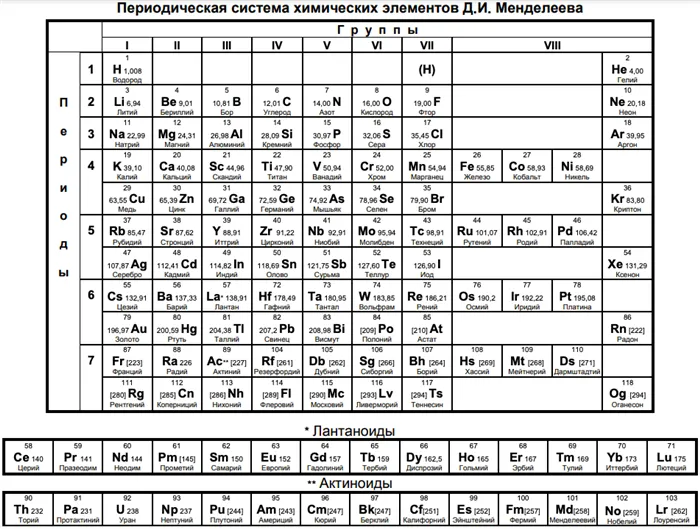
Периодический закон Менделеева
Периодический закон химических элементов имеет две формулировки — классическую и современную.
Классический Менделеев, высказанный первооткрывателем Д.И.:.
‘Свойства простых объектов, а также формы и свойства соединений элементов регулярно зависят от значения атомной массы элемента’.
Современный:.
Свойства простых веществ, а также свойства и формы соединений элементов периодически зависят от заряда (порядкового номера) ядер атомов элементов».
Появление журнальной системы положило начало новой, подлинно научной эре в истории химии и многих смежных наук. Вместо разрозненной информации о данных и соединениях появились целостные системы, позволяющие обобщать и делать выводы и прогнозы.
«Башня» из химических элементов
Периодическая таблица Adma была разработана Валерием Циммерманом в 2006 году. Вместо того чтобы основываться на атомных номерах, он перелистывает четыре квантовых числа конфигурации электронов, используемых для описания расположения и движения электронов внутри отдельного человека. Согласно статье в журнале Science Alert, идея возникла у старого инженера и биолога Чарльза Джанета. В его работе элементы были переставлены в соответствии с занятостью орбиталей — базовой вероятностью того, что электрон находится на определенном расстоянии от ядра.
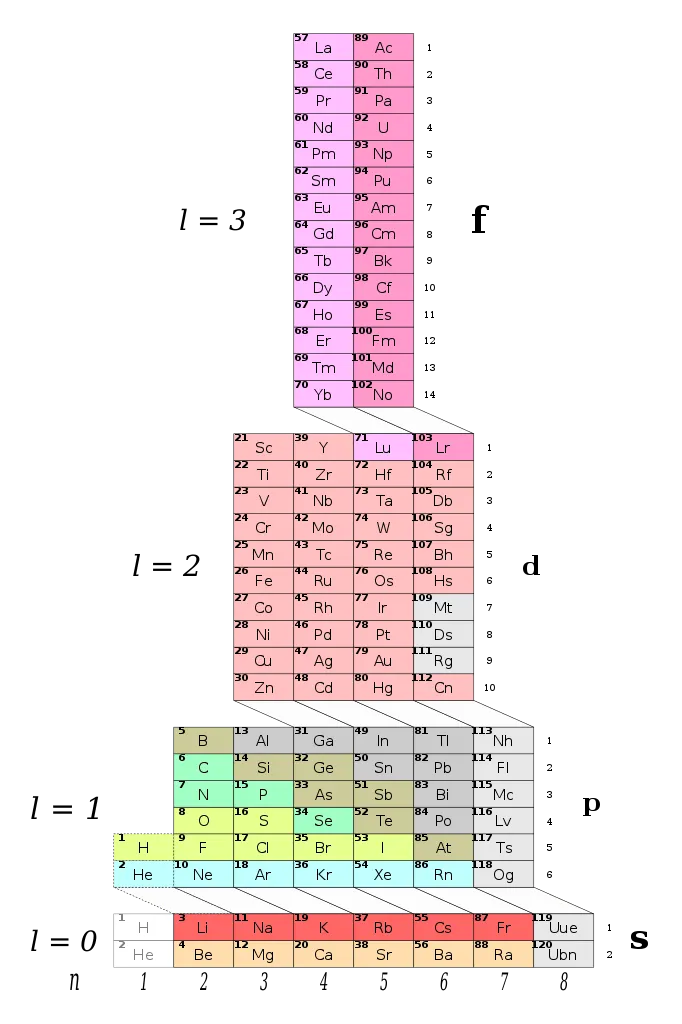
То же самое относится и к регулярной системе Адомаха
Читайте больше интересных статей о физике, химии и новостях мировой науки на канале Google News.
Цветок Менделеева

Сочетание химических веществ в системе может сбить с толку, особенно если смотреть на нее с разных сторон.
Стоит отметить, что в этой периодической таблице нет ни водорода, ни солнца. Первая секция (или лепесток) бирюзового цвета содержит щелочные металлы на лицевой стороне и щелочные металлы земли на обратной стороне. Остальные лепестки содержат остальные элементы, сгруппированные в соответствии с присущими им свойствами.
Лента периодических химических элементов
Варианты перемещения смотрите ниже. Таблица под названием «Периодическая таблица скрученных лент» была создана секцией Джеймса Франклина Хайда в середине двух циклов.
В циклической системе химических веществ каждый элемент имеет символ, название, порядковый номер и относительный индивидуальный вес.
Далее приведена таблица химических веществ и их взаимодействий
Однако панель начинается из центра правого круга с водорода, а затем расширяется на различные группы. Множество цветов подчеркивает регулярную взаимосвязь элементов. Красивые изгибы становятся одним из наших любимых вариантов, но они также очень напряженные. Чтобы увидеть, как все это действует, посмотрите периодическую таблицу, показывающую, как используются эти предметы.
Таким образом, рубид обладает самыми сильными металлическими свойствами, в то время как неметаллические свойства у него слабее. Сера обладает самыми слабыми металлическими свойствами, а с другой стороны, Бог — самый сильный неметалл.
Группы элементов с похожими свойствами
Группы — это вертикальные ряды в периодической таблице, которые определяют основные природные и химические свойства элементов. Вещества, принадлежащие к одной группе, имеют сходные химические свойства и демонстрируют одинаковую картину изменения при увеличении их индивидуального количества.
Все группы (столбцы таблицы) имеют номера 1-18 — слева направо (от щелочных металлов до благородных). Эта система вступила в силу в 1988 году по инициативе ИЮПАК. Все предыдущие названия групп, использовавшиеся в разных странах, больше не используются.
Предметы, принадлежащие к одной группе, располагаются сверху вниз по следующей схеме.
- Возрастает радиус атома элементов в рамках одной группы.
- Усиливаются металлические свойства элементов и ослабевают неметаллические.
- Падает электроотрицательность.
Цветовое определение групп
Вещества в каждой группе делятся на вещества главной подгруппы и вещества вторичной подгруппы. В таблице элементы боковых групп выделены синим цветом и включают только элементы с большой продолжительностью (начиная с четвертого периода). Основная подгруппа может включать как краткосрочные, так и долгосрочные элементы (начиная с первого или второго периода).
Различение металлов, металлоидов и неметаллов
Все химические элементы можно разделить на три типа в соответствии с их химическими и физическими свойствами
Металлы (например, медь, алюминий, золото): свойства металлов.
- Хорошая электро- и теплопроводность.
- Способность отражать свет (яркий внешний вид).
- Высокая температура плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Пластичность и податливость.
Неметаллы встречаются в природе в трех состояниях: газообразном (например, водород), жидком (например, бром) и твердом (например, фосфор). Характеризуется:.
- Неспособность проводить тепло и электричество.
- Разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Значительно более низкая температура плавления в сравнении с металлами.
- Хрупкость и ломкость.
Металлоиды обладают смешанными свойствами металлов и неметаллов (например, кремний). Их основными особенностями являются.
- Средняя тепло- и электропроводность.
- Внешний вид может быть схож с металлами или неметаллами.
- Различаются между собой по температуре плавления, плотности, цвету и форме.
Обозначение элементов
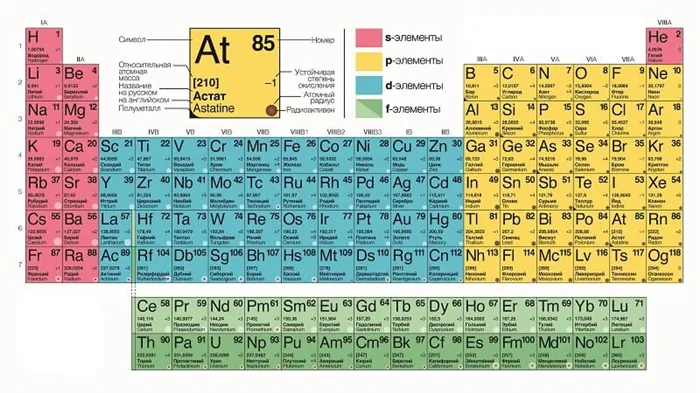
Каждая запись в периодической таблице Менделеева имеет свое название.
Буквенное, название
Таблица может содержать полное название вещества (например, углерод). В этом случае он помещается под химическим символом.
Символ — это сокращенное название элемента (например, солнце — это он).
В некоторых случаях название вещества в таблице не указывается, только химический символ. Символы обычно состоят из одной или двух латинских букв. Символ элемента находится в центре соответствующей ячейки таблицы.
Атомный номер
Атомный номер элемента обычно находится в верхней, центральной или угловой части соответствующей ячейки. Атомный номер всех элементов варьируется от 1 до 118. Атомный номер всегда является целым числом.
Массовое число
Массовое число — это общее количество протонов и нейтронов в ядре. Его легко определить, округлив атомный вес элемента до ближайшего целого числа.
Атомная масса написана в нижней части клетки, под символом элемента. Атомная масса представляет собой сумму масс частиц (протонов и нейтронов), составляющих ядро атома, и является средним значением, выраженным десятичной дробью для большинства элементов.
Например, атомная масса фосфора (P) составляет 30,97376, поэтому его массовое число (количество протонов и нейтронов в ядре) равно 31.
Валентность
Интенсивность — это свойство элемента, образующего химические связи.
Определить число валентных электронов из таблицы Менделеева несложно.
- Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
- Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 (всего 8 групп в таблице) вычесть № группы, в которой находится вещество.
Например, вещества первой группы главных подгрупп (Li, K) имеют валентность I, а элементы второй группы главных подгрупп (Mg, Ca) — валентность II. Мышьяк (As) относится к V группе главной подгруппы, поэтому его атомный показатель также равен V. Кроме того, вещество имеет еще одно атомное значение. Этот показатель определяется по приведенной выше формуле и равен III.
Если у вас есть трудности в обучении не только по химии, но и по другим предметам, обратитесь за помощью к образовательным ресурсам Phoenix.Help. Ни один предмет или задача не являются для нас слишком сложными!
Например, сравните значения EO атомов Te, In, Al и P. Индий принадлежит к той же группе, что и алюминий, с увеличением значений EO In→Al (снизу вверх). Алюминий находится в том же цикле, что и сера, и EO-ост увеличивает Al→S (слева направо). Если сравнивать серу и теллур, то сера находится в группе выше теллура и поэтому также имеет более высокую электроотрицательность.
Периодическая таблица элементов Менделеева длинная форма
Длинная форма (или форма длинного периода) картины Менделеева состоит из 18 групп, от щелочных металлов до благородных газов, слева направо, и считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Картины Менделеева можно скачать в малом или большом формате в цветном или черно-белом исполнении, открыв и сохранив изображения на своем компьютере по ссылке ниже.
____________
Источники.
1. большой химический справочник / А.И. Волков, — М.: 2005.
Большая энциклопедия химических элементов. Периодическая таблица Менделеева/И.А. Леенсон. -Москва: 2014.
Металлы — это главные подгруппы (подгруппы IA, IIA, IIIA, исключая бор) с номерами электронов интенсивности 1-3, а также элементы германий, олово, свинец, сурьма, висмут и полоний.
Периодический закон
Периодический закон был открыт Д.-И. Менделеева в 1868 году. Его современная формулировка выглядит следующим образом. Свойства химических элементов и образующихся из них соединений (простых и сложных) периодически зависят от величины заряда ядра.
Периодические законы лежат в основе современных учений о строении материи. Периодическая таблица Д. Менделеева является наглядным отражением периодического закона.
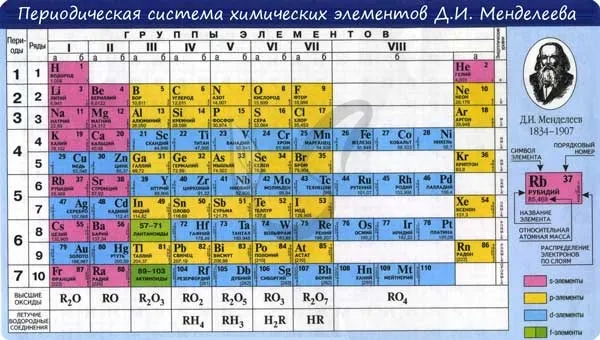
В периодической таблице элементы расположены в порядке возрастания атомной нагрузки и сгруппированы в «ряды и столбцы» (циклы и группы).
Периоды — это ряд химических элементов, расположенных горизонтально. Периоды 1, 2 и 3 называются короткими периодами и состоят из ряда элементов. Периоды 4, 5 и 6 называются длительными и состоят из двух серий химических элементов.
Группа — это вертикальный ряд химических элементов в периодической таблице. Элементы группируются по степени окисления до высшего оксида. Каждая из восьми групп состоит из главной подгруппы (a) и второстепенной подгруппы (b).
Периодическая таблица Д. Менделеева дает огромное количество ответов на самые разные вопросы. При правильном использовании его можно использовать для вывода структуры и свойств веществ, а также для успешной записи химических реакций при решении задач.
Атомный радиус
Атомный радиус — это расстояние между ядром и самым дальним орбитальным электроном. Он не является определенным, а представляет собой фиктивный предел, указывающий на наиболее вероятное положение электрона.
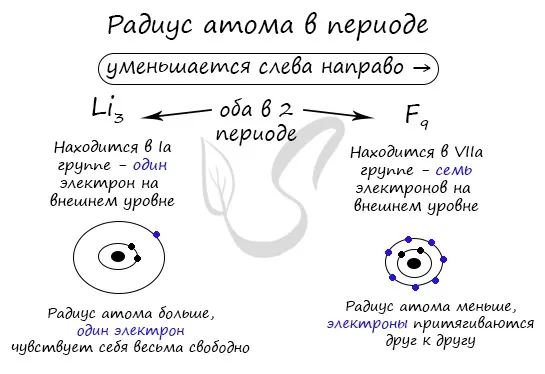
В данном периоде, по мере увеличения числа порядков элементов, атомный радиус уменьшается (‘→’ слева направо). Это происходит потому, что с увеличением числа групп увеличивается и число электронов на внешней поверхности. Обратите внимание, что для элементов главной подгруппы номер группы равен числу электронов на внешней поверхности.
По мере увеличения числа электронов их становится больше, поскольку они сильнее притягиваются друг к другу. Именно поэтому радиус атома мал.
Чем меньше электронов, тем больше степеней свободы и тем больше радиус атома, поэтому радиус увеличивается справа налево в течение периода ‘←’.
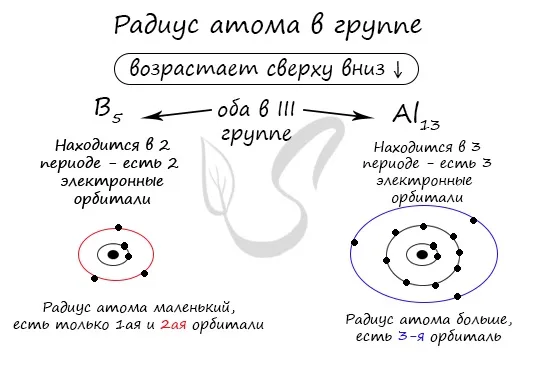
В группах радиус атома увеличивается по мере загрузки ядра — ‘↓’ сверху вниз. Чем длиннее период, тем больше электронных орбиталей вокруг атома, что приводит к увеличению радиуса атома.
По мере уменьшения нагрузки на индивида в группе, уменьшается его радиус — ‘↑’ снизу вверх. Это происходит из-за уменьшения числа орбитальных электронов вокруг атома. Возьмем для примера атомы элементов бора и алюминия, которые принадлежат к одной группе.
Периоды, группы и конфигурации электронов
И снова мы хотели бы подчеркнуть важную деталь. Одна и та же группа (главная подгруппа!) ) элементы, принадлежащие к одной группе, имеют схожие конфигурации внешнего слоя. Таким образом, бор имеет три электрона на своей внешней поверхности, и алюминий также имеет три электрона на своей внешней поверхности. Оба относятся к группе III.
Такие детали могут значительно облегчить жизнь, но не присутствуют в элементах подгрупп. В подгруппах электроны должны быть размещены на электронных орбиталях и измерены «вручную».








