2.2 Цинк реагирует с минеральными кислотами (например, соляной, фосфорной и разбавленной серной). В результате образуются соль и водород.
Свойства цинка и его взаимодействие с другими веществами
Обратите внимание, что вся информация на сайте Prowellness носит исключительно информационный характер и не является личной рекомендацией, инструкцией или медицинским заключением. Не используйте эти материалы для диагностики, лечения или выполнения медицинских процедур. Перед применением любой методики или использованием любого продукта проконсультируйтесь с врачом. Данный сайт не является профессиональным медицинским порталом и не заменяет профессиональную медицинскую консультацию. Владелец данного сайта не несет ответственности перед любой стороной, понесшей косвенные или побочные убытки в результате неправильного использования материалов данного ресурса.
Цинк относится к группе металлов и вступает в реакцию с различными химическими элементами. Как он реагирует?
Цинк классифицируется как металл и обладает всеми его свойствами. Ему присущи блеск, твердость, пластичность, тепло- и электропроводность. Однако при определенных условиях цинк может проявлять неметаллические свойства.
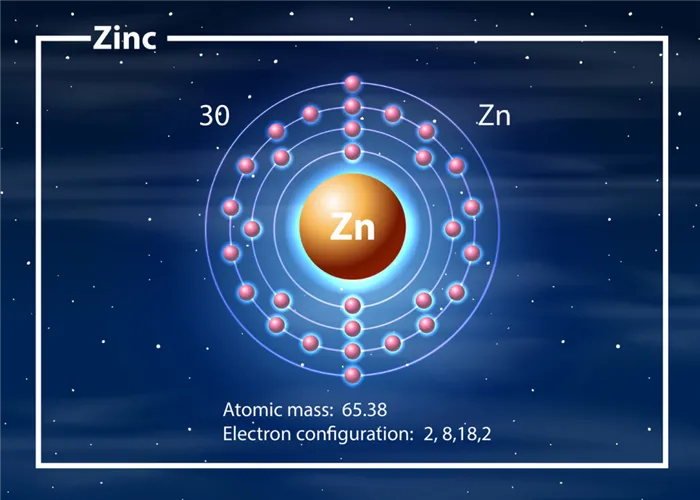
Характеристики цинка

Цинк имеет приятный серебристо-голубой цвет. При нормальных температурных условиях он гибкий, а иногда хрупкий. Металлы используются для упаковки в листы. Через некоторое время на листьях образуется тонкий слой оксида, и цинк перестает взаимодействовать с воздухом. Со временем она начинает слегка мутнеть и теряет свой блеск.
В таблице Менделеева номер химического элемента равен 30. Он относится к группе переходных металлов. Он называется Zn.
Где содержится цинк?
В 18 веке Уильяму Чемпиону удалось получить чистый цинк. До этого он использовался в сочетании с медью, и конечный продукт был известен как латунь.
В земной коре содержится большое количество цинка. Для промышленных целей цинк добывают из источников тепла.
Роль цинка в жизни растений и животных очень важна. Он является важным биологическим элементом.
Взаимодействие цинка с водой
Когда вода нагревается до высоких температур, при взаимодействии с водой образуется оксид цинка.
Цинковые концентраты обжигаются в печах. Сульфид цинка преобразуется в оксид цинка. В процессе выделяется сернистый газ SO2, который используется для производства серной кислоты.
Физические и химические свойства цинка
Температура плавления цинка составляет 420°C. В нормальных условиях это хрупкий металл. Нагрев до 100-150°C повышает пластичность и вязкость цинка, и металл можно использовать для производства кабелей и листового проката. Температура кипения цинка составляет 906°C. Металл является отличным проводником. Начиная с 200°C, цинк легко превращается в серый порошок и теряет свою пластичность. Металл обладает отличной теплопроводностью и теплоемкостью. Приведенные выше физические параметры позволяют использовать цинк в сочетании с другими элементами. Латунь — самый известный сплав цинка.

Фотография месторождения духовых инструментов.
При нормальных условиях поверхность цинка быстро покрывается оксидами в виде серо-белых тусклых бляшек. Они образуются потому, что кислород воздуха окисляет чистое вещество. Цинк как простое вещество реагирует с медью, лошадью, кислородом, фосфором, щелочами, кислотами, аммиаком (его солями) и аммиаком. Цинк не реагирует с азотом, водородом, бором, углеродом или кремнием. Химически чистый цинк не реагирует с кислотными и щелочными растворами. Цинк сохраняет воду и реагирует со щелочами, образуя комплексные соединения, называемые солями гидроксина. Нажмите здесь, чтобы ознакомиться с экспериментом, который можно провести дома для изучения свойств цинка.
Реакция серной кислоты с цинком и получение водорода
Взаимодействие разреженной серной кислоты с цинком является основным экспериментальным методом получения водорода. Для этого используется чистый гранулированный цинк или цинковые техники в виде осколков и стружки.
При использовании очень чистого цинка и серной кислоты водород выделяется медленно, особенно в начале реакции. Поэтому после разбавления в охлаждающий раствор можно добавить немного раствора сульфата меди. Металлическая медь, осажденная на поверхности цинка, ускоряет реакцию. Лучшим способом разбавления кислоты для получения водорода является разбавление плотной серной кислоты в воде с плотностью 1,19 в соотношении 1:1.
Реакция концентрированной серной кислоты с цинком
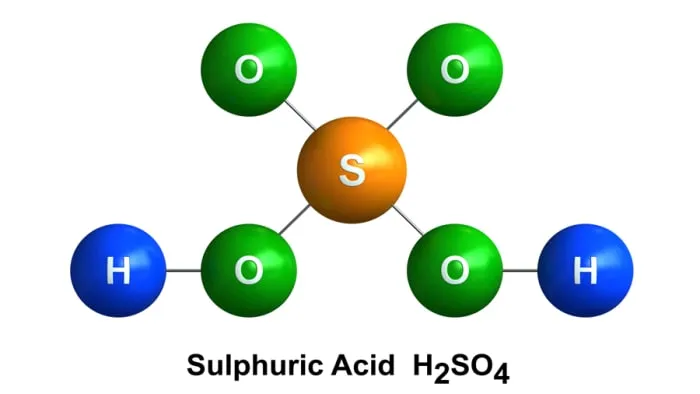
Фото кредиты.
Средой окисления в густой серной кислоте является сульфат-ион, который является самой сильной средой окисления, а не водородный полюс. Сильная гидратация и, следовательно, низкая подвижность — это не то, что вступает в реакцию окисления для разбавления серной кислоты.
То, как серная кислота реагирует с цинком в концентрации, зависит от температуры и концентрации. Уравнение реакции выглядит следующим образом.
4Zn +5H₂SO₄ = 4ZnSO₄ +H₂S +4H₂O
Концентрированная серная кислота является мощной окислительной средой благодаря своим условиям окисления (S⁺⁶). Он взаимодействует с металлами с низкой потенцией, т.е. до и после водорода, и, в отличие от разреженных кислот, не выделяет водород в этих реакциях. В результате реакций сахарной серной кислоты с металлами всегда образуются три продукта: соль, вода и продукты восстановления серы. Концентрированная серная кислота является очень мощной окислительной средой и может даже окислять некоторые безотходные продукты (углерод, серу и фосфор).
Растворимые соли цинка и сильных кислот гидролизуются катионами. Гидролиз происходит постепенно и обратимо. Другими словами, это происходит только постепенно.
Реакции, взаимодействие цинка с оксидами. Уравнения реакции:
Реакция между цинком и водой происходит с образованием оксида цинка и водорода
Zn + Co2 → ZnO + CO (T = 800-950°C).
Реакция между цинком и оксидом углерода (IV) происходит путем образования цинка и оксида углерода (II).
В результате реакции цинка с оксидом азота (IV) образуется оксид азота (II) и нитрат цинка.
Цинк и оксид серы реагируют с дитионитом цинка. Реакция протекает в водном растворе этанола.
Реакции, взаимодействие цинка с солями. Уравнения реакции:
Нитрат и цинк реагируют, образуя серебро и цинк.
Азот свинца и цинка реагируют с образованием нитрата свинца и цинка.
3. реакция взаимодействия сульфата цинка и меди:.
Реакции взаимодействия меди и цинка происходят с образованием сульфата цинка и сульфата меди.
Реакции взаимодействия меди и цинка происходят с образованием хлорида цинка и хлорида меди.
Реакции, взаимодействие цинка с кислотами. Уравнения реакции:
Цинк и азотная кислота реагируют с образованием нитрата цинка, оксидов азота (IV) и воды. Для реакции используется теплый густой раствор азотной кислоты.
Реакция между цинком и ортофосфорной кислотой протекает с образованием гидрофосфата цинка и водорода. В первой реакции используется горячий концентрированный раствор ортофосфорной кислоты.
Аналогичные реакции происходят и с другими минеральными кислотами.
Цинк — это хрупкий металл голубоватого цвета, который быстро тускнеет на воздухе и активно реагирует с кислотами и щелочами. Основное применение цинка — в гальванических процессах для покрытия железных предметов для защиты их от коррозии, а также в качестве компонента различных сплавов (например, меди в латуни).
Способы получения
Оксид цинка может быть получен различными методами:
1. путем окисления цинка кислородом:
2Zn + O2 → 2ZnO
2. Гидроксид цинка разлагается при нагревании:
3. Оксид цинка можно получить путем разложения нитрата цинка:
Химические свойства
Оксид цинка является типичным амфотерным оксидом. Он реагирует с кислотными и основными оксидами, кислотами и щелочами.
1. Когда оксид цинка реагирует с основными оксидами, образуются соли цинка.
Например, оксид цинка реагирует с оксидом натрия:
Оксид цинка взаимодействует с растворимыми основаниями (щелочами). Оксид цинка образует соли цинка (соли цинка) в расплаве и комплексные соли в растворе. В то же время оксид цинка проявляет кислотные свойства.
Например, оксид цинка реагирует с гидроксидом натрия в расплаве с образованием оксида цинка натрия и воды:
Оксид цинка растворяется в избытке щелочного раствора с образованием тетрагидрокси-цинката:
3 Оксид цинка не реагирует с водой.
Оксид цинка реагирует с кислотными оксидами. Образуются соли цинка. В этих реакциях оксид цинка проявляет основные свойства.
Например, оксид цинка реагирует с оксидом серы (VI) с образованием сульфата цинка:
5. Оксид цинка реагирует с растворимыми кислотами с образованием солей.
Например, оксид цинка реагирует с соляной кислотой:
ZnO + 2HCl = ZnCl2 + h2o
6. Оксид цинка обладает слабыми окислительными свойствами.
Например, оксид цинка при нагревании реагирует с углеродом и окисью углерода:
ZnO + C(コカコーラ). → Zn + CO
ZnO + CO → Zn + CO2
7. Оксид цинка представляет собой твердое, нелетучее вещество. Следовательно, он вытесняет более летучие оксиды (обычно углекислый газ) из солей во время плавления.
Например, из карбоната бария:
Гидроксид цинка
Способы получения
1. Гидроксид цинка можно получить, пропуская диоксид углерода, диоксид серы или сероводород через раствор тетрагидроксициннамата натрия:
Чтобы понять, как протекает эта реакция, можно воспользоваться простым приемом: мысленно проанализировать исходное вещество Na2Zn(OH).4 на составные части NaOH и Zn(OH)2。 Затем мы определяем, как углекислый газ реагирует с каждым из этих веществ, и записываем продукты их взаимодействия. Поскольку Zn(OH)2 не вступает в реакцию с CO2, запишите в правой части Zn(OH)2 変更なし。
2. Гидроксид цинка может быть получен действием щелочи на избыток соли цинка.
Например, хлорид цинка реагирует с дефицитом гидроксида калия с образованием гидроксида цинка и хлорида калия:
Химические свойства
1. Гидроксид цинка реагирует с растворимыми кислотами.
Например, гидроксид цинка реагирует с азотной кислотой с образованием нитрата цинка:
2. Гидроксид цинка реагирует с кислотными оксидами.
Например, гидроксид цинка реагирует с оксидом серы (VI) с образованием сульфата цинка:
3. гидроксид цинка реагирует с растворимыми основаниями (щелочами). Гидроксид цинка взаимодействует с растворимыми основаниями (щелочами), образуя в расплаве комплексные соли цинка. В то же время гидроксид цинка проявляет кислотные свойства.
Например, гидроксид цинка взаимодействует с гидроксидом калия в расплаве с образованием цинкового калия и воды.
Гидроксид цинка растворяется в избытке щелочи с образованием тетрагидроксона цинка.
4. гидроксид цинка разлагается при нагревании.
Соли цинка
Нитрат и сульфат цинка
Нитрат цинка при нагревании разлагается на оксид цинка, оксид азота (IV) и кислород.
Сульфат цинка разлагается на оксид цинка, диоксид серы и кислород.
Комплексные соли цинка
Для описания свойств комплексных солей цинка (гидроксицинат цинка) полезно использовать следующий метод Психическое разложение тетрагидроксицината на две отдельные частицы (гидроксид и гидроксид цинка).
Например, тетрагидроксицинат натрия разделяют на гидроксид цинка и гидроксид натрия.
Na2Zn(OH).4 разлагается на NaOH и Zn(OH).2
Свойства комплекса в целом могут быть определены как свойства этих отдельных соединений.
Таким образом, гидроксикомплексы цинка реагируют с кислотными оксидами.
Например, гидроксикомплекс разлагается под действием избытка углекислого газа. В этом случае NaOH реагирует с CO2 реагирует с NaOH с образованием кислых солей (в избытке CO2), в то время как амфотерный гидроксид цинка не реагирует с диоксидом углерода и просто выпадает в осадок: гидроксид цинка не является продуктом реакции.
Аналогичным образом тетрагидроксициннамат калия реагирует с углекислым газом.
Однако амфотерный гидроксид цинка реагирует с сильными кислотами, поэтому воздействие избытка сильной кислоты не приведет к выпадению осадка.
В случае с соляной кислотой, напр.
Однако под действием небольшого (недостаточного) количества сильной кислоты осадок все равно выпадает, и кислоты не хватает для растворения гидроксида цинка.
Аналогично, в отсутствие азотной кислоты выпадает в осадок гидроксид цинка.
Когда вода испаряется из объединенного раствора и полученный материал нагревается, остаются обычные соли цинка.
Гидролиз солей цинка
Растворимые соли цинка и сильных кислот гидролизуются катионами. Гидролиз происходит постепенно и обратимо. Другими словами, это происходит только постепенно.
Стадия I: Zn 2+ + H2O = ZnOH + + + H +
Стадия II: ZnOH + H2O = Zn(OH)2 + H +
Более подробную информацию о гидролизе см. в соответствующей статье.
Цинкаты
Соли цинка (соли цинка) образуются из оксида цинка, когда он соединяется со щелочными и основными оксидами с образованием кислотных остатков.
Чтобы понять свойства солей цинка, их можно также мысленно проанализировать с помощью двух отдельных веществ.
Например, цинк-натрий можно мысленно разделить на два вещества — оксид цинка и оксид натрия.
Na2ZnO2 анализируется с помощью Na2O и ZnO
Тогда становится ясно, что соли цинка реагируют с кислотами, образуя соли цинка.
Под воздействием избытка воды соли цинка преобразуются в комплексные соли.
Сульфид цинка
Сульфид цинка — это так называемый «белый сульфид». Сульфид цинка нерастворим в воде, но минеральные кислоты вытесняют сероводород из сульфида цинка (например, HCl).
ZnS + 2HCl → ZnCl2 + h2S








