В простых веществах неметаллические атомы связаны нековалентными, неполярными связями. Это формирует электронные системы, более стабильные, чем у изолированных людей. В этом случае они бывают простыми (например, молекулы водорода H2, галогенов KI, BR2), двойными (например, в молекулах бога имеются ковалентные связи (например, в молекулах азота).
Свойства простых веществ − неметаллов
Существует всего 16 неметаллических химических веществ, два из которых, кислород и кремний, составляют 76% земной коры. Неметаллы составляют 98,5% массы растений и 97,6% массы человека. Углерод, водород, кислород, сера, фосфор и азот составляют все важнейшие органические вещества и являются элементами жизни. Водород и солнце — важные элементы Вселенной и всех светящихся объектов, включая наше солнце. Невозможно представить нашу жизнь без неметаллических соединений, особенно если учесть, что самые важные соединения воды состоят из водорода и кислорода.
Если провести диагональную линию от бериллия до ататиона в журнале «Система», то неметаллические элементы находятся вверху с правой стороны, а с левой стороны — металлы, относящиеся ко всем подгруппам, лантаниды и элементы киви. К ним. Элементы, расположенные близко к диагонали, такие как бериллий, алюминий, титан, германий и сурьма, являются бинарными и относятся к металлоидам. Неметаллические элементы: s-группа 13 — водород — P-P-GROUP 13 — бор группа 14 — уголь и кремний группа 15 — азот, фосфор и мужской элемент группа 16 — кислород, сера, селен и элементы группы телеус группа 17 — фтор, хлор, бром, йод и буржуазия. Особое место занимают элементы группы 18 — инертные газы. Они имеют полностью интегрированный внешний электронный слой и занимают промежуточное положение между металлами и неметаллами. Иногда их считают неметаллами, обычно по естественным причинам.

Неметаллы — это химические вещества, в которых индивиды получают электроны для завершения внешнего энергетического уровня, образуя тем самым отрицательно заряженные ионы.
Неметаллические атомы имеют от трех до восьми электронов в своем внешнем электронном слое.
Почти все металлы имеют относительно небольшие лучи и многочисленные электроны на внешних энергетических уровнях 4-7, характеризующиеся высокими электронными и окислительными свойствами. Таким образом, по сравнению с атомами металлов, неметаллы имеют
— более четырех электронов, на внешних энергетических уровнях.
Поэтому важнейшая характеристика неметаллических индивидов — склонность принимать электроны, недостающие до восьми, то есть окислительные свойства. В качестве качественной характеристики неметаллических атомов, т.е. своеобразной меры неметалличности, можно привести свойства электронов, т.е. химических элементарных людей. самих себя.
Первой научной классификацией химических веществ было разделение на металлы и неметаллы. Эта классификация не утратила своего значения. Неметаллы — это химические вещества, характеризующиеся способностью индивидов принимать электроны до завершения внешнего слоя, благодаря наличию четырех или более электронов во внешнем электронном слое и небольшому радиусу индивида по сравнению с атомами. .
Это определение исключает инертные или благородные газы, которые являются элементами главной подгруппы группы VIII. Электронный состав людей этих элементов таков, что их нельзя отнести ни к металлическим, ни к неметаллическим. Это предметы, которые делят элементы на металлические и неметаллические, занимая лишь небольшое место между ними. Инертные газы или вельд («вельд» представлен как неактивный) могут быть формально классифицированы как неметаллы только по естественным причинам. Эти вещества остаются газами при очень низких температурах. Например, солнце не переходит в жидкое состояние при T° = -268,9°C.
Строение и физические свойства неметаллов
В простых веществах неметаллические атомы связаны нековалентными, неполярными связями. Это позволяет сформировать более стабильную электронную систему, чем в случае с изолированными людьми. Образуются простые связи (например, водород hmmies h2, галогены f2, b2, I2), двойные (например, молекулы серы2), тройной (например, молекула азота n2) мириады облигаций.
- Ковкость отсутствует
- Блеска нет
- Теплопроводность (только графит)
- Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
- Электропроводность (только графит и черный Фосфор.)
- газы – H2, o2, o3, n2; f2, кл.2;
- жидкость – Br2;
- твердые вещества – модификации серы, фосфора, кремния, углерода и др.
В отличие от металлов, неметаллы — это простые вещества, характеризующиеся различными свойствами. Неметаллы имеют различные ситуации агломерации при нормальных условиях.
- газы – H2, o2, o3, n2; f2, кл.2;
- жидкость – Br2;
- твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Цветовой спектр неметаллов гораздо богаче: красный у фосфора, красно-коричневый у брома, желтый у серы, желто-зеленый у хлора, фиолетовый у паров йода. Безотходное производство более способно к отчуждению металла.
Способность отдельных химических веществ образовывать различные простые вещества называется гомологичностью, а эти простые вещества — гомологичными модификациями.
Простые вещества — неметаллы могут иметь
1. молекулярная структура. В общих условиях большинство из этих веществ являются газами (H2, n2, o2; f2, кл.2, o3или твердые частицы (i2, p4, s8), и только бром (Br2) она влажная. Все эти вещества являются летучими из-за своей молекулярной структуры. Как твердые вещества, они легко воспламеняются из-за слабых алмазных взаимодействий, которые удерживают молекулы в кристаллах и могут испаряться.
2. индивидуальная структура. Эти вещества состоят из больших цепочек индивидуумов (cn, bnsin, sen, TEn). Из-за высокой прочности ковалентных связей они обычно обладают большой твердостью, а изменения (плавление, испарение), связанные с распадом ковалентных связей в кристалле, происходят с большими затратами энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а их летучесть очень низка.
Многие безотходные материалы образуют разнообразные простые вещества — гомогенные модификации. Эта собственность индивида называется отчуждением. Альянсы также могут быть связаны с различным составом молекул (o2, �. 3) различных кристаллических структур. Графит, алмаз, карбин и фулл являются модификациями одной и той же системы углерода. Для определения свойств, характеризующих все неметаллические объекты, необходимо обратить внимание на периодическую систему элементов и формирование внешнего электронного слоя.

Окислительные свойства простых веществ — неметаллов
Неметаллические индивиды, а значит и образуемые ими простые вещества, характеризуются как окислительными, так и восстановительными свойствами.
Окислительные свойства неметаллов впервые проявляются при их взаимодействии с металлами (металлы всегда являются восстановительным средством):…

Окислительные свойства хлора Cl2Металл Fe, который в соединении имеет стабильные степени окисления +2 и +3, таким образом, окисляется до более высокой степени окисления.
Большинство неметаллов проявляют свойства окисления при взаимодействии с водородом. Это приводит к образованию летучих водородных соединений. 2.2.

Большинство неметаллов реагируют с водородом, образуя летучие водородные соединения. 2:
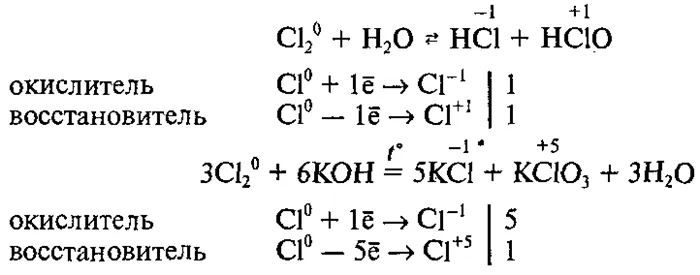
Сера имеет более высокую электроотрицательность, чем фосфор, и поэтому обладает здесь окислительными свойствами.
Фторид имеет более высокую электроотрицательность, чем все остальные химические элементы, и поэтому обладает окислительными свойствами. Фторид F2 -самый сильный окислитель среди неметаллов — проявляет в реакции только окислительные свойства. 3.3.
Окислительные свойства неметаллов также проявляются в реакциях с некоторыми соединениями.
Сначала остановимся на окислительных свойствах неметаллического кислорода в реакциях с композитными материалами.

Помимо кислорода, другие неметаллы могут быть окислителями в реакциях с соединениями — неорганическими (1, 2) и органическими (3, 4).
Мощный окисляющий агент хлор Cl2 окисляет хлорид железа (II) до хлорида железа (III) и

Хлор Cl2 Более мощный окислитель, вытесняет йод I2 без раствора йодистого калия.
Галогенирование метана является характерной реакцией алканов.
Качественной реакцией для ненасыщенных соединений является их обесцвечивание в бромированной воде.

Анионы хлора также играют важную биологическую роль для человека, поскольку они участвуют в активации определенных ферментов. С их помощью в желудке сохраняется благоприятная среда и поддерживается осмотическое давление. Хлор обычно всасывается в организм человека через поваренную соль при употреблении пищи.
Физические свойства неметаллов. Аллотропия
Если рассматривать металлы, то общие свойства, которые можно увидеть невооруженным глазом, — это блеск металла, инертность твердого тела (за исключением жидкой ртути), теплопроводность и электропроводность.
Для неметаллов все гораздо сложнее. Они могут иметь молекулярную или немолекулярную структуру. Из-за различий в структуре простые неметаллы существуют в трех состояниях сборки.
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство неметаллов являются неадекватными проводниками электричества и тепла.
Исключением является графит, разновидность углерода.
Аллотропия — это уникальная способность неметаллических элементов образовывать разнообразные простые вещества. В природной среде существуют аллотропные модификации элементов с различными физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в разделе «Химия». Шаг 9.
Химические свойства неметаллов
Как упоминалось выше, группы неметаллов очень разнообразны и могут проявлять как окислительные, так и восстановительные свойства, в зависимости от типа реакции, в которой они участвуют. Фтор является исключением из этого правила. Фториды всегда являются окислителями.
В ряду F, O, N, CL, Br, I, S, C, Se, P, As, Si и H окислительные свойства снижены. Кислород может обладать восстановительными свойствами только в случае фторидов.
В таких реакциях проявляются свойства окисления, и неметалл принимает электроны, образуя отрицательно заряженные частицы.
Почти все неметаллы реагируют с водородом. Единственным исключением из этого типа реакции являются инертные газы. Продуктом реакции является летучее водородное соединение: летучее водородное соединение
P + 5O2 = 2P2O5 4. Взаимодействие с водой и кислотами не характерно для неметаллов.
История открытия неметаллов
Медные инструменты, железные инструменты, золотые украшения — люди давно заметили, что все эти вещества обладают определенными общими свойствами.
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В отличие от металлов, существовали и другие вещества, которые не обладали свойствами металлов и были названы неметаллами. К концу XVII века алхимикам были известны только два неметаллических металла — углерод и сера.
В 1669 году Блад обнаружил пули из белого фосфора во время поисков философского камня. Затем, между 1748 и 1798 годами, было открыто около 15 новых металлов и пять неметаллов.
Усилия по обнаружению фтора стоили исследователям не только здоровья, но и жизни. Дейви, братья Нокс, Гей Люссак — вот неполный список жертв науки, которые потеряли свое здоровье, пытаясь отделить фтор от фтористой глины. Только в 1886 году Муассан решил эту сложную задачу с помощью электролиза. Затем в его руки попали первые галогены и токсичный хлор. Во время Первой мировой войны он использовался в качестве оружия массового поражения.
За некоторыми исключениями (золото, медь и т.д.), вы знаете, что большинство металлов имеют характерный серебристо-белый цвет. Однако цветовая гамма простых неметаллических материалов гораздо разнообразнее.
Физические свойства неметаллов.
Некоторые неметаллические простые вещества бывают газообразными (фтор, хлор, кислород, озон, азот, водород), жидкими (бром) и твердыми (йод, кремний, сера и т.д.). Цвет простых неметаллических веществ также варьируется: темно-серый, почти фиолетовый (йод), красный (фосфор), желтый (сера) и желто-зеленый (хлор). Точки кипения и плавления обычных неметаллов также различаются. Например, графит начинает плавиться при температуре 3 800°C, а азот закипает при температуре -195,8°C.
Эти различия обусловлены двумя типами кристаллических решеток, характерных для простых веществ, образованных из неметаллов.
Химические свойства неметаллов.
В случае неметаллов — простые вещества характеризуются как окислительными свойствами (реакции с металлами и водородом), так и восстановительными свойствами (реакции с наиболее электроотрицательными неметаллами и окисленными соединениями).
Теперь мы переходим к рассмотрению специальной серии, а именно серии электроотрицательности.

Положение неметаллических элементов в этом ряду определяется не только их электроотрицательностью, но и характеризует изменение окислительно-восстановительных свойств образуемых ими простых веществ.

- Взаимодействие неметаллов с металлами было рассмотрено в предыдущем конспекте. Оно характеризует окислительные свойства неметаллов.
- Неметаллы проявляют окислительные свойства по отношению к водороду или его соединениям, например, в реакциях, которые лежат в основе получения аммиака и соляной кислоты:
- В реакциях с органическими соединениями неметаллы, образованные элементами с высокой электроотрицательностыо, также проявляют окислительные свойства. Например:
- В реакциях со фтором и кислородом неметаллы проявляют восстановительные свойства, например, в реакциях горения неметаллов, которые имеют практическое значение для получения кислот и других ценных химических продуктов: S + O2 = SO2↑4P+5O2 =2Р2О5
- В реакциях со сложными веществами — сильными окислителями неметаллы проявляют восстановительные свойства. Например, взаимодействие фосфора с бертолетовой солью составляет основу производства спичек: 6Р + 5КС lO3 = 5KS l + 3P2 O5
Характеризуя окислительно-восстановительные свойства неметаллических элементов в зависимости от их положения в ряду электроотрицательности, следует помнить, что этот ряд описывает свойства химических элементов, т.е. неметаллических атомов, а не простых веществ.
На сравнительную активность неметаллических простых веществ указывает порядок активности галогенов: F2 > CI2 > Bg2 > I2
Так, хлор замещает бром из раствора бромистого водорода или бромистого калия: C l2 + 2KBr = 2KS l + Bg2
Затем бром может заменить наименее активный йод из раствора йода: Br2 + 2K I = 2KBr + I2
Химия неметаллов (таблица)

Конспект курса химии по неметаллам. Учебник «Химия. 11 класс: Учебник для общеобразовательных учреждений: базовый уровень / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков.- М.:Просвещение. глава III. Вещества и их свойства. Выберите дальнейшие действия.
Неметаллы — это, как правило, химические элементы, характеризующиеся наличием четырех или более электронов во внешнем электронном слое и способностью атомов принимать электроны до завершения внешнего слоя из-за малого атомного радиуса атома. К атомам металлов.
Таблица расположения неметаллов
| Группа | I | III | IV | V | VI | VII | VIII |
| Первый период | H | He | |||||
| Второй период | B | C | N | O | F | Ne | |
| Третий период | Si | P | S | Cl | Ar | ||
| Четвертый период | As | Se | Br | Kr | |||
| Пятый период | Te | I | Xe | ||||
| Шестой период | At | Rn |
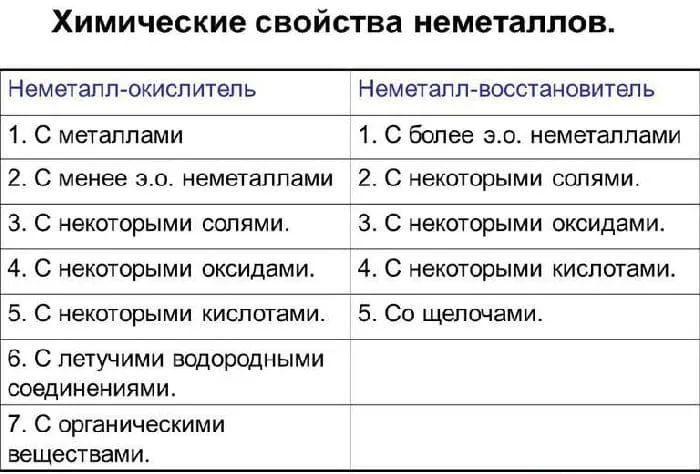
Рисунок 3.Таблица химических свойств неметаллов.








