Таким образом, можно сформулировать понятие количества материи: одна молекула содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро).
Уравнение состояния идеального газа
Законное уравнение для идеального газа называется уравнением Менделеева-Клапейрона. Давление смеси химически невзаимодействующих газов равно некоторому общему давлению, закон Дальтона.
Страница-> Решения по физике содержит решения задач и заданий с решенными примерами для всех задач по физике.
Уравнение состояния идеального газа
Уравнение состояния идеального газа имеет вид p = nkt и называется уравнением Менделеева-Клапейрона, которое описывает связь между тремя наиболее важными макроскопическими параметрами идеального газа — давлением, объемом и температурным режимом. Поэтому уравнение Менделеева-Клапейрона также называют законным уравнением для идеального газа.
В предыдущей главе было показано, что для описания свойств газа можно использовать величины, характеризующие молекулярный мир (микромир), такие как молекулярная энергия, скорость и масса. Определить эти размеры можно только расчетным путем. Все эти величины называются крошечными («микро» по-гречески — маленький).
Однако такие размеры можно использовать и для описания свойств газов. Их значения находят с помощью простых приборов, таких как давление, температура и объем газа. Такие значения размеров называются макроскопическими («макро» по-гречески — большой), поскольку они определяются общим действием огромного числа молекул.
Соотношение (4.1): термодинамические параметры газа. Наиболее важными термодинамическими параметрами газа являются объем V, давление P и температура T.
Для данной массы поглощенного газа t при постоянных значениях p, v и t газ находится в равновесии. При изменении этих параметров происходит газовый процесс. Если этот процесс состоит из ряда постоянно сменяющих друг друга ситуаций уравновешивания газа, то он называется процессом уравновешивания. Если параметры быстро меняются, процесс балансировки должен развиваться медленно, поскольку давление и температура не могут иметь одинаковые значения во всем объеме газа. В данной главе рассматривается только процесс уравновешивания газа, при этом масса газа остается стабильной.
По окончании процесса газ находится в новой ситуации, и его параметры обычно получают новое фиксированное арифметическое значение, отличное от цены в начале процесса. Для газов постоянной массы, если значения всех параметров в начале и конце процесса одинаковы, процесс является круговым или замкнутым.
Эти значения или связь между этими параметрами в начале и конце процесса называется газовым законом. Газовый закон, который отражает взаимосвязь между всеми тремя параметрами газа, называется комбинированным газовым законом.
Следует также отметить, что для газов не существует такого процесса, который изменяет только один параметр газа, так как значения этих параметров взаимосвязаны. Примером может служить закон Шарля, который описывает взаимосвязь между P и T.
Объединенный газовый закон. Приведение объема газа к нормальным условиям
Связь между давлением, объемом и температурой для определенной массы газа определяется соотношением (4.9): n
где n — общее число молекул, v — объем газа. Затем мы получаем.
Так как при постоянной массе газа N остается неизменным,
(Поскольку значения p, v и t в (5.2) относятся к одинаковым газовым условиям, единый газовый закон может быть сформулирован следующим образом Для неподвижных газовых масс величина отношения давления к абсолютной температуре является газом. Газ — это газ. То же самое относится ко всем ситуациям для данной массы газа.
В результате, при символе p1, v1 и t1цена в конце процесса p2, v2 и t2, то.
Типы (5.2) и (5.3) являются математическими выражениями Единого газового закона.
На практике иногда нужно установить, какой объем V 0 Понять массу газа, доступную при нормальных условиях.0= 273 K и p0=1,013 . 10 5 Па. Если значения параметров для этой массы газа в каком-либо произвольном состоянии, отличном от нормального, обозначить через р, V и Т , то на основании (5.3) получаем
Тип (5.4) уменьшает объем определенной массы газа при нормальных условиях.
Плотность газа зависит от объема и температуры сосуда. Для сравнения, предположим, что 1 моль азота, заполненного в контейнер такого объема, создает давление 1 бар, если контейнер помещен в ледоруб при 0 °C.
Количество вещества
Расчеты количества выполняются для того, чтобы реально осуществить определенный процесс или узнать состав и структуру определенного вещества. Эти расчеты не могут быть выполнены для абсолютной массы индивидуума или молекулы. Это объясняется тем, что они очень маленькие. Соответствующие индивидуальные массы также невозможно использовать, поскольку они в большинстве случаев не связаны с общепринятыми измерениями массы или объема вещества. По этой причине было введено понятие количества материи. Это обозначается греческой буквой V (NU) или n. Количество вещества соизмеримо с числом структурных единиц (молекул, отдельных частиц), которые оно содержит.
Молекула — это количество вещества, которое содержит столько структурных единиц, сколько людей в 12 граммах изотопа углерода.
Масса одного человека равна 12 амм, поэтому число людей в 12 г углерода равно.
Естественная величина NA называется константой Авогадро. Молекула любого вещества содержит 6,02*10 в силе 23 частиц.

Рисунок 1.Метод Авогадро.
Молярный объем газа
Молекулярный вес газа — это отношение объема вещества к объему этого вещества. Эта величина рассчитывается путем деления молекулярного веса вещества на его плотность в соответствии со следующими типами
VM, где VM — молекулярная опухоль, M — молекулярный вес и P — плотность вещества.
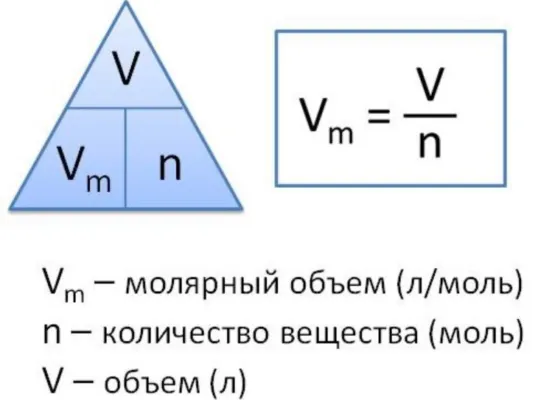
Рисунок 2.Типы молекулярных опухолей.
В Международной системе С молекулярный вес газа измеряется в кубических метрах на молекулу (м 3 /моль).
Молекулярный вес газа отличается от молекулярного веса жидких и твердых веществ тем, что 1 моль газового элемента всегда занимает один и тот же объем (при соблюдении одинаковых параметров).
При расчете объема газа при нормальных условиях, так как объем газа зависит от температуры и давления. Нормальными условиями являются температура 0°C и давление 101 325 кПа. Молекулярный объем одного моля газа при нормальных условиях всегда одинаков и равен 22,41 DM3 /моль. Этот объем называется молекулярным весом идеального газа. Это означает, что для одного моля газа (кислорода, водорода, воздуха) объем составляет 22,41 дм3 /м.

Рисунок 3.Молекулярная масса газов при нормальных условиях.
Таблица «молярный объем газов»
В таблице ниже приведены объемы некоторых газов.
| Газ | Молярный объем, л |
| h2 | 22,432 |
| o2 | 22,391 |
| cl2 | 22,022 |
| co2 | 22,263 |
| NH3 | 22,065 |
| SO.2 | 21,888 |
| Идеальный | 22,41383 |
10. если нет расчетов, определите, какой газ тяжелее воздуха.2, ч4, n2, o2 .
ПОИСК

Одна из распространенных ошибок, допускаемых участниками, заключается в использовании молекулярного веса газа при нормальных условиях (22,4 л/моль) для решения проблемы условий, не сообщающих о том, что газовая опухоль измеряется в н.у.с.
Молекулы газа при определенных условиях занимают одинаковый объем. Этот объем называется молекулярным весом газа. c, которое равно количеству вещества данного вещества в объеме газа.
Количество занимаемой массы определенного газа. Если газ находится при 0°C и нормальном атмосферном давлении, то в качестве основы для расчета можно использовать молекулярный вес газа (22,4 л/моль). Если газ находится при различных давлениях и температурах, объем рассчитывается по уравнению Клапейрона-Менделеева стр.35
Этот объем часто называют молекулярным весом газа. c.132
По мере уменьшения молекулярной массы газа оба предположения, составляющие основу концепции идеального газа, становятся все более справедливыми.
Чтобы описать газы в более широком диапазоне давлений, Ван дер Ваальс предложил уравнения, которые носят его имя.
Сначала уравнение Ван-дер-Ваальса, учитывая, что молекулы газа занимают конечную опухоль, объем без молекул в уравнении (8.1) вместо молекулярной опухоли, стр.123
Случай Авогадро показывает, что если равные объемы газа содержат равное число молекул, то объем, занимаемый одной молекулой газа, должен быть одинаковым для всех газов. Этот объем, называемый молекулярной массой газа, составляет 22 414 дм при CTD, I I I (O°C и 1 ATM) или 24 056 дм при CTD (20°C и p.154).
Например, при нормальных условиях (т.е. 273,15 к (0°C) и давлении /7 = 1,01325 10 Па (1 атм, 760 мм. рт. ст.), каждый газ (подобно идеальному газу), вплоть до 1 моль равного и одинакового объема составляет 22,4 л. Эта физическая константа называется молекулярной массой газа при нормальных условиях. c.13
Молекулярная масса, соответствующая газу Х, связана с молекулярной массой газа Х через соотношение c.11.
Таким образом, при нормальных условиях один моль газа занимает объем 22,4 л. Этот объем называется молекулярной массой газа и обозначается V. c.12.
Таким образом, при нормальных условиях молекула газа занимает объем 22,4 л. Этот объем называется молекулярным весом газа (обозначается VT) — 23.
При нормальных условиях (и. у.), т. е. давлении P = 101 325 Па и температуре 7 = 273,15 К (О. С.), моли различных газов занимают 22,4 л (точнее 22,41383 л). Этот объем называется молекулярным весом газа и измеряется в литрах на молекулу (л/моль).
По аналогии, эквивалентный объем — это объем, занимаемый одним молем эквивалентного газа различных веществ при определенных условиях. Например, эквивалентный объем молекулярного водорода при нормальных условиях составляет 22,4/2 = 11,2 л/моль молекулярного кислорода — 22,4/4 = = 5,6 л/моль.
При таком содержании, в пределах обычно достигаемой точности, кажущийся молекулярный вес газа в воде постоянен и получается как частичная молекулярная опухоль бесконечного разбавления. Очевидно, что это утверждение временное и зависит от точности эксперимента.
В некоторых случаях видимая молекулярная опухоль значительно отличается от частичной молекулярной опухоли конечного разбавления, поскольку опухоль раствора складывается из концентрации растворенного газа.
Моль. Закон Авогадро. Молярный объем газа
Молекула (n) — это количество вещества, содержащее 6,02*, включая множество структурных единиц (молекул, индивидов, ионов и т.д.), в том числе 12 грамм (0,012 кг) индивидов в 1 мс 12с изотопии. 1023 структурных единиц (число Авогадро, NA).
Тип связи между объемом вещества, его массой и молекулярным весом.
Здесь M масса, M молекулярная масса и V линия.
4. метод авогадро. Основан итальянским естествоиспытателем Авогадро в 1811 году. Одно и то же количество газа, собранное при одинаковой температуре и давлении, содержит одинаковое число молекул.
Таким образом, можно сформулировать понятие количества материи: одна молекула содержит число частиц, равное 6,02*1023 (называемое постоянной Авогадро).
Результатом этого закона является то, что при нормальных условиях (P0 = 101,3 кПа и T0 = 298 K) в объеме 22,4 л в минуту находится газ.
5. метод Бойля-Мариотта.
При постоянной температуре объем определенного количества газа обратно пропорционален давлению, при котором он находится.
При постоянном давлении изменение объема газа прямо пропорционально температуре.
7. связь между объемом одного газа, давлением и температурой может быть выражена комбинацией методов Бойля-Мариотта и Гейлосака.
P0, V0, T0 — объемное давление и температура при нормальных условиях: P0 = 760 мм рт. ст. или 101,3 кПа, T0 = 273 K (00C)
8.Независимая оценка молекулярной массы M может быть сделана с помощью так называемого уравнения статута идеального газа или уравнения Клапейрона-Мендели.
pv = (m/m)*rt = vrt. (1.1)
где P — давление газа в замкнутой системе, V — объем системы, T — масса газа, T — конечная температура и R — глобальная газовая постоянная.
Заметим, что значение константы R можно получить, заменив цены, характеризующие молекулы газа, на N.A. Уравнение (1.1).
r = (p v)/(t) = (101,325kpa 22,4l)/(1 моль 273k) = 8.31j/mol.k)
Примеры решений
Пример 1. Реконструкция объема газа при нормальных условиях.
Какой объем газа занимает 0,4 x 10-3 м3 объема (н.у.) при температуре 500°C и давлении 0,954 x 105 Па?
Для нормализации объема газа при нормальных условиях используется общий вид комбинированного закона Бойля-Мариотта и Гей-Люссака.
Объем газа (н.у.) составляет T0 = 273 K-P0 = 1,013 x 105 PA-T = 273 + 50 = 323 K.
(н.у.), газ занимает объем 0,32 x 10-3 м3.
Пример 2. Рассчитайте относительную плотность газа по его молекулярной массе.
Вычислите плотность водорода и этанида C2H6 в воздухе.
Закон Авогадро гласит, что относительная плотность одного газа по отношению к другому равна отношению молекулярных весов (MH) этих газов, т.е. d = m1/m2 Если m1ñ2í6= 30 и m2í2= 2, то относительная плотность этана в водороде равна dh2 = 30/2 = 15, когда средняя молекулярная масса воздуха равна 29.
Относительная плотность этана в воздухе: dvod = 30/29 = 1,03, т.е. этин в 15 раз тяжелее водорода и в 1,03 раза тяжелее воздуха.
Любой газ — о2, n2, ко или ко2В объеме 24,5 ± 0,2 л содержится 6,02-10 mpt (25°C и 1 ATM). Объем 22,4 ± 0,1 л n2, CO или других газов содержит 6,02-10 м молекул при 0°C и 1 АТМ.
Закон Авогадро
Сравнение различных газов с одинаковой температурой и давлением может легко показать, что они имеют одинаковый молекулярный вес.
Это наблюдается не только при 0°C и 1 АТМ, но, что особенно важно, при других температурах и давлениях.
Объем 1 моля газа при температуре 0°С и давлении 1 атм
Пустая бутылка w1, г Вес газа и баллона w2, г 1 литр газа по массе w2, — w1 ,. гМолекулярная масса
MW. g
МВт / (w2 — w2)a
Когда два газа вступают в реакцию, например, аммиак NH3хлорида HCl, то 1 л аммиака реагирует с 1 л хлористого водорода, когда опухоли двух газов измеряются при одинаковой температуре и давлении. 1 АТМ, но что более важно — при других температурах и давлениях.
Используя эти и другие подобные результаты, Авогадро сформулировал свой знаменитый случай. Согласно этому случаю, равные количества газа содержат одинаковое число молекул (одинаковые температура и давление).
Поэтому молекулярный вес газа может быть определен путем сравнения веса известного объема газа с весом и известным молекулярным весом другого газа того же объема. Не имеет значения, каковы значения P и T, поскольку они одинаковы для обоих газов.
Гипотеза Авогадро
Случай Авогадро часто называют законом Авогадро, поскольку он нашел очень широкое применение. Это один из важнейших законов химии.
Он важен не потому, что дает точные результаты, а потому, что его можно применять ко всем газам, независимо от размера молекул. Молекулы различных газов имеют разные размеры, и силы притяжения между ними несколько отличаются.
Поэтому различные газы в данном количестве содержат неодинаковое число молекул. Эти отклонения малы (обычно менее 1%) и не уменьшают значение в случае Авогадро как способа определения молекулярного веса газа.
Интересно отметить, что этот важнейший закон, который сегодня часто называют Законом, не был признан в течение полувека с момента его предложения.
Авогандро предложил свой случай в 1811 году, но только на Международном химическом конгрессе в Карлсруэ (Германия) в 1858 году он получил всеобщее признание.
Сегодня, когда имеется так много количественных данных о весе тела и опухолях, можно привести множество примеров, доказывающих правоту этого случая.
Напротив, в начале 19 века точная индивидуальная нагрузка не была известна и не была окончательной.
Практическое занятие по теме объем газа в молях
Сколько молекул азота содержится в 1 л газа при 0°C и 1 атм?
(a) Рассчитайте объем (в миллилитрах), занимаемый молекулами азота в твердой фазе.
(b) Определите размер куба (в сантиметрах) с объемом, рассчитанным в (a), зная, что 1 мл = 1,00 см3. Используя значительное число, выразите ответ в ангстремах (1 Å = 10 -8 см).
Похожие страницы:
Количественные соотношения в реакциях между газамиПервое количественное исследование реакций между газами было проведено французским ученым Гей Россаком, автором его знаменитого закона.
Расчет молекулярной массы одного газа по молекулярной массе другого газа может быть выполнен и более простым способом. Этот метод основан на выражении
Парциальное давление газа при измерении молекулярного веса газа очень часто требуется для измерения количества газа, собранного на воде.
Уравнение состояния газаСостояние газа в веществе характеризуется относительно большими расстояниями между молекулами, незначительным притяжением и относительно значительными силами.
Статья 1 Содержание Авогадро 1.1 Молекулярные законы грамм газа 1.2 Расчет грамм молекул газа по химическим типам с использованием объема.
Наиболее важный метод определения молекулярного веса газа основан на законе Авогадро. Однако прежде.









