Поэтому молекулярная масса газа прямо пропорциональна произведению его массы и глобальной постоянной газа относительно температуры, и обратно пропорциональна произведению давления и объема.
Количество вещества. Моль. Молярная Масса. Формула
Количество материи используется для измерения макроскопических количеств вещества во многих естественных науках, включая физику, химию, изучение электролиза и термодинамику, которая описывает идеальное состояние газа. Поскольку молекулы взаимодействуют кратно целым числам и независимо от массы, при описании химических реакций удобнее использовать количества вещества, а не массу. Чтобы понять количество вещества в химии, обратите внимание, что количество имеет свою собственную единицу измерения.
Количество одинаковых строительных блоков (атомов, электронов, молекул, ионов и других частиц) в веществе является физической величиной — количеством вещества. В Международной системе единиц (СИ) количества вещества измеряются в молях, кмолях или ммолях или выражаются в виде n(en), когда используются в расчетах.
Применение, значение
В химии при написании уравнений химических реакций количество используемого вещества и его значение становятся более понятными, если вы знакомы с законом постоянства массы веществ. Например, в реакции сжигания водорода соотношение кислорода должно быть 2:1. Зная массу водорода, можно определить количество вещества кислорода, участвующего в реакции горения.
В реальных экспериментах вместо количества вещества используется единица измерения моль. Это уменьшает долю исходного реагента и упрощает расчеты. На практике один моль вещества содержит 6 -1023 моль-1 единиц, что называется числом Авогадро N.A .
 Величина, с которой сравнивают массу атома
Величина, с которой сравнивают массу атома
Первоначально даже Дальтон сравнивал атомную массу с атомной массой водорода, который был самым легким. Позже появилась так называемая кислородная единица, которая соответствует 1/16 части массы атома кислорода. Это было принято потому, что большинство химических атомов образуют соединения с кислородом.
Однако с развитием атомной физики эта установка также стала очень неудобной. Это связано с тем, что кислород встречается в природе в различных изотопах (т.е. три константы, всего 16). Как мы знаем, изотопы имеют разный атомный вес. Из-за большого разнообразия изотопов и их различной стабильности единица кислорода потеряла свое значение.
В настоящее время (с 1961 года) наиболее часто используемой единицей является единица углерода, так называемая единица атомной массы (сокращенно а.м.). Она равна 1/12 части массы атома углерода (изотоп 12C).
Почему именно углерод? Потому что.
-Углерод имеет только два изотопа: 12C и 13C — первый составляет 98,9%, а
-в сотни раз больше органических веществ (известных как углеродная основа), чем неорганических, и
-Уже рассчитанные относительные атомные массы всех элементов остаются практически неизменными при переходе от кислородных единиц к углеродным, что оказалось очень удобным. Поэтому атомная масса химического элемента связана с его массой. Число атомов углерода как относительная атомная масса: зная абсолютную массу атома и значение а.е.м. Ag: Ar считается безразмерной величиной, или величиной а.е.м. Однако «а.е.м.» обычно не пишут, и значение Ar остается без единиц.
Но как найти относительную молекулярную массу?
Здесь все не так просто. Понятие «относительная молекулярная масса» не всегда применяется правильно. Правильнее было бы говорить о «массе прессы».
Верно, что молекулы характерны для веществ с ковалентными связями: вода H2O, серная кислота H2Итак.4глюкоза C6H12O6 и т.д. И термин «относительная молекулярная масса» может быть полностью применен к ним.
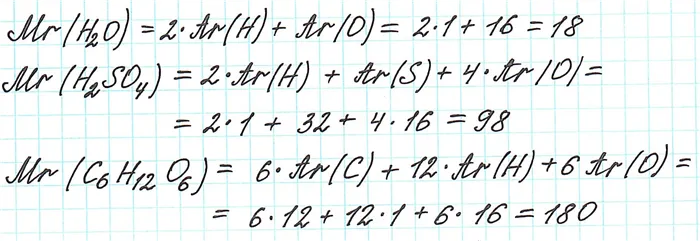
Молекулы состоят из атомов, поэтому относительная молекулярная масса (Mr) равна сумме их относительных атомных масс. Пример: металлы (как простые вещества) и ионные соединения, с другой стороны, не имеют молекул. Их кристаллические решетки состоят из бесконечного числа атомов и ионов. Поэтому молекулярная формула этих соединений отражает количественное соотношение частиц в кристалле.
Например, формула NaCl указывает на наличие в кристалле хлорида натрия ионов Na+ и ионов Cl-. В действительности, хлорид натрия имеет следующий вид: Na∞Cl∞. Обратите внимание, что термины «молекула» и «молекулярная масса» не применимы к ионным соединениям.
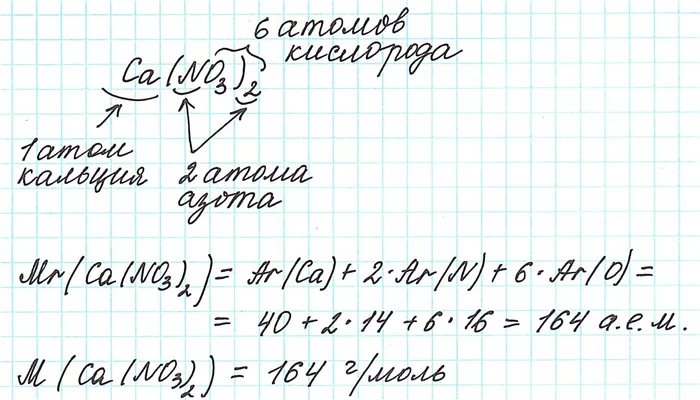
По этой причине рассчитываются стандартные массы этих веществ. Он рассчитывается по тому же принципу, что и молекулярный вес. Его зовут господин. Например, для хлорида натрия:.
Наряду с относительной атомной массой (Ar), относительная молекулярная масса (Mr) сравнивается с 1/12 атома углерода в изотопе 12C.
Далее мы обсудим г-на
Количество вещества и молярная масса
В практических расчетах необходимо вычислять массы, взятые в граммах, килограммах и тоннах (например, в производстве).
Введены новые относительные величины (моль).
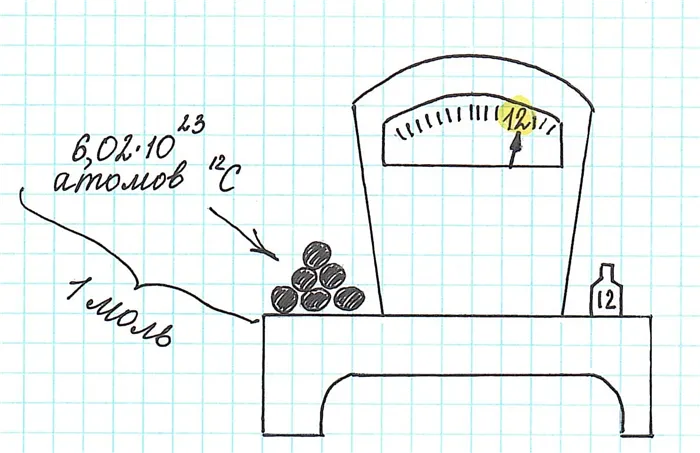
Масса определенного количества атомов изотопа углерода 12 C, т.е. 6,02-10,23, правильно рассчитана и составляет ровно 12 г. Обратите внимание, что относительная молекулярная масса одного и того же изотопа равна 12, но не граммам.
Количество вещества, содержащее такое же количество частиц (атомов, ионов, молекул — в зависимости от его структуры), как 12 граммов изотопа углерода 12 C, называется молекулой.
Молекула вещества (любого!) всегда содержит 6,02-10 23 частиц (постоянная Авогадро).

Атомы элемента имеют разную массу, поэтому моль вещества также имеет разную массу. ! Обратите внимание, что в русском языке слово «крот» — мужского рода! (не как бабочка-мотылек).
Масса молекул вещества называется его молекулярной массой (М) и рассчитывается в г/моль.

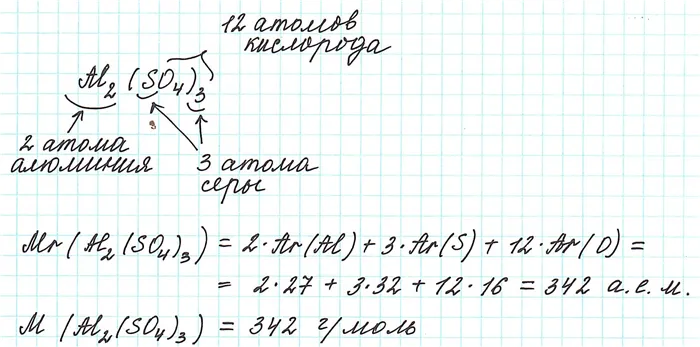
Таким образом, молекулярная масса и количество вещества связаны следующим соотношением
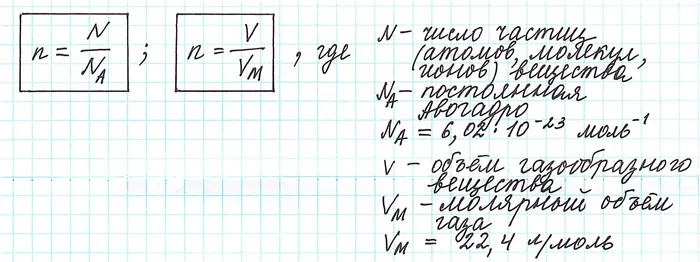
Можно также определить такое соотношение в отношении количества вещества.
Почему же относительная молекулярная и молярная массы равны?
Поэтому относительная молекулярная масса и молекулярный вес — это не одно и то же, как следует из их определений.
Докажем, как обе массы могут быть численно равны.

Не углубляясь в историю, стоит вспомнить, что каждый химический элемент — это определенный тип человека. Было установлено, что атомы химических элементов обладают уникальными свойствами.
Что такое молярная масса
Молекулярная масса — это масса молекул вещества, измеряемая в граммах, деленных на молекулы (г/моль). Это отношение между массой вещества и его количеством, измеряемым в молекулах.
Как обозначается молекулярный вес: m.
где — масса вещества, а — количество вещества.
Единицей измерения молекулярного веса является г/моль.
Хотя 1 моль химического вещества содержит одинаковое количество молекул (и равен числу Авогадро), молекулярные веса различных веществ отличаются. Это происходит потому, что индивидуумы, составляющие эти молекулы, различны. В частности, они различаются по своей относительной атомной массе (Ar) — например, Ar(Mg) = 24, Ar(Hg) = 200. Важность этого факта становится очевидной.
Как определить молярную массу
Этот размер тесно связан с такими понятиями, как относительный персональный вес и молекулярный вес. Это актуально, потому что абсолютная масса молекулы или человека вещества не используется для решения задач в химии — это очень маленькая величина.
Относительная индивидуальная масса вещества (ar) его человек в 1/12 раза больше атома углерода. Это значение для каждого химического элемента можно найти в таблице Менделеева.
Соответствующая молекулярная масса (mr) показатель — это сумма АР индивидов в молекуле вещества с учетом показателя. Он указывает, превышает ли масса молекулы 1/12 атома углерода.
Где находится количество особей?
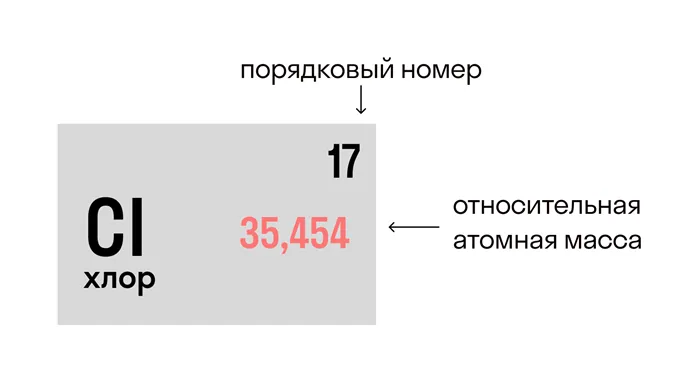
В молекуле хлорида натрия NaCl есть один человек натрия и один человек хлора, иr(Na) = 23, ar (cl) = 35,5.
Нано-молекула.2 Содержит одного человека с натрием, одного человека с азотом и двух людей с кислородом.
Фактически, для расчета молекулярного веса больше ничего не требуется.
Молекулярная масса вещества численно равна его относительной молекулярной массе. Однако не следует путать эти два понятия — у них разные физические концепции. Молекулярный вес описывает одну молекулу, в то время как относительный молекулярный вес описывает одну молекулу.
Количество вещества
Из предыдущих видов видно, что молекулярный вес и количество вещества тесно связаны. Давайте рассмотрим эту связь подробнее. Первоначально количество вещества может быть заявлено с помощью латинских или греческих букв (NU). Не удивляйтесь, если вы встретите международные имена с одной из двух букв этого типа.
В типе нахождения молекулярного веса количество вещества было дано как
Используя его, вы можете найти количество (моль) вещества, если вам известны его абсолютный и молекулярный вес.
Пример 1
Как найти количество вещества, содержащего 350 г сульфата.4;
Помните, что m = mr (значение молекулярной массы равно значению относительной молекулярной массы).
Замените значения молекулярной массы в уравнении.
Если вы знаете число молекул или других структурных единиц, то существует еще один вид количества одного вещества, которое вы можете найти
Здесь — количество структурных единиц — число Авогадро.
Пример 2
Предположим, что объем КАКО3 3.01-10 23 пункта содержит. Как найти количество вещества, соответствующее определенному объему?
Используйте тип молекулы.
Выше мы нашли количество вещества через его молекулярный вес, но для газов это также можно сделать через молекулярные опухоли. Согласно закону Авогадро, если газы рассматриваются при одинаковой температуре и давлении, то объемы газов, равные одному молю, занимают одинаковый объем.
Молярная масса, расчет по формуле вещества
Молекулярный вес вещества — это сумма молекулярных весов отдельных веществ, составляющих его химический тип. Индивидуальные молекулярные массы — это константы, значения которых можно найти в химических справочниках (иногда атомные массы указаны непосредственно в периодической таблице элементов).
Например, молекулярный вес водорода (химический тип молекулы водорода — h2) в два раза больше атомного молекулярного веса элемента водорода (H).
Округленные молекулярные веса используются для упрощения расчетов, особенно в школах. Однако для компьютера не составляет труда рассчитать без округления и найти для вас в таблице соответствующий молекулярный вес.
Калькулятор молярной массы
Все, что вам нужно знать, — это химическое вещество.
Калькулятор распознает химические вещества в формуле и рассчитывает общую массу. Однако, например, тип H2CO3 (карбоновая кислота), написанный без прописной буквы — H2CO3 — будет распознан компьютером как H2CO3, то есть определенный тип гидрида кобальта.
Для того чтобы калькулятор мог распознавать элементы типа, ему необходимо учитывать группы меньшинств. Однако в мобильных телефонах неудобно постоянно менять корпус ввода. В этом случае химические вещества разделяются вакуумом. Когда программа смотрит на пробелы, она видит, что это отдельные пункты.
Примеры типов, которые может понимать калькулятор:.
C8H10N4O2 (кофеин), (NH4)2SO4 (сульфат аммония), 4Na2CO3 * 1,5 H2O2 (перкарбонат натрия), h2 s o 4 (серная кислота)
| # | Элемент | Масса, г/моль | N | Σ, г/моль |
|---|---|---|---|---|
| K | Калий | 39.0983 | 2 | 78.1966 |
| Hg | Ртуть | 200.59 | 1 | 200.59 |
| I | Йод | 126.9045 | 4 | 507.618 |
This entry was posted on 21 Dec 2016, 5:52 pm and is filed under Главная страница. Перейдите в нижнюю часть страницы, чтобы оставить комментарий.
Мало букафф? Читайте есчо !
Генератор словесного поноса
Иногда речи политиков могут превращаться, намеренно или ненамеренно, в неинформативные вводные фразы, общие фразы и лексическую путаницу. Очевидно, что такая речь помогает им избежать неловких пауз, что дает им время на обдумывание своих ответов.
Игра жизнь online (js)
Культовая игра «Жизнь», теперь js. Давным-давно я создал приложение для игры в Delphi (в 1999 году?).. Старое приложение продолжает работать, но запускается.
Для решения задачи вам может понадобиться знание того, как найти молекулярный вес газа. Об этом сообщает только плотность воздуха или другого газа. Это возможно, если известен тип относительной плотности, обозначаемый буквой D.
п.5. Задачи
Вопрос 1.Масса кристалла серы равна 16 г. Сколько молекул серы ⌘ (⌘ mathrm \) содержится в этом кристалле? (Округлите свой ответ до двух значащих цифр).
Относительная молекулярная масса на молекулу $M_r = 8 \ cdot A_r = 8 \ cdot 32 =256$ Молекулярная масса $\mu = 256 \ cdot 10 ^ \ frac >> $Масса в кристалле серы: $ \ nu = \ frac = \ frac<\mu>Число молекул в кристалле серы: $ $ N = \ frac<\mu>N_A $ $ $ N = \ frac<1,6\cdot 10^><256\cdot 10^>\ cdot 6,022 \ cdot 10^\\\ примерно 3,8 \ cdot 10 ^ $ $ Ответ: $\ (3,8 \ cdot 10 ^ \)
Вопрос 2*. Генераторы кислорода на космическом корабле произвели 1,6 кг кислорода \(⌘ mathrm \). Космонавтам обычно требуется 600 литров кислорода в день. Предполагая, что газовые условия приблизительно нормальные, определите количество часов кислорода, необходимого астронавту.
Относительная молекулярная масса молекул кислорода$M_r= 2 \ cdot A_r =32$Молекулярная масса кислорода$\mu = 32 \ cdot 10 ^ \ frac>$Масса произведенного кислорода$








