Правильно, метиловый спирт и метанол — это одно и то же. Химическая формула метанола – CH3OH — простейший спирт, состоящий из одного атома. Но это все равно правильное название. метанол.
Строение метанола
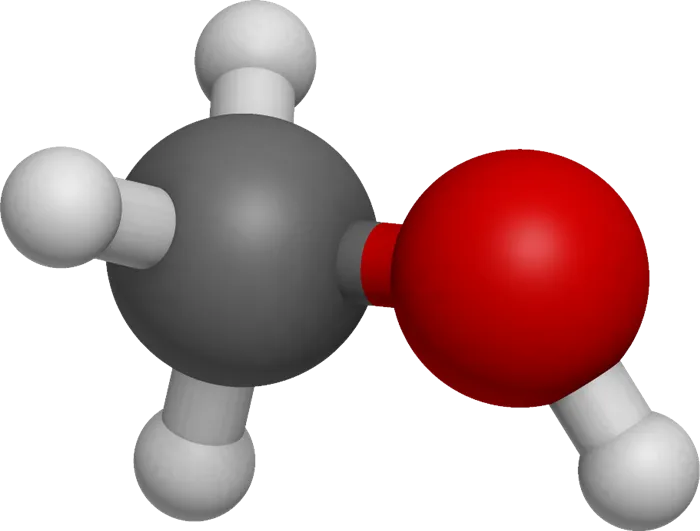
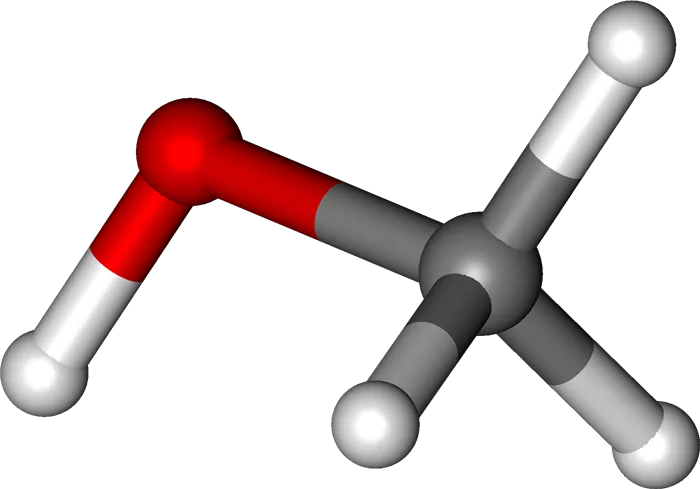
Помимо связей С-С и С-Н, в молекулах спиртов существуют ковалентные полярные связи. химические связи О–Н и С–О.
| Электроотрицательность кислорода (OR = 3,5) больше, чем у водорода (OR = 2,1) и углерода (OR = 2,4). |
Электронная плотность обеих связей смещена в сторону более электроотрицательного атома кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических Атомы C и H имеют две гибридные орбитали 2sp 3, участвующие в связи атомов C и H, а две другие гибридные орбитали 2sp 3 заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C-O-H почти тетраэдрический и составляет почти 108o .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи заставляют молекулы спирта притягиваться и объединяться:
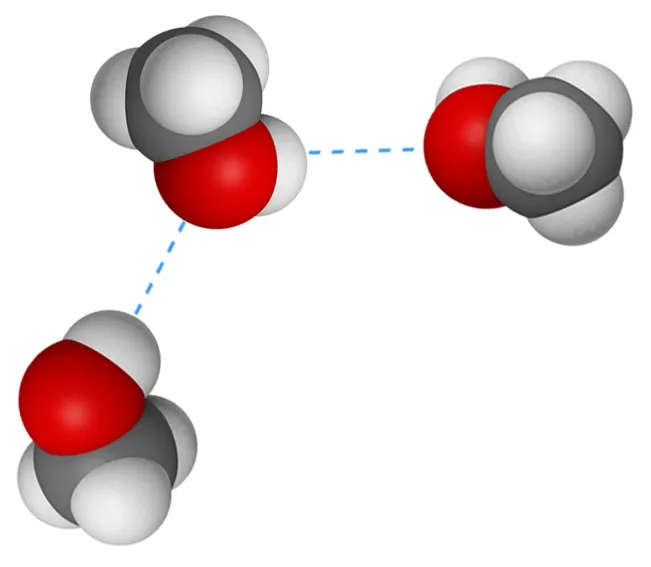
Поэтому метанол — Жидкость с относительно высокой температурой кипения (температура кипения. метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами. метанола и воды. Поэтому метанол Они хорошо растворимы в воде. Молекулы соединяются только между молекулами одной и той же молекулы. метанола гидратируются в воде:
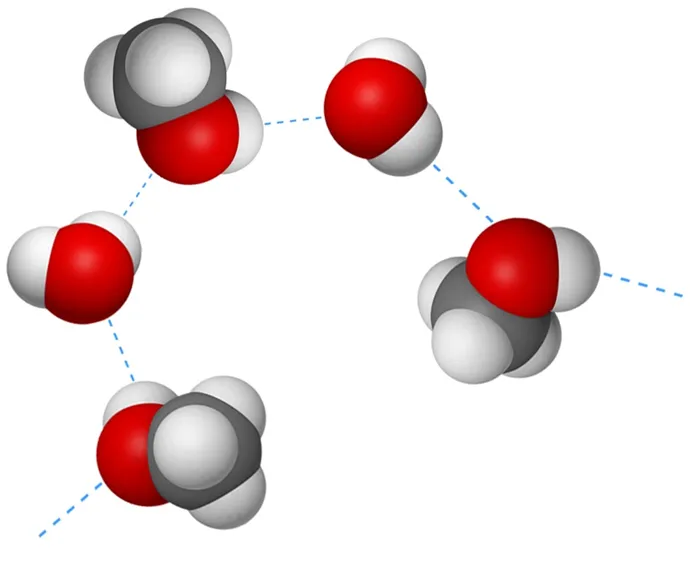
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше групп OH содержит спирт, тем более он растворим в воде. |
Метанол смешивается с водой в любом соотношении.
Изомерия метанола
Для метанола Не существует характерных структурных изомеров — ни изомеров по углеродному скелету, ни изомеров по положению гидроксильной группы, ни изомеров между классами.
Метанол — это органическое вещество, молекула которого содержит группу OH в дополнение к углеводородной цепи.
1. Кислотные свойства метанола
| Метанол является неэлектролитом; в водном растворе он не разлагается на ионы. свойства В растворе он слабее, чем в воде. |
1.1. Взаимодействие с раствором щелочей
Метанол практически не реагирует с растворами щелочей, поскольку образующиеся спирты почти полностью гидролизуются водой.
В этой реакции равновесие настолько сильно смещено влево, что прямой реакции не происходит. Это причина метанол они не реагируют с щелочными растворами.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол реагирует с активными металлами (щелочными и щелочноземельными) с образованием спиртов. При взаимодействии с металлами спирты ведут себя как кислоты.
| Например, метанол Калий и водород реагируют с калием с образованием метилата калия и водорода. |
Метиловые соли полностью гидролизуются под воздействием воды с образованием спирта и гидроксида металла.
| Метилат калия, например, разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогенированными углеводородами, группа OH замещается галогеном, и образуется галогенированный алкан.
| Например, метанол реагирует с бромистым водородом. |
2.2. Взаимодействие с аммиаком
Гидроксильная группа спиртов может быть заменена на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, реакция метанола с аммиаком дает метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол реагирует с карбоновыми кислотами с образованием сложных эфиров.

| Например, метанол Он реагирует с уксусной кислотой, образуя метилацетат (метиловый эфир уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты также реагируют с неорганическими кислотами, такими как азотная или серная кислота.
| Например, метанол Он реагирует с азотной кислотой: |
Независимо от этого, стоит отметить увеличение показательного КПД классического двигателя внутреннего сгорания на метаноле по сравнению с работой на бензине. Это увеличение происходит за счет снижения тепловых потерь и может достигать одного процента.
Содержание
До 1960-х годов метанол был синтезирован только на цинк-хромовом катализаторе при температуре 300-400 °C и давлении 25-40 МПа (= 250-400 бар = 254,9-407,9 кгс/см²). Позже синтез медьсодержащих катализаторов получил широкое распространение. метанола с медьсодержащими катализаторами (медь-медь-хром, медь-цинк-алюминий и др.) при 200-300 °C и давлении 4-15 МПа (= 40-150 бар = 40,79-153 кгс/см²).
Современный промышленный метод получения — каталитический синтез из оксида углерода(II) (CO) и водорода (2H2) при следующих условиях:
- температура — 250 °C,
- давление — 7МПа (= 70 атм = 70 Бар = 71,38 кгс/см²), — смесь ZnO (оксид цинка) и CuO (оксид меди(II)):
До промышленного освоения каталитического процесса получения метанол его получали путем сухой перегонки древесины (отсюда название «древесный спирт»). Сегодня этот метод имеет второстепенное значение.
Известны также системы, в которых для этой цели используются отходы нефтепереработки и угольный гранулят.
Эмпирическая формула: CH4O или CH3-OH, и структурно: В настоящее время метиловый спирт получают синтетически из окиси углерода и водорода при температуре 300-400 °C и давлении 300-500 атм в присутствии катализатора — смеси оксидов цинка, хрома и др. — производится. Сырье для синтеза метанола это синтез-газ, обогащенный водородом (CO + H2): :CO + 2 H2 → CH3OH 2
_2\mathrm \ \rightleftharpoons \ \mathrm + 3 \; \mathrm_2 ; \ \Delta H (300 \; \mathrm) = 206 \; \mathrm/\mathrm, » width=»» height=»» /> _2\mathrm \ \rightleftharpoons \ \mathrm_2 + \mathrm_2 ; \ \Delta H (300 \; \mathrm) = -412 \; \mathrm/\mathrm. » width=»» height=»» />
Производство метанола (в тыс. тон):
| Год | США | Германия | Мир | Цена реализации ($/т) |
|---|---|---|---|---|
| 1928 | 24 | 18 | 140 | 84,7 |
| 1936 | 97 | 93 | 305 | 88,9 |
| 1950 | 360 | 120 | 349 | 83,1 |
| 1960 | 892 | 297 | 3930 | 99,7 |
| 1970 | 2238 | данные отсутствуют | 5000 | 89,7 |
| 1980 | 3176 | 870 | 15000 | 236,1 |
| 2004 | 3700 | 2000 | 32000 | 270 |
Крупнейшим производителем в России является ОАО «Метафракс» в Губахе. метанола в России — ОАО «Метафракс» в Губахе.
При применении метанола В качестве топлива следует отметить, что объемное и массовое содержание энергии (теплотворная способность) составляют метанола (удельная теплота сгорания = 22,7 МДж/кг) на 40-50% ниже, чем у бензина, но тепловыделение топливно-воздушно-спирто-воздушной и топливно-воздушно-бензиново-воздушной смесей при их сгорании в двигателе существенно не отличается, так как высокое значение теплоты отработавших газов метанола улучшает наполнение цилиндров двигателя и снижает тепловую нагрузку на двигатель, что приводит к более полному сгоранию спирто-воздушной смеси. Это приводит к повышению эффективности двигателя на 10-15%. Двигатели гоночных автомобилей работают на метаноле октана, чем бензин, имеют степень сжатия более 15:1, тогда как степень сжатия неэтилированного бензина в обычном двигателе внутреннего сгорания с искровым зажиганием обычно не превышает 11,5:1. Метанол может использоваться как в обычных двигателях внутреннего сгорания, так и в специальных топливных элементах. для получения электричества.
- Метанол травиталюминий. Проблемным является использование алюминиевых карбюраторов и инжекторных систем подачи топлива в ДВС. Это относится в основном к метанолу-сырой, со значительным количеством примесей муравьиной кислоты и формальдегида. Технически чистый метанол, содержащей воду, которая реагирует с алюминием при температуре выше 50 °C, но совсем не реагирует с обычной углеродистой сталью. Метанол притягивает воду, что приводит к разделению бензиново-топливных смесей.метанол.
- Метанол, как и этанол, повышает пропускную способность пластмассовых испарений для некоторых пластмасс (например, плотного полиэтилена). Эта особенность метанола повышает риск увеличения эмиссии летучих органических веществ, что может привести к уменьшению концентрации озона и усилению солнечной радиации.
- Уменьшенная летучесть при холодной погоде: моторы, работающие на чистом метаноле, может иметь проблемы с запуском при температуре ниже +10 °C и повышенный расход топлива до достижения рабочей температуры. Однако эта проблема может быть легко решена путем добавления в метанол 10—25 % бензина.
небольшое количество примесей метанола можно добавлять в топливо существующих автомобилей, используя подходящие ингибиторы коррозии. Так называемая Европейская директива о качестве топлива позволяет использовать до 3 % метанола такое же количество присадок в бензине, продаваемом в Европе. В настоящее время в Китае используется более 1 000 миллионов галлонов метанола в год в качестве транспортного топлива в низких смесях, используемых в существующих транспортных средствах, и в высоких смесях в транспортных средствах, предназначенных для использования в дорожном движении метанола в качестве топлива.
Помимо применения метанола в качестве альтернативы бензину, существует технология, которая может метанола для производства угольной суспензии, которая коммерчески доступна в США под названием «Methacoal» (Methacoal 7 ) и предлагается в качестве альтернативы печному топливу, которое широко используется для отопления зданий (мазут). В отличие от водоугольного топлива, оно не требует специальных котлов и является более энергоэффективным. С экологической точки зрения, он имеет меньший углеродный след8, чем обычное синтетическое топливо, производимое из угля, часть которого сжигается при производстве жидкого топлива.
Свойства метанола и его реакции
В статье использованы материалы из Энциклопедического словаря Брокгауза и Ефрона (1890-1907).
Метанол представляет собой бесцветную жидкость с похожим, но более слабым запахом, чем у этилового спирта. Пахнет вином. Температура кипения составляет 64,7°.
Удельный вес при 0°/0° = 0,8142 (Kopp); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Schiff); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a² = 5,107 (Шифф), критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота сгорания составляет 170,6, теплота образования 61,4 (Stohmann, Kleber и Langbein).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешивании с водой он сжимается и нагревается. Горит голубоватым пламенем. Как и этиловый спирт, он является сильным растворителем и может заменить этиловый спирт во многих случаях. Безводный метанол, При растворении небольшого количества сульфата меди медь становится сине-зеленой, поэтому безводный сульфат меди не следует использовать для обнаружения следов воды. в метанолено не растворяет CuSO4.7H2O (Klepl).
Метанол (в отличие от этанола) не образует азеотропную смесь с водой, поэтому вода-метанол смеси могут быть разделены дистилляцией. Температура кипения водных растворов метанола:
| Метанол Моль % Моль | T_ температура кипения, 760 мм рт. ст. °C |
|---|---|
| 0 | 100 |
| 5 | 92.8 |
| 10 | 88.3 |
| 15 | 84.8 |
| 20 | 82 |
| 25 | 80.1 |
| 30 | 78.2 |
| 35 | 76.8 |
| 40 | 75.6 |
| 45 | 74.5 |
| 50 | 73.5 |
| 55 | 72.4 |
| 60 | 71.6 |
| 65 | 70.7 |
| 70 | 69.8 |
| 75 | 68.9 |
| 80 | 68 |
| 85 | 67.1 |
| 90 | 66.3 |
| 95 | 65.4 |
| 100 | 64.6 |
Метанол дает соединения типа кристаллических гидридов (растворимых) со многими солями, например: CuSO4 ∙ 2CH3OH; LiCl ∙ 3CH3OH- MgCl2 ∙ 6CH3OH- CaCl2 ∙ 4CH3OH представляют собой гексагональные листы, которые разлагаются водой, но не разрушаются при нагревании до 100° (Кейн). BaO ∙ 2CH3OH ∙ 2H2O получается в виде блестящей призмы, когда BaO растворяют в водном метаноле и выпаривают. полученной Жидкость при комнатной температуре (Forcrand).
С едкими щелочами метанол образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Gettig). Под действием калия и натрия он легко образует алкильные соли, которые прилипают к кристаллизации. метанол и иногда воду.
Когда пар метанола через раскаленную трубу, он производит C2H2 и другие продукты (Бертло). Когда пары проходят через метанола над раскаленным цинком, получают окись углерода, водород и небольшое количество болотного газа (Jahn). Медленное окисление паров метанола раскаленной платиной или медной проволокой — лучший способ получить для получения большое количество формальдегида: 2CH3OH+O2=2CH NO+2H2О. Под действием хлорида цинка и высокой температуры метанол дает воду и алканы, а также небольшое количество гексаметилбензола (Swan и Green). Метанол, нагретый с аммиаком в запаянной трубке при 300°, дает моно-, ди- и триметиламины (Bertleau).
Метанол это химическое Вещество под названием ксилол или метиловый спирт. Его получение не является сложным, поскольку относится к продукции человека. Его использование в алкогольных напитках может привести к пищевому отравлению. Он также может образовывать взрывоопасные смеси при температуре 8 градусов Цельсия.
Если есть этиловый спирт, зачем нужен метиловый?
Без метанола Современная промышленность не смогла бы этого сделать. Краски, лаки, фанера, ДСП, пластмассы, полистирол, дорожные реагенты, сухое горючее, антисептики и автомобильные шины. Это простой список. Потому что ниже вы найдете более длинный список отраслей, в которых они задействованы. И это относится практически к каждой отрасли. Производство этилового спирта намного дороже, чем производство технического спирта. Вот почему это необходимо. метанол.
Новая технология MtO (метанол в олефины), при которой олефины (в основном этилен и пропилен) производятся напрямую из метанола. Согласно исследованию «Исследование рынка: текущая ситуация и перспективы на ближайшие годы», метанол метанолаТекущая ситуация и перспективы», опубликованном исследовательским центром E&Y в октябре 2020 года, пластик MtO является самым быстрорастущим видом потребления. метанола в мире (увеличение доли рынка на 45% к 2025 году), вторым по темпам роста является использование для метанола в топливе (увеличение доли рынка на 20% к 2025 году) — второе по темпам роста применение.
Производство топлива, соответствующего евростандартам — часто с добавлением слова «эко» — возможно только благодаря метанолу. Почему «эко»? — метанол более чистое сгорание, полная растворимость в воде и повышение эффективности двигателей внутреннего сгорания. Его называют альтернативой нефти.
Как отмечает Валерий Петухов, доктор технических наук, профессор, заведующий кафедрой физико-технических систем и безопасности техносферы ДВФУ, «Когда мы говорим. о метаноле, Важно помнить, что это чистая энергия, производство которой экономически оправдано. Это новый вид энергии, сочетающий в себе две важные характеристики: относительно недорогое производство и экологическую устойчивость. Уже есть корабли, которые только на метаноле. Кстати, крупнейший в мире производитель метанола — канадская корпорация «Метанекс» — поставляет клиентам метанол через 29 морских танкеров, почти половина из которых использует метанол в качестве топлива.
И все же, стоит ли производить метанол в России?
Если мы не хотим остаться позади в жизни, то во что бы то ни стало. Согласно отчету о состоянии рынка метанолаТекущая ситуация и перспективы», опубликованном исследовательским центром E&Y в октябре 2020 года, мировой рынок метанола составляет около 84 млн. тонн в год. Рынок растет и, как ожидается, к 2025 году достигнет 110-120 миллионов тонн продукции.
На долю России в 2019 году пришлось 5,4% рынка производства. метанола. По прогнозам E&Y, эта доля увеличится до 8,6% к 2025 году. Это благоприятное развитие событий, потому что метанол, который является продуктом переработки природного газа, экономически более ценен, чем природный газ. Российские производители имеют очень выгодную стартовую позицию, поскольку стоимость сырья для производства метанола Наш единственный конкурент — Саудовская Аравия. Это позволяет формулировать и реализовывать эффективные и экономически привлекательные инвестиционные проекты, размещая их в местах, отвечающих лишь нескольким критериям: Во-первых, должен быть доступен природный газ, а во-вторых, должна существовать логистическая инфраструктура для транспортировки конечной продукции (в идеале — морской транспорт).
Кто сегодня производит в России? метанол? Первые пять — это «Метафракс» (производство в Пермском крае), «Томет» (Самарская область), «Щекино Азот» (Тульская область), «Сибметахим» (Томская область) и НАК «Азот» (Тульская область). Существующие заводы в России имеют совокупную производственную мощность чуть более 5 млн тонн (на 2020 год), а на 2018-2020 годы объявлены планы по реализации новых проектов — более 20 проектов общей мощностью свыше 30 млн тонн. Территориально это Приморский край, Амурская область, Ленинградская область, Республика Татарстан, Ненецкий автономный округ, Краснодарский край и другие регионы.
Развитые страны стараются избавляться от грязных производств. Где в мире производят метанол? Наверное, в списке будут только африканские страны.
Производство метанола Она не является «грязной». В этой технологии для производства используются два натуральных компонента: Природный газ и вода. Нет химических Углекислый газ — продукты сгорания выбрасываются в атмосферу так же, как и на обычной электростанции. Количество CO2 эквивалентные выбросы самолета, дважды совершающего полет между Москвой и Владивостоком 1 .
Страной, которая производит и потребляет больше всех в мире, является метанола — Китай, на долю которого в 2017 году пришлось более половины (41 млн тонн) мирового потребления и который активно наращивает собственные производственные мощности (+26 млн тонн) 2. Methanex Corporation, канадская компания и крупнейший в мире производитель, имеет метанола — 11 заводов в 6 странах: Канада, Чили, Египет, Новая Зеландия, США и Тринидад и Тобаго. Основные производственные мощности метанола расположены в Саудовской Аравии, Брунее и Малайзии. 2,8% метанола производится в Европе, 5,4% — в России.
Тяжелые отравления проявляются быстрым развитием клинических симптомов. Они сопровождаются судорожным синдромом, нарушениями сознания и дыхания, сердечной дисфункцией и развитием множественной органной недостаточности. Побочные реакции могут привести к летальному исходу в течение первых 24 часов.
Свойства метанола и его реакции
Метанол представляет собой бесцветную жидкость со спиртовым запахом (запах этилового спирта). Температура кипения составляет +64,7 °C.
Удельный вес при 0°/0° = 0,8142 (Kopp); при 15°/15° = 0,79726; при 25°/25° = 0,78941 (Perkin); при 64,8°/4° = 0,7476 (Schiff); при 0°/4° = 0,81015; при 15,56°/4° = 0,79589 (Dittmar и Fawsitt). Капиллярная постоянная при температуре кипения a² = 5,107 (Шифф), критическая температура 241,9° (Шмидт). Упругость пара при 15° = 72,4 мм; при 29,3° = 153,4 мм; при 43° = 292,4 мм; при 53° = 470,3 мм; при 65,4° = 756,6 мм (Д. Коновалов). Теплота сгорания составляет 170,6, теплота образования 61,4 (Stohmann, Kleber и Langbein).
Метанол смешивается во всех отношениях с водой, этиловым спиртом и эфиром; при смешивании с водой он сжимается и нагревается. Горит голубоватым пламенем. Как и этиловый спирт, он является сильным растворителем и может заменить этиловый спирт во многих случаях. Безводный метанол, При растворении небольшого количества сульфата меди медь становится сине-зеленой, поэтому безводный сульфат меди не следует использовать для обнаружения следов воды. в метанолено не растворяет CuSO4∙7H2O (Klepl).
Метанол (в отличие от этанола) не образует азеотропную смесь с водой, поэтому вода-метанол смеси могут быть разделены дистилляцией. Температура кипения водных растворов метанола:
| Молярная доля метанола % | T Температура кипения °C, 760 мм рт. ст. |
|---|---|
| 0 | 100 |
| 5 | 92,8 |
| 10 | 88,3 |
| 15 | 84,8 |
| 20 | 82 |
| 25 | 80,1 |
| 30 | 78,2 |
| 35 | 76,8 |
| 40 | 75,6 |
| 45 | 74,5 |
| 50 | 73,5 |
| 55 | 72,4 |
| 60 | 71,6 |
| 65 | 70,7 |
| 70 | 69,8 |
| 75 | 68,9 |
| 80 | 68 |
| 85 | 67,1 |
| 90 | 66,3 |
| 95 | 65,4 |
| 100 | 64,6 |
Метанол дает соединения типа кристаллических гидридов (растворимых) со многими солями, например: CuSO4 ∙ 2CH3OH; LiCl ∙ 3CH3OH — MgCl2 ∙ 6CH3OH- CaCl2 ∙ 4CH3OH представляют собой гексагональные кристаллы, которые разлагаются водой, но не разлагаются при нагревании до 100° (Канэ). Соединение BaO ∙ 2CH3OH ∙ 2H2O образует яркие призмы при растворении BaO в водном растворе метаноле и испаряется на холоде полученной Жидкость при комнатной температуре (Forcrand).
С едкими щелочами метанол Образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Gettig). Под действием калия и натрия он легко образует алкильные соли, которые прилипают к кристаллизации. метанол и иногда воду.
Когда пар метанола через раскаленную трубу, он производит C2H2 и другие продукты (Бертло). Когда пары проходят через метанола над раскаленным цинком, получают угарный газ, водород и небольшое количество болотного газа (Jahn). Медленное окисление паров метанола раскаленной платиной или медной проволокой — лучший способ получить для получения большое количество формальдегида: 2CH3OH+O2=2HCHO+2H2O. Под действием хлорида цинка и высокой температуры метанол дает воду и алканы, а также небольшое количество гексаметилбензола (Swan и Green). Метанол, нагретый с аммиаком в запаянной трубке при 300°, дает моно-, ди- и триметиламины (Bertleau).
Нахождение в природе
Свободный метиловый спирт встречается в природе лишь изредка и в очень малых количествах (например, в эфирных маслах), но его производные довольно широко распространены. Например, многие растительные масла содержат спиртовые метиловые эфиры: масло лука-шалота содержит метиловый эфир салициловой кислоты C6H4(OH)COOCH3Жасминовое масло содержит метиловый эфир антраниловой кислоты C6H4(NH2)COOCH3. Эстеры метилового спирта очень распространены среди натуральных продуктов, например, природных красителей, алкалоидов и т.д.
В промышленности метиловый спирт производился исключительно путем сухой перегонки древесины. Так называемый «древесный уксус» содержит уксусную кислоту (10 %), ацетон (до 0,5 %), ацетальдегид, аллиловый спирт, метилацетат, аммиак и амины, а также от 1,5 до 3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор лактата кальция, который удерживает уксусную кислоту в виде ацетата кальция. Разделение метилового спирта и ацетона намного сложнее, поскольку их точки кипения очень близки друг к другу (ацетон, BS 56,5°; метиловый спирт, BS 64,7°). Однако путем тщательной перегонки в подходящих по технологии колоннах можно почти полностью отделить метиловый спирт от сопутствующего ацетона. Неочищенный метиловый спирт также называют «древесным спиртом».
Токсичность

Метанол является очень опасным ядом и потребляется в количестве 10 мл метанола Метанол может вызвать тяжелое отравление (одним из последствий является слепота) при попадании в организм в количестве более 80-150 миллилитров. метанола (1-2 миллилитра чистого метанола на килограмм веса тела) обычно приводит к летальному исходу. ЛД50 для животных составляет от нескольких до десятков г/кг. Токсические эффекты метанола развиваются в течение нескольких часов, и эффективные антидоты могут уменьшить ущерб. Чистое вещество опасно не только для жизни. метанол, но и жидкости, содержащие этот токсин, даже в относительно небольших количествах.
В Соединенных Штатах максимально допустимая суточная доза составляет метанола (контрольная доза), при которой предполагается отсутствие последствий для здоровья, установлена (с 1988 года) на уровне 2 мг на кг веса тела.
Предельно допустимая концентрация метанола в воздухе на рабочем месте составляет 5 мг/м³ (с изопропиловым спиртом 10 мг/м³, с этанолом 1000 мг/м³), значение МАК в воздухе помещения составляет 1,0 мг/м³ (с изопропиловым спиртом 0,6 мг/м³, с этанолом 5 мг/м³).
Самая легкая форма отравления характеризуется головной болью, общей слабостью, недомоганием, ознобом, тошнотой и рвотой.
Токсичность метанола Основная причина этого заключается в том, что, попадая в организм, он со временем окисляется до токсичного формальдегида, который приводит к слепоте, поражает нервную систему и вступает в реакцию с белками. Происходит так называемый летальный синтез.
Особая опасность метанола Это связано с тем, что его нельзя отличить от этилового спирта по запаху и вкусу, поэтому его принимают внутрь. Йодоформная реакция: с этиловым спиртом выпадает желтый йодоформ, а с этиловым спиртом выпадает желтый йодоформ. с метанолоНичего не выпадает в осадок (реакция не подходит для определения). метанола в растворе этанола).
Как описано в Руководстве для врачей скорой помощи, антидотом в случае отравления является этанол. метанолоантидотом является этанол, вводимый внутривенно в виде 10% раствора путем инфузии или 30-40% раствора через рот в количестве 1-2 г раствора на 1 кг массы тела в сутки. Полезным эффектом в этом случае является переключение фермента ADH I на окисление экзогенного этанола.
Следует помнить, что при недостаточно точной диагностике алкогольную интоксикацию можно спутать с отравлением. метанолоотравление м, отравление 1,2-дихлорэтаном или четыреххлористым углеродом — в этом случае опасно добавление этанола.
Отравления метанолом — довольно распространенное явление. В США, например, в 2013 году было зарегистрировано 1 747 случаев.
Массовые отравления метанолом
Известно множество случаев массового отравления метанолом. Источником метанола может быть фальсифицированная автомобильная жидкость, не замороженная, фальсифицированный алкоголь, метанол, выдаваемое за этиловый спирт.
- Массовое отравление метанолом в Испании в начале 1963 года; официальное число погибших 51 человек, однако существуют оценки в диапазоне от 1000 до 5000 человек.
- Массовое отравление метанолом в Бангалоре (Индия) в июле 1981 года. Число погибших — 308 человек.
- Массовое отравление вином с добавкой метанола в Италии весной 1986 года; погибли 23 человека.
- Массовое отравление метанолооктября 2000 года в Сальвадоре, в результате которого погибли 122 человека. Власти заподозрили теракт, потому что заводы по производству спиртных напитков были метанол при расследовании инцидента не был выявлен.
- Массовое отравление метанолом 9—10 сентября 2001 года в городе Пярну (Эстония); 68 человек погибли.
- Массовое отравление метанолом в Чехии, Польше и Словакии в сентябре 2012 года; 51 человек погиб.
- Массовое отравление метанолом 17-20 декабря 2016 года в Иркутске (Россия). Число погибших — 78 человек.
Промышленность производит его в больших масштабах. И есть несколько способов сделать это. Одним из самых востребованных является синтез метана.
Хроническое отравление метанолом
Профессиональное заболевание, вызванное постоянным контактом с метиловым спиртом, встречается у работников нефтяной, газовой и нефтехимической перерабатывающей промышленности. и химической промышленности.
Отравление в основном характеризуется симптомами поражения нервной системы. Наблюдается общая слабость, головная боль, дрожание пальцев, век и языка, потливость и нарушения сна. Нарушения зрения проявляются в потере зрения. Усиление симптомов при продолжении трудовой деятельности указывает на хроническое отравление метиловым спиртом.

Профессиональная медицина не делает различий между метанол и его производные как отдельная группа вредных веществ химической Природа. Рабочие нефте- и газоперерабатывающих заводов и химической Работники нефте- и газоперерабатывающих заводов подвергаются воздействию различных факторов, в том числе токсичных веществ. Поэтому терапевтические меры направлены на неспецифическую детоксикацию организма, которая включает в себя следующее:
- проведение внутривенных инфузий;
- назначение гепатопротекторов, антианемических средств;
- применение препаратов, уменьшающих внутричерепное давление и улучшающих микроциркуляцию крови;
- физиотерапевтическое лечение.
Консультации офтальмолога и невропатолога обязательны. Рекомендуется проводить профилактику рецидивов дважды в год. Показателем эффективности лечения является уменьшение симптомов. Затем, для людей с хронической интоксикацией. метанола рекомендуется:
- смена рода деятельности;
- умеренные физические нагрузки;
- диспансерное наблюдение терапевта, невролога и окулиста;
- регулярные реабилитационные мероприятия — лечебная физкультура, санаторно-курортное лечение, физиотерапевтические процедуры.
Правильный профессиональный отбор и регулярные медицинские осмотры являются эффективными мерами по снижению заболеваемости хронической интоксикацией метиловым спиртом.
Промышленность производит его в больших масштабах. И есть несколько способов сделать это. Одним из самых востребованных является синтез метана.
Применение метилового спирта
Метиловый спирт используется в качестве ингибитора образования гидратов в трубопроводах природного газа и является важным свойства метанола — это хорошая растворимость в воде и низкая температура замерзания. Большая часть метилового спирта используется для производства фенолформальдегидных смол. Высокое октановое число, которым характеризуется карбинол, делает его экологически чистым топливом для автомобилей. В лакокрасочной промышленности карбинол используется в качестве растворителя.
Древесный спирт совершенно не подходит для использования в качестве алкогольного напитка, так как является чрезвычайно токсичным веществом. Как только он попадает в желудочно-кишечный тракт, он начинает окисляться до муравьиной кислоты и муравьиного альдегида. Продукты окисления поражают зрительные нервы и сетчатку глаза, где расположены рецепторы. Результаты слепоты. Муравьиная кислота, которая сильно накапливается, транспортируется через кровь в печень и почки и разрушает эти жизненно важные органы. Отравление муравьиной кислотой смертельно. метанолоМ-интоксикация смертельна, поскольку методы удаления метаболитов из крови неэффективны.
В нашей статье мы рассмотрели со свойствама также приложения и методы получения метанола.
С едкими щелочами метанол образует соединения 5NaOH ∙ 6CH3OH; 3KOH ∙ 5CH3OH (Gettig). Под действием калия и натрия он легко образует алкильные соли, которые прилипают к кристаллизации. метанол и иногда воду.
Нахождение в природе
Очень редко такое вещество встречается в свободном состоянии. Даже если он случайно упадет на него, его количество будет крайне незначительным. С другой стороны, ингредиенты для его производства можно найти практически везде. К ним относятся растительные масла, различные виды деревьев, земли и даже металлы.
Для человека даже 10 мг уже смертельны. И поскольку один из эффектов будет получение слепота, категория риска (согласно ГОСТ 12.1.007-76) — 3. Не имеет значения, находится ли он в жидком или газообразном состоянии. Код классификации FT1, вторая группа упаковки.
Влияние на человеческий организм
Патологические изменения возникают при превышении предела толерантности. Но слепота — это только начало. Дальнейшее действие приводит к повреждению мозга и полному нарушению работы мочевыделительной системы.
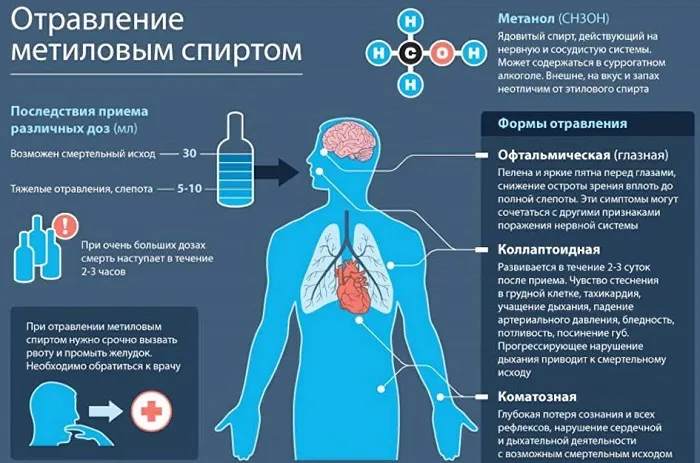
Немедленная смерть наступает при дозе до 2 граммов на килограмм веса тела. Это связано с тем, что одноатомный спирт окисляется до яда формальдегида, который использовался в качестве тихого убийцы. Он мгновенно парализует нервную систему и действует на белковые соединения. В то же время токсический эффект проявляется только через несколько часов.
Заключение
В высокоразвитых странах. метанол Его добавляют в автомобильное топливо. Из-за того, как он взаимодействует его свойствам и его взаимодействие с топливом, создается экологически чистый продукт. В Российской Федерации его использование в качестве потребительского товара запрещено законом. Известно много случаев отравления с летальным исходом.








