Тип 1/1.2 используется для получения смеси, необходимой для соединения металлов. При работе с деталями из легированной стали сварщик должен следить за состоянием пламени. В частности, не допускается чрезмерная полнота пламени. ацетилена.
Все о том, что такое ацетилен простыми словами
В этой статье в доступной и понятной форме объясняется происхождение пламени, химическом составе, свойствах и опасность для людей ацетилена. Рассматриваются основные техники его получения (состав) и как работать безопасно.
Это бесцветный газ с сильным запахом, который человек воспринимает как чеснок. Чрезвычайно опасен, как для вдыхания, так и по техническим причинам. Воспламеняется и взрывоопасен почти во всех ситуациях накопления.
Из-за своей взрывоопасности и инертности он обычно хранится растворенным в ацетоне в специально оборудованных контейнерах с пористым материалом. Его нормальная температура горения может достигать 3500 °C.
Формула ацетилена
Чрезвычайно простая формула этого газа, C2H2 H2O, позволяет синтезировать его в любой лаборатории, как бы плохо она ни была оборудована. Часто ацетилен в месте применения, поскольку зачастую проще и безопаснее получить чем организовать надлежащую доставку.
Структурная формула ацетилена Газ показан на слайде.
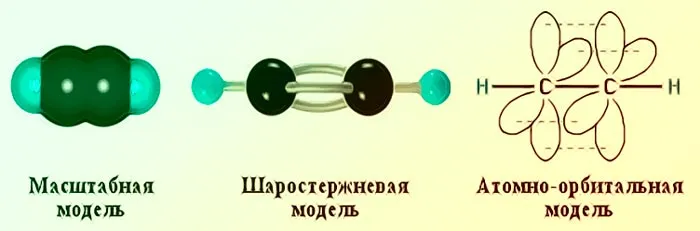
Общие сведения о строении молекулы ацетилена
Строение молекулы ацетилена можно представить как набор из двух атомов углерода, расположенных на расстоянии друг от друга. Каждый из атомов имеет три химические связи с атомами водорода.
Орбитали атомов углерода лежат в равносторонней плоскости под неизменным углом друг к другу. Эта связь может быть представлена в виде электронного облака всю химическую в виде электронного облака. Молекулярная масса ацетилена составляет 26г/моль.
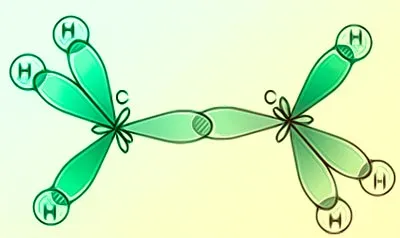
Строение молекулы ацетилена можно представить как набор из двух атомов углерода, расположенных на расстоянии друг от друга. Каждый из атомов имеет три химические связи с атомами водорода.
Метан, формула, газ, характеристики:
Метан (лат. methanum) — простейший углеводород, ограниченный по составу, органическое вещество из класса алканов, состоящее из одного атома углерода и четырех атомов водорода.
Химическая формула метана — CH4, ортологическая формула CH4. Он не имеет изомеров.
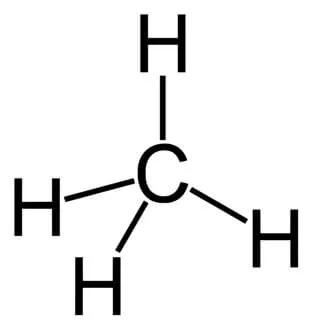
При нормальных условиях метан представляет собой легкий, бесцветный, безвкусный и не имеющий запаха газ. Однако, когда метан используется в качестве технологического газа, для предотвращения утечки могут добавляться одоранты — вещества с резким и неприятным запахом.
Метан является основным компонентом природного газа.
Он является одним из парниковых газов. Метан является третьим по значимости парниковым газом в атмосфере Земли (после водяного пара и углекислого газа). Его вклад в глобальное потепление составляет 4-9 %.
В природе он содержится в природном газе, который добывается из месторождений природного газа и газового конденсата, а также в попутном газе. Его выделяют из природного и попутного газа путем очистки и сепарации газа. Он также содержится в шахтном и отстойном газе (отсюда другие названия метана — отстойный или шахтный газ) и газе со свалок.
В анаэробных условиях (на болотах, переувлажненных почвах, на дне озер и застойных вод, где он образуется при разложении растительных остатков в отсутствии воздуха, в кишечнике жвачных животных, в биореакторах, биогазовых установках и т.д.) он образуется биогенно в результате жизнедеятельности определенных микроорганизмов.
Он растворяется в нефти, пластах и поверхностных водах. В процессе переработки нефти метан выделяется для дальнейшего использования.
Помимо газообразной формы, он также встречается в природе в твердой форме на морском дне, в океаническом дне и в зоне вечной мерзлоты в виде гидратов метана (газогидратов), которые называют «горючим льдом».
Он огнеопасен и взрывоопасен.
Практически нерастворим в воде и других полярных растворителях. Однако он растворим в некоторых неполярных органических веществах (метанол, ацетон, бензол, тетрахлорметан, диэтиловый эфир и другие).
По своим токсикологическим свойствам метан относится к веществам 4 класса опасности (малоопасные вещества) по ГОСТ 12.1.007.
Физические свойства метана:
| Название параметра: | Ценность: |
| Цвет | бесцветный |
| Пахнет | без запаха |
| Вкус | безвкусный |
| Инертное состояние (при 20 °C и давлении в 1 атмосферу) | Газ |
| Плотность (при 20 °C и атмосферном давлении 1 бар), кг/м 3 | 0,6682 |
| Плотность (при 0 °C и атмосферном давлении 1 бар), кг/м 3 | 0,7168 |
| Плотность (при -164,6 °C и атмосферном давлении 1 бар), кг/м 3 | 415 |
| Температура плавления, °C | -182,49 |
| Температура кипения, °C | -161,58 |
| Температура самовоспламенения, °C | 537,8 |
| Критическая температура*, °C | -82,4 |
| Критическое давление, МПа | 4,58 |
| Критический удельный объем, м3 /кг | 0,0062 |
| Взрывоопасные концентрации газовоздушных смесей, объемные проценты | 4.4 — 17.0 |
| Удельная теплота сгорания, МДж/кг | 50,1 |
| Коэффициент теплопередачи (при 0 °C и давлении в 1 атмосферу), Вт/(м-К) | 0,0302 |
| Коэффициент теплопередачи (при 50 °C и давлении в 1 атмосферу), Вт/(м-К) | 0,0361 |
| Молекулярная масса, г/моль | 16,04 |
| Растворимость в воде, г/кг | 0,02 |
* Выше критической температуры газ не может быть сконденсирован ни при каком давлении.
Химические свойства метана:
Метан трудно вступает в реакцию при любой температуре. в химические реакции. При нормальных условиях не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде.
Химические свойства метана аналогичны свойствам Другие представители ряда алканов. Поэтому характеризуется химические реакции:
- 1. конверсия метана в синтез-газ :
CH4 + H2O → CO + 3H2 (кат = Ni/Al2O3 при t o = 800-900 oC или без катализатора при t o = 1400-1600 oC).
Синтез-газ, полученный в этом процессе, может быть использован для следующих целей. реакции синтез-газ может быть использован для следующих синтезов метанола, углеводородов, уксусной кислоты, ацетальдегида и других продуктов.
Реакция является цепной. При воздействии света молекула брома или йода распадается на радикалы, которые атакуют молекулу метана и извлекают ее атом атом водорода, в результате чего образуется свободный метил-CH3— который сталкивается с молекулами брома (йода), расщепляя их и образуя новые радикалы йода или брома:
Br2 → Br-+ Br- ( hv) — инициирование реакции галогенирования;
CH4 + Br- → CH3— + HBr- — эволюция цепи реакции галогенирования;
CH3— + Br- → CH3Br; – обрыв цепи реакции галогенирования.
Галогенирование представляет собой из реакций Замена. Наименее гидрогенизированный атом углерода галогенируется первым (третичный атом, затем вторичный, первичные атомы галогенируются последними). Галогенирование метана происходит поэтапно — на одном этапе замещается не более одного атома водорода.
Галогенирование продолжается до тех пор, пока не будут замещены все атомы водорода.
При избытке кислорода:
Горит голубоватым пламенем.
В отсутствие кислорода углекислый газ (CO2) получаетсУгарный газ (CO) и еще меньше кислорода высвобождают мелкие частицы углерода (сажу в различных формах, таких как графен, фуллерен и т.д.) или их смесь.
CH4 → C + 2H2 (при t o > 1000 o C).
- 9. каталитическое окисление метана :
В реакциях При каталитическом окислении метана могут образовываться спирты, альдегиды и карбоновые кислоты.
2CH4 + O2 → 2CH3Образуется OH (при t o = 200 o C, кат)-метанол,
CH4 + O2 → HCHO + H2O (при t o = 200 o C, кат)-форма формальдегида образуется,
2CH4 + 3O2 → 2HCOOH + H2O (при t o = 200 o C, кат) — образует муравьиную кислоту.
Единственным ограничением этого метода соединения металлов является то, что материал сварочного стержня должен полностью соответствовать материалу соединяемых деталей.
Изомерия метана
Метан не характеризуется изомерами ни структурно (изомерия углеродного скелета, положение заместителей), ни пространственно.
Метан является ненасыщенным углеводородом и поэтому не может реагировать с в реакции присоединения.
Метан характеризуется реакции:
- разложения,
- замещения,
- окисления.
Расщепление слабополярных связей C-H происходит только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикалы. реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и т.д.), не реагирует с концентрированными кислотами, щелочами и бромсодержащей водой.
1. Реакции замещения
Метан характеризуется реакции радикальное замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом при воздействии света или нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может реагировать с хлором с образованием дихлорметана, трихлорметана и тетрахлорметана:

| Химическая активность хлора выше, чем у брома, поэтому хлорирование происходит быстро и без разбора. |
Бромирование происходит медленнее.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
R∙ свободные радикалы — это атомы или группы связанных атомов, которые содержат неспаренный электрон.
Первый этап. Начало цепи.
При воздействии кванта света или тепла молекула галогена распадается на два радикала:
Свободные радикалы — это очень активные частицы, которые стремятся образовать связь с другим атомом.
Второй этап. Второй этап.
Радикал галогена вступает в реакцию с молекулой алкана и отнимает у нее водород.
В результате образуется промежуточный продукт — алкильный радикал, который, в свою очередь, реагирует с новой неспаренной молекулой хлора:
Третий этап. Третий этап.
В цепном процессе радикалы рано или поздно сталкиваются друг с другом и образуют молекулы, радикальный процесс прерывается.
Одинаковые или разные радикалы могут сталкиваться, также два метильных радикала:

1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму при нагревании до 140 o C и под давлением. Атом водорода в метане замещается нитрогруппой NO2.
2. Реакции разложения метана (д егидрирование, пиролиз)
При медленном и длительном нагревании до 1500 o C метан разлагается на простые вещества:
Если процесс нагревания метана происходит очень быстро (около 0,01 с), происходит межмолекулярная дегидрогенизация и ацетилен:
Пиролиз метана — промышленный процесс получения ацетилена.
Ацетилен можно получить в лабораторных и промышленных условиях. Для получения ацетилена В лабораторных условиях достаточно нанести небольшое количество воды на карбид кальция (формула: CaC2), можно добавить небольшое количество воды. реакция выделения ацетилена. Для его замедления можно использовать обычную соль (типа NaCl).
Алкины
Алкины — это ненасыщенные углеводороды, в молекуле которых имеется тройная связь C≡C. Каждая из этих связей содержит одну сигма-связь (σ-связь) и две π-связи (π-связи).
Алкины также называются ацетиленовАлкины также известны как углеводороды. Первым членом гомологического ряда является этин — CH≡CH (ацетилен). Общая формула их гомологического ряда: CnH2n-2.
Номенклатура и изомерия алкинов
Названия алкинов образуются путем добавления суффикса «ин» к названию алкана с соответствующим номером: Этин, пропин, бутин и т.д.
При наименовании алкина важно отметить, что основная цепь атомов углерода обязательно должна содержать тройную связь. Нумерация атомов углерода начинается с конца, ближайшего к тройной связи. Атом углерода, с которого начинается тройная связь, указывается в конце названия.
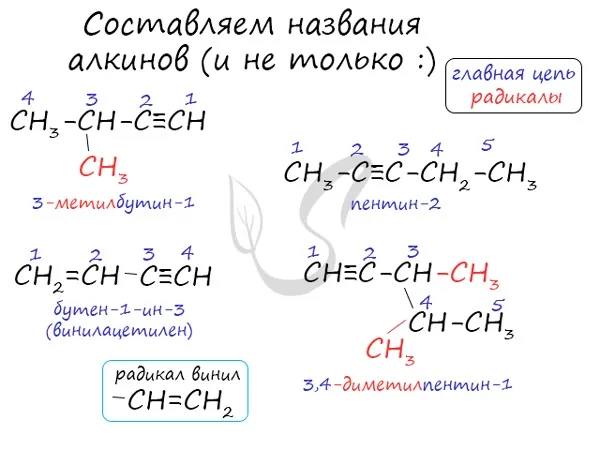
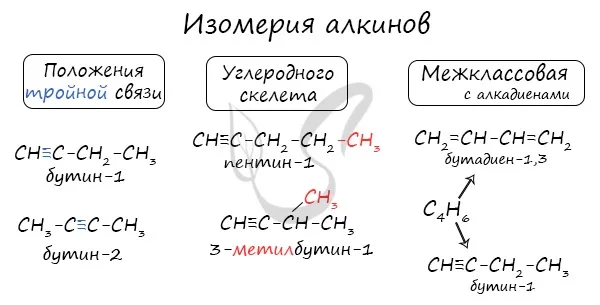
Алкины характеризуются изомерией углеродного скелета, положением тройной связи и классовой изомерией с алкадиенами.
Пространственно-геометрическая изомерия с ними невозможна, поскольку каждый атом углерода, прилегающий к тройной связи, связан с одним заместителем.
- В молекулах алкинов присутствуют тройные связи, длина которых составляет 0,121 нм
- Тип гибридизации атомов углерода — sp
- Валентный угол (между химическими связями) составляет 180°
Производство алкинов
При нагревании метана до 1200-1500 °C происходит димеризация молекул метана, в ходе которой разлагается водород.
Оно осуществляется непосредственно простыми веществами. Процесс осуществляется с помощью электрической дуги в атмосфере водорода.
2C + H2 → (t, вольтова дуга) CH≡CH
При разложении карбида кальция образуется ацетилен и гидроксид кальция II.
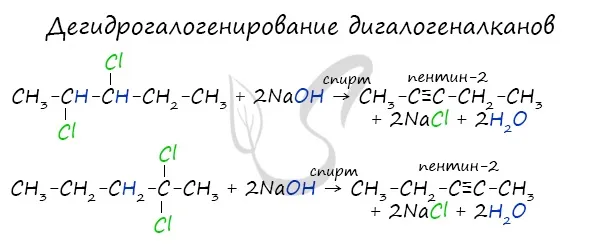
Получение гомологов ацетилена возможно в реакциях Дегидрогалогенирование дигалоалканов, в которых атомы галогена расположены на атоме углерода или на двух соседних атомах.
Химические свойства алкинов
Алкины — это ненасыщенные углеводороды, которые легко превращаются в в реакции добавки. Реакции замещения для них не характерны.
Водород соединяется с атомами углерода, образуя тройную связь. p-связь (π-связь) отщепляется, оставляя только одну σ-связь (σ-связь).
CH≡C-CH3 + H2 → (t, Ni) CH2=CH-CH3 (в реакции 1 моль водорода)
CH≡CH≡CH + 2H2 → (t, Ni) CH3-CH3 (в реакции 2 моль водорода).
Реакция с бромированной водой является качественной для ненасыщенных соединений, содержащих двойные (и тройные) связи. В этой реакции бромированная вода реакции бромированная вода обесцвечивается, что указывает на ее многократное обогащение органическим материалом.
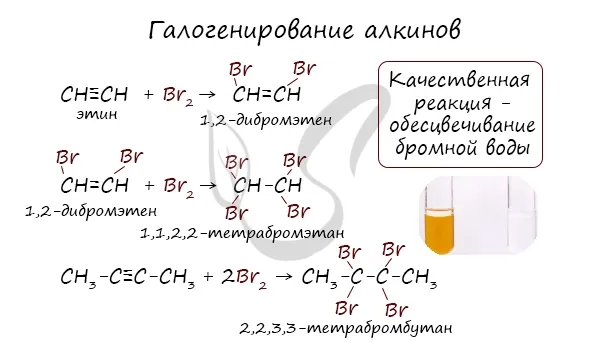
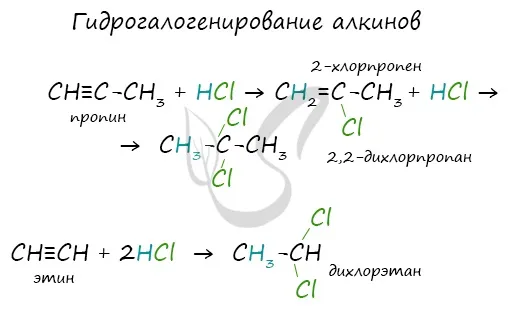
Алкины вступают в реакции Гидрогалогенирование, которое протекает в зависимости от типа связи.
Гидрогалогенирование протекает по правилу Марковникова, согласно которому атом водорода присоединяется к наиболее гидрогенизированному атому, а атом галогена — к наименее гидрогенизированному атому углерода.
Метан не характеризуется изомерами ни структурно (изомерия углеродного скелета, положение заместителей), ни пространственно.
Химические и физические свойства
Некоторые химические свойства
Свойства ацетилена Изомеры метана в основном определяются его формулой. То есть наличие атомов углерода и водорода, соединенных между собой.
Смешивание ацетилена с водой, при добавлении катализаторов, таких как соли ртути, приводит к к получению ацетат альдегида. Тройная связь атомов молекулы ацетилена при сгорании выделяет 14 000 ккал/куб. м. Во время горения температура повышается до 3000 °C.
При определенных условиях этот газ может быть преобразован в бензол. Для этого его необходимо нагреть до 4000 °C и добавить графит.
Водород в молекулах является кислотой. свойства. Это означает, что он легко отражается от молекулы в виде протонов. Ацетилен обесцвечивает воду в состоянии, содержащем бром и раствор «марганцовки».
Молярная масса ацетилена составляет 26,04 г/моль. Плотность ацетилена 1,1 кг/м³.
Физические свойства
В нормальных условиях ацетилен представляет собой бесцветный газ, практически нерастворимый в воде. Он начинает кипеть при температуре -830 °C. При сжатии он начинает разлагаться, высвобождая большое количество энергии. Поэтому он хранится в стальных баллонах, которые могут хранить газ под высоким давлением.
Этот газ не должен выбрасываться в атмосферу. Его природа может оказывать негативное воздействие на окружающую среду.
Технология и режимы сварки
Кислородно-ацетиленовые смеси используются для соединения деталей из углеродистых и низколегированных сталей. Например, этот метод часто используется для изготовления неразъемных соединений трубопроводов. Например, трубы с диаметром 159 мм и толщиной стенки 8 мм или менее. Однако существуют некоторые ограничения, так, этим методом нельзя соединять стали категорий 12×2М1, 12×2МФСР.
Сварка при помощи ацетилена Пламя при ацетиленовой сварке
Выбор параметров режима
Тип 1/1.2 используется для получения смеси, необходимой для соединения металлов. При работе с деталями из легированной стали сварщик должен следить за состоянием пламени. В частности, не допускается чрезмерная полнота пламени. ацетилена.
Расход смеси с типом кислород/кислородацетилен составляет 100-130 дм3 /час на 1 мм толщины. Мощность пламени можно регулировать с помощью огнемета в зависимости от используемого материала, его свойств, толщины и т.д.
Сварочный пруток используется для сварки с ацетилена используется сварочный прут. Его качество должно соответствовать качеству стали свариваемых деталей. Диаметр проволоки зависит от толщины свариваемого металла.
Для удобства технологов и сварщиков существует множество таблиц, где можно легко выбрать режим сварки. Для этого необходимо знать следующие параметры:
- толщину стенки свариваемых заготовок;
- вид сварки — левый, правый;
Исходя из этого, можно определить диаметр сварочной проволоки и выбрать скорость потока. ацетилена. Например, если толщина материала составляет 5-6 мм, используется наконечник № 4. Потребление ацетилена в данном случае составляет 60-780 дм3/час при левом методе и 650-750 дм3/час при правом методе.
Сварка производится небольшими участками по 10-15 мм. Работы должны выполняться в следующем порядке. Первый шаг — расплавить края. Затем формируется корень. Как только корень будет готов, сварку можно продолжить. Если толщина деталей составляет 4 мм, допускается сварка в один слой. Если толщина превышает этот предел, необходимо нанести второй слой. Он наносится только после выполнения корневого шва по всей заданной длине.
Для улучшения качества сварного шва допускается предварительный подогрев. Это означает, что будущий сварной шов нагревается горелкой. При использовании этого метода предварительный нагрев необходимо повторять после каждого перерыва.
Газовые швы можно сваривать в любом пространственном положении. Существуют особенности, например, при изготовлении вертикального шва. Например, вертикальный сварной шов должен быть сварен снизу вверх.
Во время сварки нельзя прерывать работу, по крайней мере, до тех пор, пока не будет вырезан весь шов. По окончании работы горелку следует медленно отводить, иначе могут возникнуть дефекты сварки, такие как ямы и поры. Интересной особенностью сварки труб является то, что ток не протекает, поэтому концы труб должны быть герметичными.
Виды ацетилена
Промышленность производит два типа ацетилена — в твердом состоянии и в виде газа.
Газообразный
Ацетилен обладает сильным запахом, что имеет определенные преимущества в случае утечки. Его масса аналогична массе атмосферного воздуха.
Жидкий
Жидкий ацетилен Он не имеет цвета. У него есть одна особенность: он разрушает цвет. Ацетилен, как в жидком, так и в газообразном состоянии, является опасным веществом. Это означает, что при неправильном обращении он может взорваться в любой момент, даже при комнатной температуре. Для повышения безопасности при работе с материалом используется так называемый антипирен. Это означает, что пористое вещество помещается в контейнер, предназначенный для хранения ацетилена снабжен пористым веществом. Это снижает его опасность.
Метан реагирует с разбавленной азотной кислотой по радикальному механизму при нагревании до 140oC и под давлением. Атом водорода в метане замещается нитрогруппой NO2.
Декарбоксилирование солей карбоновых кислот (реакция Дюма)
Реакция Дюма — это взаимодействие солей карбоновых кислот со щелочами путем плавления.
R-COONa + NaOH → R-H + Na 2 CO 3
Декарбоксилирование — это разложение (удаление) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксильной группы (-COOMe) соли органической кислоты.
Когда ацетат натрия реагирует с гидроксидом натрия, в результате плавления образуются метан и карбонат натрия:
Как получить ацетилен
От метана до дома получить ацетилен очень сложно. Самый простой способ выделить этот газ — это это реакция Самый простой способ удаления метана из метана — использовать воду с карбидом кальция. Многие из вас, вероятно, помнят, как бросали кусочки этого вещества в лужи и что происходило потом. реакция. Послышался сильный шум. Карбид кальция постепенно плавился и образовывал большое количество пены. Такой реакцию можно записать следующим образом: CaC2+2H2O=C2H2+Ca(OH)2.
Многие используют коммерческий карбид кальция, который содержит большое количество примесей. Следствием этого является то, что. при реакции С водой вещество выделяет неприятный запах. Он высвобождается при образовании общего с ацетиленом небольшое количество токсичных паров. Наиболее распространенными являются фосфин, сероводород и так далее. как получить ацетилен Производить метан из метана можно только с помощью специальной установки.
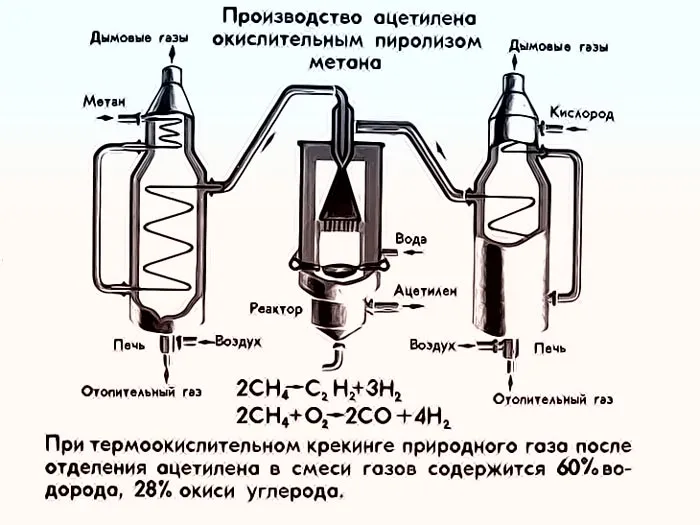
Крекинг нефтепродуктов
Сегодня это возможно не только из метана. получить ацетилен. Основным промышленным методом получения этого алкина является пиролиз (разложение) углеводородов. Когда он производится из метана получить ацетилен, затраты на энергию минимальны. Помимо дешевого и доступного сырья, эта технология интересна для производителей углеводородов еще и тем, что технологическое оборудование для процесса дегидрирования метана простое.
Существует два способа осуществления этого процесса химического Процесс дегидрирования метана основан на двух различных вариантах технологического процесса. Первый вариант основан на прохождении метана через электроды, нагретые до 1600°C. Процесс включает в себя резкое охлаждение полученного продукта. Второй вариант дегидрирования метана с получением ацетилена это использование энергии, получаемой при частичном сгорании этого алкина.
Цилиндры с ацетилен, не могут быть оснащены медными клапанами, поскольку медь содержит медь. Взаимодействие этого металла с ацетиленом сопровождается получением взрывоопасная соль.
Промышленный метод намного сложнее и технически требовательнее, но он предназначен для использования на получение ацетилена В количествах, соответствующих потребностям производственных предприятий.
Инструкция
1. поместить небольшое количество глинозема в контейнер из термостойкого материала и закрыть его крышкой и двумя трубками для отбора проб газа, одну из которых помещают в пробирку с концентрированной серной кислотой. Нагрейте емкость на газовой горелке, температура оксида алюминия должна быть примерно от 350 до 500 градусов.
2. Затем налейте немного чистого этилового спирта в отдельную пробирку. Закройте пробирку газоотводной трубкой и нагрейте ее в спиртовой горелке. Соедините флакон с контейнером, содержащим оксид алюминия. При нагревании спирт начинает испаряться и проходит через паровую трубку в алюминиевый контейнер. При высокой температуре в оксиде алюминия происходит дегидратация, т.е. вода отщепляется от молекул спирта. Этилен выходит из резервуара вместе с водяным паром и нереактивным спиртом в газообразном состоянии. Эту смесь опускают в пробирку с серной кислотой, которая используется для обезвоживания смеси.
Смешайте этиловый спирт и концентрированную серную кислоту. A реакция с образованием этилового эфира кислоты. Нагрейте смесь, так как при нагревании спирт обезвоживается и выделяется этилен.
Похожие видео
Обратите внимание. При работе с кислотами надевайте средства защиты, защищайте глаза и кожу. Соблюдайте все меры предосторожности в случае пожара.
Этан — один из газов, часто встречающихся в природе. Это органическое вещество, которое, как и метан, является компонентом нефти и газа. Он изготовлен из получают этилен, который, в свою очередь, является основным материалом для получения уксусной кислоты, этилового спирта, винилацетата и ряда других веществ. Метан обычно используется в качестве исходного материала для производства этана.

Инструкция
И метан, и этан относятся к классу органических соединений, называемых алканами. Они, в свою очередь, являются частными случаями терминальных углеводородов. Углеводороды — это органические соединения, молекулы которых, как следует из названия, состоят из атомов углерода и водорода. Метан — первый представитель гомологического ряда алканов. За ним следуют этан, пропан, бутан и ряд других. Типы насыщенных углеводородов описываются следующим образом. Метан и этан гомологичны друг другу. Это термин для обозначения веществ, которые являются идентичными по химическим свойствам, но отличаются по составу и, следовательно, по физике. свойствам. Состав гомологов различается в зависимости от группы CH2.
Существует два основных метода получения этана из метана. Первый из них — это использование реакции Существует два основных метода получения метана. Этот метод наиболее часто использовался примерно в 1870 году. реакция основан на взаимодействии галогенпроизводных насыщенных углеводородов с металлическим натрием. В частности, это может быть осуществлено с помощью хлорида метана. Для упрощения метода реакции К этому соединению необходимо добавить натрий. Он будет вмешиваться в реакцию с молекулами хлора. Натрий прилипает к молекулам хлора, в результате чего образуется получится этан:CH3-CH3хлорметан; -2NaCl; C2H6 Для того чтобы получить Этан, хлорметан должны быть подготовлены заранее. Он получаетсПутем нагревания метана и хлора до 400 градусов. Затем выполните реакцию корень, как показано выше.
3. 2-й метод — это многоступенчатый метод. Сначала метан окисляется до ацетилена, а после этого ацетилен гидрогенизация до этана. Окисление метана до ацетилена 4CH4+4O2?CH?CH+CO2+CO+5H2O+2H2 Затем его гидрогенизируют. ацетилена. Результатом двойного гидрирования является конечный продукт реакции является этан:CH3?CH3?CH2=CH2?C2H6 (гидрирующий водородный радикал H2) Хотя этан часто получают получают немного другими методами — этот метод все еще иногда используется, и только тогда, когда исходным материалом может быть только метан. Метан и этан являются газами одной категории и группы, поэтому один из двух газов легко получить.
Обратите внимание! Все алканы токсичны и огнеопасны.
Хлорэтан (также известный как этилхлорид, хлористый этил) — это бесцветный газ с формулой C2H5Cl. химическую Формула C2H5Cl. Он смешивается с этиловым спиртом и диэтиловым эфиром, но почти не смешивается с водой. Как это возможно, что получить это вещество?

Инструкция
1. Существует два основных промышленных метода синтеза хлорэтана: 1) путем гидрохлорирования этилена (этилена).2) путем хлорирования этана.
2. в настоящее время второй метод считается наиболее перспективным и экономичным. Реакция протекает следующим образом.
3. как и в случае с любым стандартом реакция Галогенирование алканов происходит по так называемому «радикальному механизму». Для получения соединения-предшественника смесь: алкан (в данном случае этан) — галоген (в данном случае хлор) должна быть подвергнута насыщенному ультрафиолетовому излучению.
4. под воздействием света молекула хлора распадается на радикалы. Радикалы реагируют с молекулами этана, удаляют их атом водорода и образуют этильные радикалы -C2H5, которые в свою очередь разрушают молекулы хлора и образуют новые радикалы. Таким образом, происходит так называемая «цепная реакция». реакция».
5. повышение температуры увеличивает скорость хлорирования этана. Однако он также увеличивает «выход» других хлорированных производных этана, что не выгодно, эту реакцию проводится при низких температурах для максимального извлечения целевого продукта.
Полезный совет В течение относительно короткого периода времени это вещество использовалось для производства Pb(C2H5)4-тетраэтилсвинца — хорошо известной добавки к топливу для ТЭЦ, повышающей октановое число моторного топлива и снижающей вероятность воспламенения. Ввиду чрезвычайной вредности этой добавки, токсичности свинца и всех его соединений, использование этилированного бензина в настоящее время строго ограничено и даже полностью запрещено в некоторых странах. Разрешено только добавление этилированного бензина в авиационное топливо. Хлорэтан также используется в производстве ацетилцеллХлорэтан также используется в производстве юлозы, в синтезе кремнийорганических соединений, в качестве растворителя для различных смол, смазок и т.д. Он также используется в медицине как быстродействующий анестетик при анестезии и как «антифриз».
Похожие видео
Полезный совет Это вещество имеет все свойства карбоновая кислота. Используется в кулинарии (бытовой и промышленной) в качестве консерванта и ароматизатора. Он также используется в фармацевтической промышленности в качестве растворителя при переработке целлюлозы и окрашивании.








