Сульфат меди особенно активен на песчаных, илистых и влажных почвах. В этих почвах низкое содержание меди. Удобрения вносятся в сухом, растворенном виде, в основном весной, как корневым, так и листовым способом.
Меди сульфат, что это. Что такое медный купорос
Пентасульфид меди является неорганическим соединением с таким названием. При соблюдении дозировок он обладает полезными свойствами, а в больших количествах может быть смертельно опасен. Это соединение характеризуется токсичностью и классифицируется как токсичное вещество категории 4.
При проглатывании порошок раздражает слизистые оболочки и
Соединение представляет собой синий порошок или прозрачные светло-голубые тройные кристаллы, содержащие 24% меди. Препарат обладает физическими свойствами:.
Формула
Что такое сульфат меди? Это вещество, полученное в промышленных условиях в результате химической реакции. Он очень гигроскопичен и образует кристаллы при поглощении жидкости (пентагидрат сульфата меди). Другое название этого соединения — сульфат меди или соли сульфата меди. Химическая формула этого соединения — CuSO45H2O. В нем одна молекула соли соединяется с пятью молекулами воды.
Свойства
При правильном использовании сульфата меди можно получить только положительные результаты от его применения. При этом он безопасен, не накапливается в организме, растениях или почве и не вызывает побочных эффектов. Полезные свойства соединения:.

Для чего нужен
Благодаря своим химическим свойствам сульфат меди широко используется во многих областях. Используется в качестве пищевой добавки в животноводстве, для дезинфекции при разведении скота. Состав используется для следующих целей
Резервуары для воды, бассейны,.
Соединение широко используется в промышленности.
Горнодобывающая промышленность — в производстве кобальта, цинка и свинца.
Сульфид меди(II)
Сульфид меди (II) (моносульфид меди) — CuS, неорганическое бинарное соединение двухвалентной меди и серы. Он имеет черный цвет и нерастворим в воде и разбавленных растворах кислот. В природе он встречается в виде редкого минерала — медного индиго.
Его получают при прямом взаимодействии элементов или в результате обменных реакций между солями двухвалентной меди и водорастворимыми сульфидами.
Сульфид меди, полученный сухим способом (теплота образования из элемента 12 ккал/моль), очень хорошо проводит ток (он является сверхпроводником при температуре ниже 1,66 К). Рентгенодифракционные исследования их кристаллов показали их довольно своеобразную и сложную структуру: одна треть атомов меди находится в центре треугольника из атомов серы, две трети в центре тетраэдра — кроме того, две трети атомов серы представлены S2(2> 2-), как в кремнеземе. В связи с этим структура кристалла CuS может быть более точно представлена формулой Cu I 4 Cu I I I I 2 S-1 2> 2 S-222.<\mbox>>_>. Рисунок 2CuS== Согласно Cu, при температуре около 400°C происходит сильное разложение сульфида.2S + S (давление пробоя 80 мм рт. ст. при 450°C). Полисульфидные производные меди Cu2Sn(где n = 3÷6 — также CuS2 ) и селенидов CuSe (теплота образования из элементов составляет 10 ккал/моль). При взаимодействии CuSO4 Насыщенный серой раствор полисульфида, довольно устойчивые красные кристаллы MCuS. (где M — NH4, K, Rb и Cs). Наименее растворимой из них является цезиевая соль.
Купрум 2 сульфат. Купрум сульфат
Ресурсы Википедии.
Сульфат меди, сульфат меди (Kupfersulfat n), представляет собой соль сульфата меди в безводном CuSO.4Продукт представляет собой белое сухое кристаллическое вещество, которое при нагревании воды становится синим или лиодиновым.
Он хорошо растворим в воде. Кристаллы из водного раствора в виде кристаллогидрата.4-5H2o голубой цвет, известный как сульфат меди (голубой камень). При температуре выше 96°C он превращается в трехцветные соли при уравновешивании водным раствором: кузо4-3H2O.
Гидратация кристаллической воды удаляется путем нагревания в небольшой керамической посуде, а стеклянные или другие стойкие неметаллические емкости осторожно нагревают (перегрев приведет к вирефикации серы из более обширных продуктов разложения). Давление пара безводного сульфата меди выше, чем давление воды многих других безводных веществ, которые также могут быть получены при обезвоживании кристаллических аквариумов в электролите на других водных склонах при нормальной температуре.
Медь является низкоактивным металлом из сульфата меди и поэтому может быть разбавлена с большинством других металлов. ZARIS:.
Для домашних экспериментов контроль влажности и температуры может быть ограничен. Помните, что сульфат меди является химически активным соединением. Вот почему рекомендуется выбирать дистиллированную воду, не содержащую других минеральных примесей.
Медный купорос — красивое и полезное неорганическое соединение
Сульфат меди представляет собой кристаллический гидрат4. После растворения в воде он активно поглощает воду из материалов, с которыми вступает в контакт, и кристаллизуется в виде пентагидрата сульфата меди(II) CUSO4-5H2O.

Пентагидрат сульфата меди(II) представляет собой ярко-синий кристалл. Сине-голубой порошок на воздухе постепенно размывается, теряет молекулы воды и превращается сначала в зеленовато-зеленый, а затем в бесцветный — чистый сульфат меди. То же самое происходит и при нагревании. Водные соли постепенно высыхают. Обе соли не имеют запаха, непрозрачны и обладают неприятным горьким вкусом с металлическим оттенком.
CUSO4-5H2O растворим в разбавленном спирте, но не в чистом спирте. Он растворим в соляной кислоте высокой плотности. Сульфат меди не воспламеняется и считается вспомогательным средством, но может взорваться при нагревании в закрытой емкости, так как разложение соли связано с выделением газа. По этой причине его следует хранить в больших количествах в проветриваемом помещении.
Сульфат меди (II) относится ко второму классу опасности и не очень токсичен. Он может вызвать неприятные симптомы при вдыхании или проглатывании в определенных дозах (в некоторых народных средствах есть рецепты, требующие пить растворы сульфата меди). Глаза также должны быть защищены от мелкой пыли сульфата меди. Передозировка может вызвать учащенное мочеиспускание, рвоту, боли в животе, смерть и даже потерю чувствительности. Поэтому к рецептам альтернативной медицины следует подходить критически и осторожно.
Длительная работа с веществом требует защитной одежды, защиты глаз, кожи и кожных покровов специальными средствами (перчатки, форма, дыхательный аппарат, очки).
Получение медного купороса

В природе встречаются различные модификации сульфата меди (II): мелкантит (сульфат меди), медит (безводный сульфат меди), бонатит (тригидрат), бутират (7-солевая соль), браутит (CUSO4-3CU).
В промышленных масштабах сульфат меди получают химическим путем из оксида меди или сульфата меди или сульфата меди. Большая часть добытых и произведенных химических веществ используется для производства ряда соединений меди.
Применение

— В химической промышленности для производства красок и лаков. — В обогащении руды. — Электролитическое и гальваническое покрытие металлов медью. — Электроника: Производство печатных плат. — Фотография: — Текстильная промышленность: производство ацетатных волокон; гравировка тканей. — Строительная промышленность: защита древесины от гниения, бетона, штукатурки, каменной кладки от солевых отложений, металла от ржавления. — В пищевой промышленности сульфид меди 5-водный является пищевой добавкой E519. Используется благодаря своим антисептическим и влагопоглощающим свойствам (консервант, загуститель). — В лабораторной практике используется гигроскопичность сульфата меди: он применяется для осушения газов и высоких концентраций спирта и используется в качестве индикатора влажности. — Медицина и ветеринария: дезинфицирующее и противогрибковое средство. — Растениеводство: препараты от болезней растений, медьсодержащие удобрения; составы для лечения повреждений плодовых деревьев; средства для проращивания.
Сульфат меди и другие химические продукты и лабораторное оборудование можно купить в интернет-магазине Prime Chemicals Group по доступным ценам с доставкой по Москве и Московской области.
Выращивание кристаллов — это увлекательный процесс, который позволяет новому поколению развить интерес к предметам естественных наук.
Другие эксперименты
- В пустую пластиковую пробирку высыпьте из баночки весь сульфат меди CuSO4 (5 г).
- Долейте пробирку водой доверху.
- Плотно закройте пробирку и несколько раз встряхните.
- Налейте кипяток в пластиковый стаканчик, как показано на рисунке. Соблюдайте меры предосторожности при работе с кипятком!
- В стакан с кипятком поместите пробирку с сульфатом меди. Подождите 3 минуты.
- Аккуратно достаньте пробирку из стакана. Встряхивайте её 10 − 20 секунд.
- Повторяйте пункты 4 − 6 до полного растворения содержимого пробирки.
- Согните фигуру из короткой медной проволоки, как показано на рисунке. Убедитесь, что она может быть надёжно закреплена в пробирке.
- Поместите фигуру из проволоки в пробирку с раствором сульфата меди.
- Поставьте пробирку обратно в стакан с горячей водой. Подождите 1 час.
- На медной проволоке вырос кристалл! Вы можете оставить проволоку в пробирке ещё на 1 − 2 часа, чтобы кристалл вырос ещё больше.
Синий прозрачный кристалл сульфата меди CuSO4*5H2O выращенных кристаллов на медной проволоке.
Утилизация
Утилизируйте отходы от эксперимента вместе с бытовыми отходами.
Почему происходит рост кристаллов?
Сульфат меди является одним из веществ, растворимость которых в воде увеличивается при нагревании. Аналогично, при охлаждении его растворимость уменьшается, что приводит к выделению сульфата меди в виде красивых голубых кристаллов CuSO4-5H2O. Благодаря тому, что охлаждение раствора происходит медленно, кристаллы развиваются постепенно и только на проволоке.
Почему сульфат меди при охлаждении раствора образует кристаллы, а не опускается на дно в виде мелкого порошка? Кристаллы отличаются от аморфных твердых тел (например, сажи и стекла) тем, что составляющие их частицы находятся в правильном геометрическом расположении друг относительно друга. Природе часто не нравятся такие строгие соответствия. Однако именно такая последовательность частиц внутри твердого тела позволяет им чувствовать себя наиболее комфортно. Это означает, что каждый атом максимально тесно связан со своим окружением, а все положительные заряды наиболее эффективно взаимодействуют со всеми отрицательными зарядами.
Например, атом меди предпочитает быть окруженным шестью атомами кислорода. Именно такая среда достигается в кристаллах гидратации:
Почему кристаллы растут на медной проволоке?
Подобное расширяется в подобное. На поверхности проволоки всегда имеется тонкий слой оксида меди (CuO). Он содержит медь в той же степени окисления Cu 2+, что и сульфат меди. Кроме того, поверхность самой медной проволоки шероховатая, т.е. имеет множество мелких неровностей. Когда сульфат меди «переполняет» раствор, он начинает кристаллизоваться на проволоке, поскольку она неоднородна и также содержит медь.
Кристаллизация вещества обычно начинается с так называемого ядра. Это группа частиц, которые по своему составу уже напоминают будущие кристаллы. Теперь рост кристаллов начнется из семени, посаженного в землю. Если в пробирке не было проволоки, она может начаться там, где появился кристаллический зародыш. Однако поверхность бронзовой проволоки сформирована таким образом, чтобы способствовать созданию ядра для непосредственной кристаллизации сульфата меди. Медленное охлаждение раствора и эта особенность проволоки вызывают развитие кристаллов только внутри нее.
Зачем во время роста кристалла нужно держать пробирку в горячей воде?
В других экспериментах этой серии охлаждение кристаллизационного раствора проводится при комнатной температуре. Однако этот эксперимент слишком медленный — с остывшей горячей водой. Если теплый насыщенный раствор сульфата сразу же вылить (или даже поместить на воздух) в пробирку с холодной водой, то на дне пробирки, а также на проволоке вырастут синие кристаллы.. Они прилипают друг к другу, и в результате мы получаем довольно красивый, но довольно неправильной формы лес изломов. Мы хотим, чтобы кристаллы росли красиво, и в итоге получился прекрасный опыт. Это требует очень медленного охлаждения для роста только на проводах и в аккуратном виде. Этого можно достичь.
В идеале, вы хотите, чтобы кристаллы росли определенным образом, а не только в определенном месте. В наиболее успешных экспериментах были получены самые интересные результаты: почти все сульфаты встречаются в виде монокристаллов So -Calcled. Это называется красивым многогранником, который блестит, переливается и прозрачен со всех сторон, без каких-либо дополнительных внутренних особенностей или аномалий.
Развитие эксперимента
Большой кристалл
Маленькие голубые кристаллы сульфата — смотреть на них одно удовольствие. Но как же вырастить действительно большие кристаллы? Однако это не так просто.
В качестве емкости используйте стеклянный химический стакан или пластиковый стаканчик (который затем можно нагреть так же, как черепаху или стакан с сахаром в других опытах с набором). В первом случае вам понадобится около 30 граммов бронзовой кузовистой бронзы4*5H2O. Его можно найти в магазинах со зданиями или в магазинах, торгующих удобрениями. Если вы разрабатываете очень крупные кристаллы и решили делать это в стекле, заранее подготовьте 60-70 граммов сульфата меди.
Растворите весь сульфат меди в теплой воде. Хорошо перемешайте раствор, пока все кристаллы не растворятся. В качестве «опор» для кристаллов используйте бронзовую проволоку, бечевку или спички.
Теперь наберитесь терпения! На выращивание крупных кристаллов может уйти несколько дней!
Кристаллизация в холодильнике
Как температура окружающей среды влияет на скорость и эффективность кристаллизации? Вы узнаете! Повторите эксперимент, но подготовьте две пробирки с раствором сульфата меди. К каждому необходимо добавить 5 грамм CUSO4*5H2o, используя раствор и кристаллы из основного эксперимента.
Остановитесь после шага 9 инструкции. Поместите одну из тестовых трубок в горячую воду, как в шаге 10, а другую — в холодильник (внутренняя температура около 4 c o ).
Подождите от 1 до 2 часов. Сравните результаты. Где находятся выращенные кристаллы? Где находятся самые крупные и почему?
Кристаллы NaCl
Разработайте кристаллы из самой обычной поваренной соли — хлорида натрия NaCl.
Растворите 39 г соли в 100 мл кипящей воды. Хорошо перемешайте раствор, пока все кристаллы не растворятся. Лучший способ поддержать кристаллы — использовать кусок дерева с намотанной на него бечевкой. Опустите его конец в раствор. Сделайте несколько узлов на конце нити.
Вам остается только ждать! Убедитесь, что стакан стоит в таком месте, где он не будет трястись или падать.
Для профилактики рака лекарство принимается перорально. Приготовьте раствор сульфата меди из щепотки порошкообразного сульфата меди на 500 мл и используйте его раз в неделю натощак.
Сульфат меди и медный купорос, характеристика, свойства и химические реакции
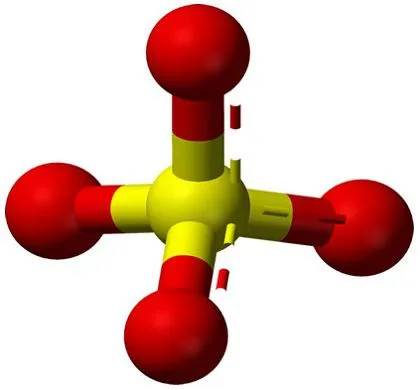

Сульфат меди — это неорганическое вещество с химической формулой CuSO4.
Краткая характеристика сульфата меди:
Сульфат меди представляет собой белый минерал.
Химическая формула сульфата меди — CuSO4.
Сульфат меди — это неорганическое химическое соединение, представляющее собой соль серной кислоты и меди.
Он хорошо растворим в воде. Растворение сульфата меди происходит при выделении значительного количества тепла. Сульфат меди гидролизуется с образованием кислотных веществ.
Он образует с водой кристаллический гидрат: пентагидрат меди CuSO.4-5H2O, также называемый сульфатом меди, тетрагидратом сульфата меди CuSO.4-4H2O, тригидрат сульфата меди CuSO4-3H2CuSO, гидратированный сульфат меди4-H2O.
Растворим в глицерине, метаноле и этиленгликоле. Не растворяется в ацетоне и этаноле.
Сульфат меди является необожженным, тугоплавким и взрывоопасным.
Сульфат меди является пищевой добавкой E519.
В природе сульфат меди встречается в виде минерала желчного камня (CuSO).4-5H2O), халькоцианит (CuSO4), бонатит (CuSO4-3H2O), бутит (CuSO4-7H2O) и некоторые другие минералы.
Краткая характеристика медного купороса:
Сульфат меди — это неорганическое вещество с различными оттенками синего цвета.
Химическая формула сульфата меди — CuSO4-5H2O.
Сульфат меди является пентагидратом сульфата меди.
Он хорошо растворим в воде. Он также растворим в глицерине, метаноле, этаноле и этиленгликоле.
Он постепенно высыхает на воздухе (теряет кристаллическую воду).
Сульфат меди является необожженным, тугоплавким и взрывоопасным.
Сульфат меди классифицируется как опасное вещество категории 2 в соответствии с ГОСТ 12.1.007.








