Диоксид кремния входит в состав стекла, поэтому чайная посуда вашей бабушки должна содержать силикон. И вы не можете загорать на пляже без песка (sio2) просто невозможно (песок можно найти на каждом шагу).
Содержание
Чистый диоксид кремния был выделен в 1811 году французскими учеными Жозефом Луи Гей Россаком и Луи Жаком Теннаром.
В 1825 году шведский химик Йонс Якоб Берцелиус провел реакцию металлического калия с фтористым кремнием.4 производили чистый элементарный кремний. Название нового элемента означает siliquium (от латинского silex). (что означает пирит). Название русский кремний было придумано русским химиком Германом Ивановичем Джессом в 1834 году. Греки перевели его как «обрыв, гора».
Нахождение в природе
Согласно различным источникам, доля кремния в коре Земли составляет 27,6-29,5 % по массе. Поэтому кремний является вторым по распространенности элементом в земной коре после кислорода. Его концентрация в морской воде составляет 3 мг/л 2.
В большинстве случаев кремний появляется в виде диоксида кремния — соединения на основе кремния (IV) SIO2 (примерно 12% от массы коры). Основные минералы и горные породы, образованные кремнием, — это песок (речной и кварцевый), кварц и кварцит, звезды и звездочки. Силет и глиняная коса — вторая по распространенности в природе группа соединений кремния.
Имел место единичный случай появления чистого кремния в его естественной форме.
Получение
Свободный кремний можно получить, пересыпая белый песок, который является диоксидом кремния, магнием.
Получается коричневый порошок аморфного кремния». 4
Кремний технической чистоты производится в промышленности в обедненном SIO2 печь хорошего типа с колой около 1800°C. Чистота полученного таким образом кремния может достигать 99,9% (основными примесями являются углерод и минералы).
Возможна дополнительная очистка кремния от примесей.
- Очистка в лабораторных условиях может быть проведена путём предварительного получения силицида магния Mg2Си. Сих Моношане газ4. Моносилан очищают ректификацией, сорбционными и др. методами, а затем разлагают на кремний и водород при температуре около 1000 °C.
- Очистка кремния в промышленных масштабах осуществляется путём непосредственного хлорирования кремния. При этом образуются соединения состава SiCl4 и сикл.3H. Эти хлориды различными способами очищают от примесей (как правило перегонкой и диспропорционированием) и на заключительном этапе восстанавливают чистым водородом при температурах от 900 до 1100 °C.
- Разрабатываются более дешёвые, чистые и эффективные промышленные технологии очистки кремния. На 2010 г. к таковым можно отнести технологии очистки кремния с использованием фтора (вместо хлора); технологии предусматривающие дистилляцию монооксида кремния; технологии, основанные на вытравливании примесей, концентрирующихся на межкристаллитных границах.
Содержание примесей в рафинированном кремнии может быть снижено до 10-8-10-6% по массе. Более подробную информацию о создании нечистого кремния можно найти в статье Поликристаллический кремний
Процесс производства чистого кремния был разработан Николаем Бекетовым.
В России промышленный кремний производит компания OK Rusal в Каменске-Уральском (Свердловская область) и Шелехове (Иркутская область) — Nitol Solar.
Нитиновая кислота слабо растворима в воде. Это нестабильное соединение — при нагревании или длительном хранении оно постепенно разделяется на воду и оксид кремния (IV).
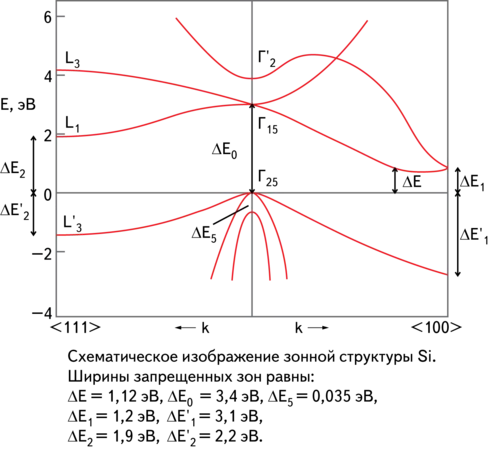
Кремний — общая характеристика элемента и химические свойства
Кремний входит в группу 14 D.I. Менделеев.
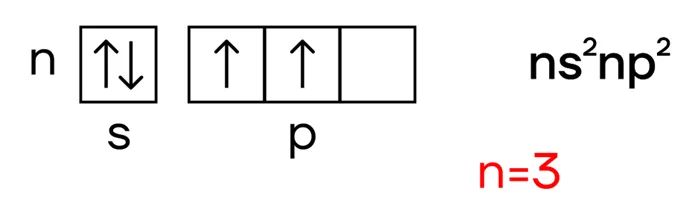
На внешнем энергетическом уровне атома углерода находятся четыре электрона в электронной конфигурации 3S 2 3p 2. Степени окисления кремния составляют -4, +2 и +4. Кремний обычно неметаллический, в зависимости от типа превращения, в котором элементы могут быть окислительной и восстановительной средой.
Аллотропия кремния
Кристаллический кремний — это темно-серое вещество с металлическим блеском, большой твердостью, хрупкое и полупроводниковое. 1415°C; t° кипения. 2680°C.
Он имеет алмазную структуру (гибридизация SP 3-кремний) и образует прочные ковалентные связи S.
Аморфный кремний представляет собой коричневый порошок, гигроскопичен и более реакционноспособен.
Силиконы используются в промышленности для производства сплавов и материалов. Ванадий оксид кремния (V3Si) используется в качестве сверхпроводника, а силикат рения (ReSi) — в качестве полупроводника.
Химические свойства кремния
Кремний имеет относительно низкую электроотрицательность. Что это значит: это значит, что он обладает сильными восстановительными свойствами, даже сильнее, чем углерод! Так, среди неметаллов он реагирует со стандартными окислителями, повышая свою степень окисления до +4.
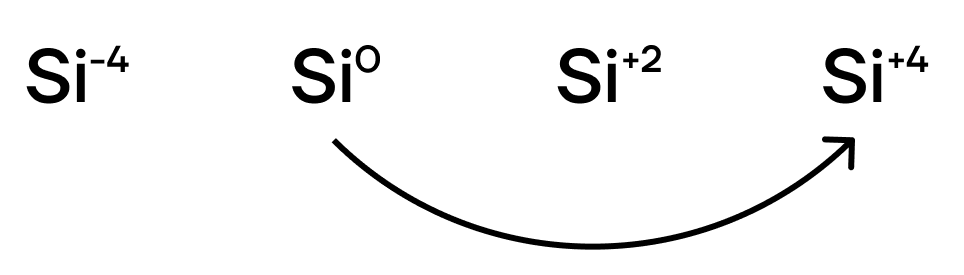
В отличие от других неметаллов, реагирующих со щелочами, кремний в этих реакциях является лишь восстановителем, повышая степень окисления до +4.

Конечно! Но не все. Слабый кремний может получить электроны только от самых слабых металлов. Как и углерод, кремний реагирует в основном с активными и промежуточными металлами с образованием силикатов.
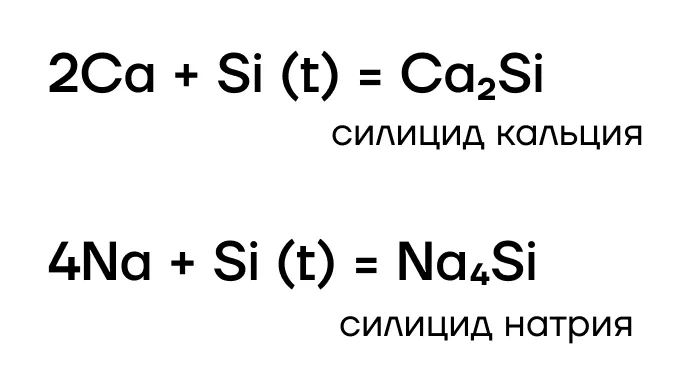
Как и многие другие бинарные соединения, силикаты металлов могут подвергаться гидролизу.
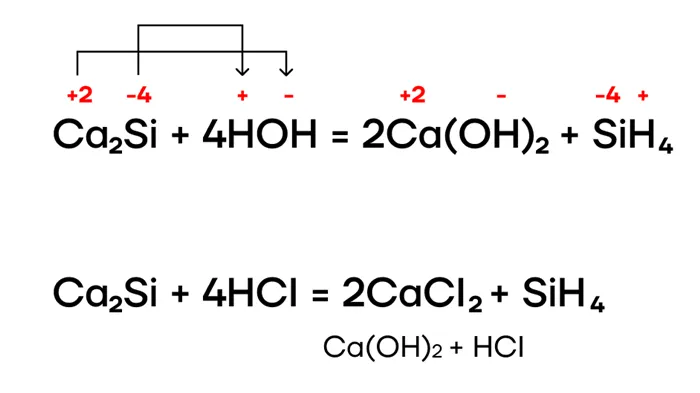
Из-за степени окисления кремния-4 образующийся бесцветный газ силан с неприятным запахом обладает восстановительными свойствами и может реагировать с окислителями (например, кислородом).
(Оксид кремния (IV) содержится в песке, которым усыпаны дороги).
Производство кремния
Кремний производится в основном путем восстановления кремнезема, SiO2 Использование сильных восстановителей: углерод, металлы.
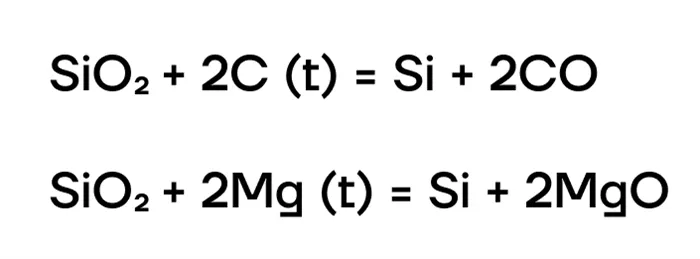
Оксид кремния (IV) — кремнезём SiO2
Диоксид кремния представляет собой кислотный оксид и является основным компонентом почти всех горных пород на Земле. Диоксид кремния и силикаты составляют почти 90% массы литосферы.
Почему же кремний так хорош? Потому что это единственный кислотный оксид, который не реагирует с водой! Поэтому он соответствует нерастворимому силикату H2SiO3 .
Как кислотный оксид, SiO2 проявляет кислотные свойства и поэтому может реагировать с веществами, проявляющими основные свойства, образуя соли. Силикаты:.
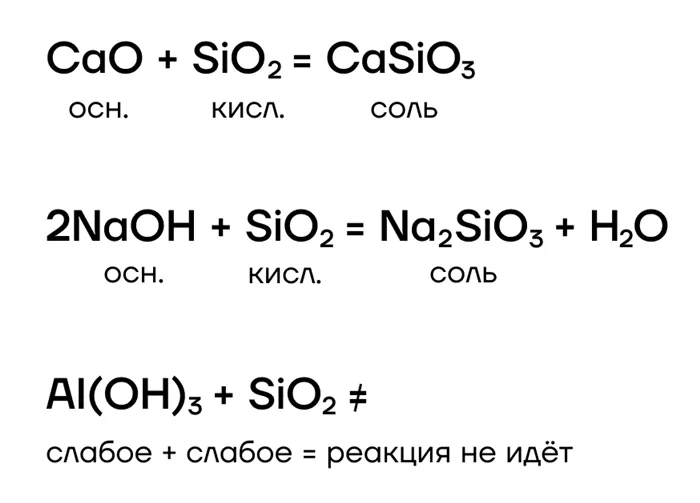
Да! SiO2 Является условно «сильным» оксидом в реакциях замещения и может вытеснять «пациентов» (CO)2Итак.2(t) этих солей во время сплавления: да!)
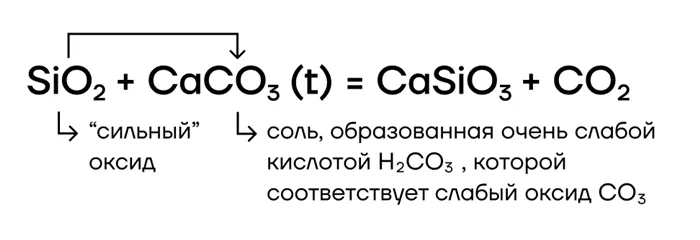
+4SiO из-за высокой степени окисления кремния.2 слабо окисляется и обычно реагирует только с очень сильными восстановителями (например, углеродом и металлами).
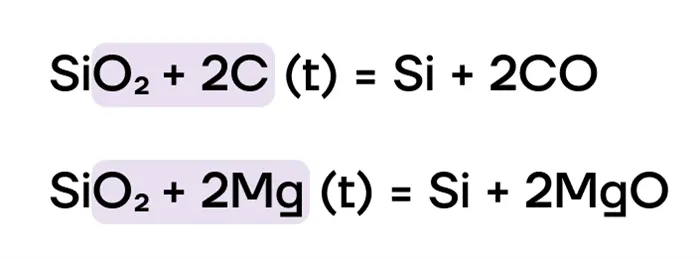
Единственная и неповторимая — кремниевая кислота и силикаты

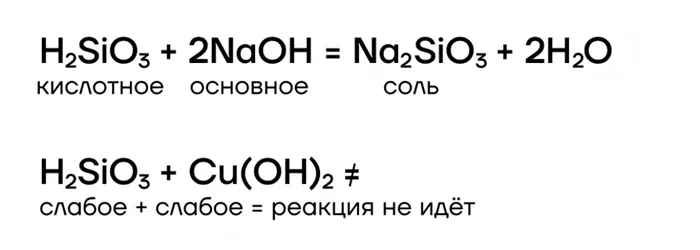
Кремниевая кислота нерастворима, но обладает кислотными свойствами, которые реагируют с сильными основаниями (щелочами): это кислотное свойство, которое реагирует с сильными основаниями (щелочами).
| А ещё силикаты различных металлов образуют красивые нитевидные кристаллы, которые используются в эксперименте « силикатный сад»! |
Силикаты, как и другие соли, являются электролитами и поэтому могут реагировать с другими электролитами, такими как соли, основания и кислоты.
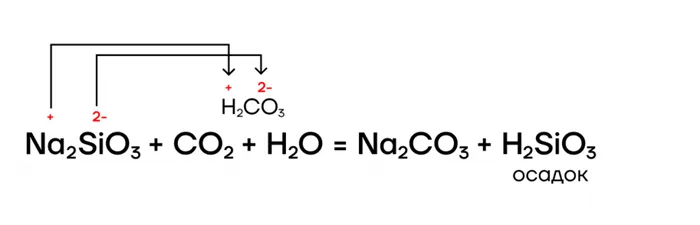
Кремниевая кислота, нерастворимый гидроксид, может разлагаться при нагревании в воде, соответствующие оксиды являются

Напишите уравнение реакции разложения гидроксида алюминия и рассчитайте теоретическую стехиометрию (x) и теоретическую массу полученного оксида алюминия.
Реакции со сложными веществами
Помимо простых веществ, кремний реагирует со сложными соединениями (кислотами и щелочами). Основные реакции перечислены в таблице.
Реагирует с плавиковой кислотой при нормальных условиях, соляной кислотой при 300°C и бромистым водородом при 500°C.
Кислотостойкий, покрыт оксидной пленкой. Реагирует только со смесями азотной и плавиковой кислот.
Растворяется в водных растворах, образует силикаты и водород
Кремний реагирует с углекислым газом при 1200°C с образованием монооксида углерода: Si + SiO2 OSiO.
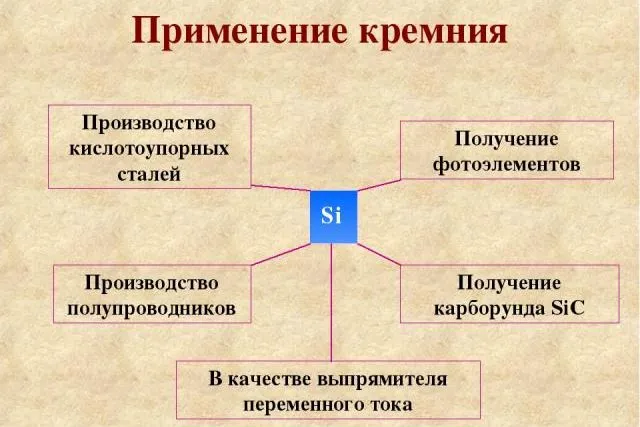
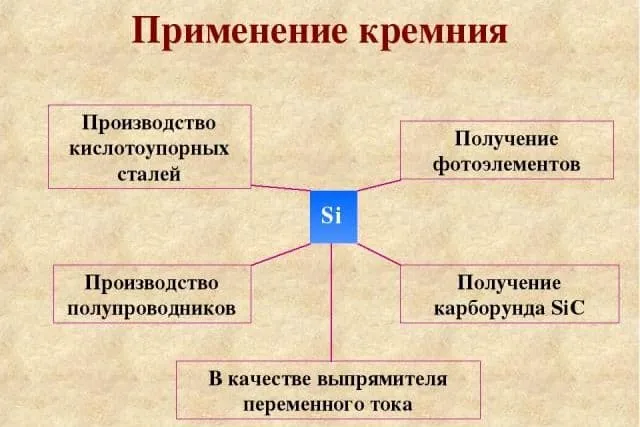
Рисунок 3.Применение кремния.
Символом кремния является Д.И. Менделеев, атомный номер 14.Si (силициум).
Понятие о выходе продукта химической реакции
На практике в результате химических реакций обычно образуется несколько меньше продуктов, чем можно рассчитать теоретически по уравнениям реакций. Это может произойти по ряду причин.
Многие химические реакции обратимы. То есть, они не завершены. Потеря вещества может быть вызвана испарением, частичным растворением (вещество не является полностью нерастворимым), испарением раствора или потерей инфильтрата. Оборудование, в котором проводятся химические реакции, также имеет большое значение. Утечки в оборудовании, где происходят химические процессы, всегда приводят к потере газа. Наконец, некоторые вещества могут не вступать в реакцию или образовываться путем генерации в процессе взаимодействия.
Термин производительность продукта химической реакции используется для оценки целостности процесса. Он аналогичен термину «коэффициент полезного действия», используемому в физике для характеристики преобразования и использования энергии, а также работы и механизмов различных двигателей.
Выход продукта химической реакции обозначается буквой греческого алфавита η ( эта ). Он представляет собой величину, равную отношению реально полученной, т. е. практической массы вещества теоретической массе
Характеристики продукта химической реакции — это размер без размеров. (CAO) = 0,75 или 75%.
Поскольку масса вещества пропорциональна его химической массе, работу продукта реакции можно также определить как отношение соответствующих химических масс вещества или опухоли (для газов).
Например, в случае известной реакции синтеза аммиака
выход продукта составляет 0,75 (η = 0,75, или 75 %), то это означает, что из азота массой 28 г (объемом 22,4 дм 3, химическим количеством 1 моль) мы получим аммиак массой не 34 г (объемом 44,8 дм 3, химическим количеством 2 моль), а массой 34 г
Таким образом, производительность продукта реакции — это цена, равная отношению массы (химической массы, объема) фактически полученного вещества к массе (химической массе, объему) этого вещества, рассчитанной по его уравнению реакции.
Значение производительности продукта реакции не должно превышать 100%. Если показатель равен 100%, реакция считается количественной. В данном случае.
В дополнение к выражению «производительность продуктов химической реакции» часто используются более короткие формы терминов «производительность продукта», «производительность реакции» и «реакция протекает с производительностью 90%».
На практике часто необходимо рассчитать стехиометрию, массу или объем продукта реакции, чтобы определить производительность продукта реакции, если эта производительность отличается от 100%. Давайте рассмотрим типы вычислений, в которых используется эта концепция.
Тип 1. Дана масса (объем, стехиометрия) исходного вещества и продукта реакции. Необходимо определить производительность продукта реакции.
Определите работу продуктов реакции при прокаливании 52,02 г гидроксида алюминия.
Найдите молекулярную массу гидроксида и оксида алюминия.
2. найдите химический вес гидроксида алюминия и оксида алюминия.
Напишите уравнение реакции разложения гидроксида алюминия и рассчитайте теоретическую стехиометрию (x) и теоретическую массу полученного оксида алюминия.
Кристаллический кремний — это темно-серое вещество с металлическим блеском, большой твердостью, хрупкое и полупроводниковое. 1415°C; t° кипения. 2680°C.
Керамика
Из солей алюминия особое значение имеет белая каолиновая глина, которая является основой для фарфора и фаггини. Производство фарфора — очень древняя отрасль. Его родина — Китай. В России фарфор впервые появился в XVIIO веке. Виноградов. Помимо каолина, сырьем для фарфора и фагиани являются песок и вода. Смесь каолина, песка и воды подвергается детальному измельчению в сферической мельнице. Затем избыток воды отфильтровывается, а хорошо перемешанная пластичная масса направляется на формирование продукта. После форматирования продукт сушат и выпекают в туннельной печи непрерывного действия, где он сначала нагревается, обжигается и, наконец, охлаждается. Затем изделие подвергается дальнейшей обработке с декорированием стеклом и керамикой. После каждого этапа фарфор подвергается обжигу. Полученный фарфор белый, гладкий и блестящий. Они просвечиваются в тонких слоях. Глиняный материал пористый и не просвечивает.
Красная глина используется в производстве керамических колец для кирпича, черепицы, глиняной посуды, абсорбции различных химических заводов и головок промывочных башен. Его также запекают для смягчения воды и придания ей механической прочности.
Цемент. Бетон
Соединения кремния являются основой для производства цемента — связующего материала, необходимого для строительства. Сырьем, используемым для приготовления цемента, являются глина и известняк. Смесь обжигается в огромных ротационных печах, в которые постоянно подается сырье. После обжига при температуре 1200-1300° порошкообразная масса (клинкер) поступает из порта в другой конец печи. После измельчения клинкер превращается в цемент. Цемент состоит в основном из силикатов. Если цемент смешать с водой до образования вязкой массы и оставить на воздухе на некоторое время, вода вступает в реакцию с компонентами цемента, образуя кристаллические шкуры и другие твердые соединения, что приводит к затвердеванию («застыванию») цемента. Этот цемент уже не преобразуется в прежнее состояние, поэтому для использования его хранят вдали от воды. Цемент требует много времени для затвердевания, и для достижения истинной прочности ему требуется около месяца. Однако цемент бывает разного качества. Обычный цемент, который мы рассмотрели, называется силикатным или портландцементом. Алюминий, известняк и кремний используются для высокоскоростного бурения глиноземного цемента.
Цемент, смешанный с легким камнем или гравием, может быть использован для производства бетона — самостоятельного строительного материала. Щебень и гравий относятся к инертным материалам. Бетон очень прочен и может выдерживать большие нагрузки. Он водонепроницаем и ударопрочен. Он обладает очень низкой теплопроводностью и поэтому практически не теряет прочности при нагревании. Бетон используется в качестве гидротехнического сооружения для защитных реакторов, поскольку он морозоустойчив и ослабляет радиацию. Бетон используется для изготовления кирпичных котлов. Когда цемент смешивается с пенообразователем, пенобетон пронизан множеством клеток. Этот бетон является хорошим звукоизолятором и выделяет меньше тепла, чем обычный бетон.
Если бетон заполнен стальными каркасами, то получается железобетон. Каркас называется усиленным. Железобетон используется при строительстве блоков и панелей для зданий, труб, мостов, плит перекрытия и спальных вагонов.
Оксид кремния (IV) — твердое тугоплавкое вещество (температура плавления 1713°C), нерастворимое в воде. Высокая температура плавления этого вещества говорит о том, что оно имеет немолекулярную структуру.
Общее описание элемента
Кремний находится в четвертой группе и в третьей фазе таблицы Менделеева. Сердечник кремниевого человека имеет положительную нагрузку +14. Вокруг ядра движутся 14 отрицательно заряженных электронов.
Человек может перейти в стимулированное состояние за счет свободного уровня d. Таким образом, элемент имеет два положительных (+2 и +4) и одно отрицательное (-4) состояние окисления. Электронная конфигурация — 1S22S22P63S23P2.
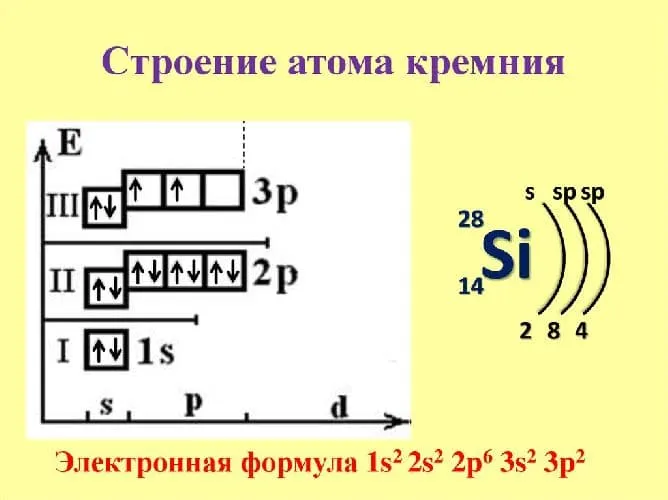
Рисунок 1. Человеческая структура кремния.
Кремний — хрупкий полупроводник с высокой температурой плавления и кипения. Это относительно легкий металл. Его плотность составляет 2,33 г/см3.
Чистый кремний не находится в чистом виде. Он входит в состав песка, кварца, агата, аметиста и других горных пород.

Реакции с неметаллами
Вступая в реакцию с неметаллами, кремний обладает восстановительными свойствами. Это означает, что он поставляет электроны. Реакция возможна только при сильном нагревании. В обычных условиях кремний реагирует только с фторидами. Реакции с основными неметаллами показаны в таблице.
Реагирует до 600°C с образованием диоксида (песок)
Реагирует при 2000°C с образованием углерода
Взаимодействует при 2000°C
Гидрид кремния — силан (SIH4) — может быть получен кислотно-кислотным разложением. Например, Mg2Si + 2H2SO4 → SIH4 + 2MGSO4.
Реакции со сложными веществами
Помимо простых веществ, кремний реагирует со сложными соединениями (кислотами и щелочами). Основные реакции перечислены в таблице.
Реагирует с плавиковой кислотой при нормальных условиях, соляной кислотой при 300°C и бромистым водородом при 500°C.
Кислотостойкий, покрыт оксидной пленкой. Реагирует только со смесями азотной и плавиковой кислот.
3SI + 4HNO3 + 18HF → 3H2SIF6 + 4NO + 8H2O
Растворяется в водных растворах, образует силикаты и водород
Si + 2KOH + H2O → K2SIO3 + H2
Кремний реагирует с диоксидом с образованием монооксида при 1200°C: Si + SiO2 → SiO