Метод молекулярных орбиталей (МО) более очевиден в графической модели линейной связи отдельных орбиталей (LCAO). Метод LCAO MO основан на следующих правилах
Статья на тему «Ковалентная связь»
Отметим, что в организациях, осуществляющих образовательную деятельность, в соответствии с Федеральным законом «Об образовании в Российской Федерации 273-ФЗ» обучение и воспитание обучающихся с ограниченными возможностями здоровья организуется как совместно с другими обучающимися, так и в отдельных классах или группах.
Химическая связь.
Химическая связь может быть определена как взаимодействие двух или более лиц с образованием химически стабильного многоатомного микроскопа (молекулы, кристалла, комплекса и т.д.).
Учение о связи является центральным для современной химии, потому что химия начинается там, где заканчивается человек и начинается молекула. По существу, все свойства материи определяются свойствами их связей. Основное отличие химических связей от других видов взаимодействий между индивидами заключается в том, что их образование определяется изменениями в электронном состоянии молекулы по сравнению с исходным индивидом. Теория связи должна дать ответы на ряд вопросов Почему образуются молекулы? Почему одни люди взаимодействуют, а другие нет? Почему люди объединяются друг с другом в определенных пропорциях? Почему люди расположены во вселенной определенным образом? Наконец, необходимо рассчитать энергию соединения, его длину и другие количественные характеристики.
В большинстве случаев электроны связанных людей связаны между собой. Этот тип химической связи называется ковалентной связью (латинская приставка для соединения «Co-«, «Valence» означает силу). Соединяющие электроны находятся в основном в пространстве между соединяемыми. Притяжение ядра атома к этим электронам создает химическую связь. Таким образом, ковалентные связи являются химическими связями и возникают благодаря повышенной плотности электронов в области между химически связанными индивидами.
Бесчисленные облигации.
Методы изучения ковалентных связей.
В настоящее время для изучения химических связей в основном используются два метода: 1) валентные связи — 2) молекулярные орбитали. 1.1. методы валентных связей.
Первый метод рассматривает взаимодействующие особи (8 правил) на основе принципа целостности электронной оболочки. Обобщение электронной пары приводит к образованию ковалентной связи методом валентной связи. На примере молекулярного водорода рассмотрим квантовомеханическую модель ковалентной связи по методу валентной связи. В 1927 году немецкие физики В. Хайтлер и Ф. Лондон решили уравнение Шредингера для молекулы водорода. Это была первая успешная попытка реализовать квантовую механику в проблеме коммуникации. Их работа заложила основы метода валентных связей или валентных систем.
Рис. 1 Фото. Ф. Лондон. Рис. 2.Фото. В. Гайтлер.
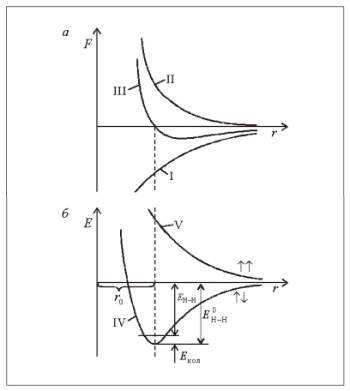
Результаты расчетов можно представить графически в виде зависимостей сил взаимодействия между атомами (рис. 3, а) и энергии системы (рис. 3, б) от расстояний между ядрами атомов водорода. Энергия системы — это расстояние между ядрами атома водорода и энергия системы. Ядро одного атома водорода располагается в начале координаты, ядро второго атома водорода приближается к ядру первого атома водорода вдоль оси расстояния. В случае противоположных электронных спинов силы притяжения (рис. 3, а, кривая I) и отталкивания (кривая II) возрастают. Результат действия этих сил представлен кривой III. Вначале преобладает притягательная сила, затем отталкивающая сила. Когда расстояние между ядрами равно r0 = 0,074 нм, притягивающая сила уравновешивается отталкивающей силой. Равновесие сил соответствует минимуму энергии системы (рис. 3, б, кривая IV) и, следовательно, наиболее устойчивому состоянию. Глубина «потенциального колодца» представляет собой энергию связи E0.H-H H.2 молекулы до абсолютного нуля. 458 кДж/моль. Однако при реальных температурах требуемая энергия E немного меньше.H-H что соответствует 435 кДж/моль при 298 К (25°C). Разница между этими энергиями при H2 колебательная энергия атома водорода (ECol. = E 0H-H -Å.H-H = 458-435 = 23 кДж/моль).
Свойства ковалентной связи.
Свойства ковалентных связей: энергия, длина, полярность, насыщенность, направленность, гибридизация, кратность.
2.1. длина химической связи.
Всякий раз, когда образуется химическая связь, происходит сближение атомов. Расстояние между ними меньше, чем сумма лучей изолированных атомов.
Ядерное расстояние между химически связанными атомами называется длиной химической связи.
Во многих случаях длину связи между атомами в молекуле вещества можно предсказать, зная расстояния между этими атомами в других химических веществах. Длина связи между атомами углерода в алмазе составляет 0,154 нм, а длина связи между атомами галогенов в молекуле хлора — 0,199 нм. Половина общего расстояния между атомами углерода и хлора, рассчитанного по этим данным, составляет 0,177 нм, что согласуется с экспериментально измеренной длиной связи в молекуле CCl.4. В то же время это не всегда так. Например, расстояния между атомами водорода и брома двух атомных молекул составляют 0,074 нм и 0,228 нм соответственно. Среднее арифметическое этих значений равно 151 нм, но фактическое расстояние между атомами молекулы водорода-брома составляет 141 нм, что гораздо короче.
Образование множественных связей значительно сокращает расстояние между людьми. Чем больше кратность связей, тем короче диатомовое расстояние.
Некоторые простые связи имеют несколько длин.
2.2 Действие соединения. Химические связи возникают только тогда, когда общая энергия взаимодействующих атомов уменьшается. Это означает, что во время образования связи должна постоянно выделяться энергия. Количество энергии, выделяемой при образовании химической связи, называется энергией связи E.CB (кДж/моль).
Энергия связи — это мера прочности связи. Чем больше энергии выделяется при образовании молекулы, тем больше энергии необходимо затратить для ее разрушения. Другими словами, молекула становится сильнее.
Соединения образуются только у отдельных людей, когда энергия представляет интерес. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов уменьшается, в противном случае она увеличивается. На определенных расстояниях (равных длине соединения r)0 ) эта энергия минимальна.
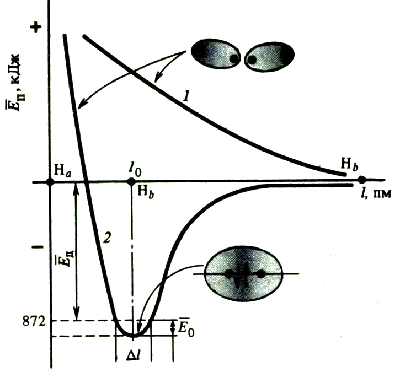
Рисунок 6.Энергии химических связей.
Таким образом, энергия высвобождается при образовании химических связей и поглощается при их разрушении. Энергия E0 необходимая для разделения атомов и отделения их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи. Для атомных молекул энергия связывания определяется как энергия расщепления молекулы внутри атома. Его можно измерить экспериментально. Для молекулярного водорода энергия связи численно равна энергии, выделяющейся при образовании H.2 атомом H: H + H = H2 +432 кДж. Чтобы разорвать связь H-H, необходимо выполнить то же действие: H2 = H +H — 432 кДж.
Для многих атомов эта величина условна и соответствует энергии процесса, при котором теряется одна конкретная химическая связь, а все остальные химические связи остаются неизменными. Если существует несколько одинаковых связей (например, в случае молекулы воды, содержащей две связи кислород-водород), их энергии могут быть рассчитаны с помощью закона Гесса. Действие разложения воды на простые вещества и водорода и кислорода на атомы известно: 2H2 O = 2H2 + а.2 ; 484 кДж/моль.
Получателем электронной пары является ион водорода или просто протон H+. Присоединение к молекуле, в которой центральный атом имеет неделимую электронную пару. NH3 Также образует комплексы NH.4 + ионный комплекс, но с положительным зарядом:.
Содержание
Ковалентные связи образуются за счет пар электронов, разделяемых между двумя атомами, и эти электроны должны занимать две фиксированные орбитали, по одной от каждого атома. 4
В результате смешивания электроны образуют полный энергетический уровень. Если полная энергия на этом уровне меньше, чем в исходном состоянии, образуется связь (а разница в энергии — это не что иное, как энергия связи).
Заполнение атомными (краевыми) и молекулярными (центральными) орбиталями электронов H2. Вертикальная ось соответствует уровню энергии. Электроны обозначены стрелками, отражающими их спин.
В простейшем случае перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей (МО). Связывающая МО и антисвязывающая (размыкающая) МО. Общий электрон находится в связи с наименьшей энергией MO.
Образование связи при рекомбинации атомов
Атомы и свободные радикалы склонны к рекомбинации — образованию ковалентных связей через пул из двух неспаренных электронов, принадлежащих разным частицам.
Образование связей при рекомбинации сопровождается выделением энергии. Таким образом, при взаимодействии атомов водорода выделяется 436 кДж/моль энергии. Это явление используется в механике сварки с атомами водорода. Поток водорода проходит через электрическую дугу, где образуется поток атомов водорода. Затем атомы вновь соединяются с поверхностью металла на небольшом расстоянии от дуги. Таким образом, металл может быть нагрет до температуры более 3500°C. Основным преимуществом «атомного водородного пламени» является равномерность нагрева, что позволяет сваривать очень тонкие металлические изделия. 5
Однако механизм взаимодействия диатомей долгое время оставался неясным. Только в 1930 году Ф. Лондон ввел понятие рассеянного притяжения. Это взаимодействие между мгновенным и индуцированным диполями. Сегодня притяжение, вызванное взаимодействием между левитирующими электрическими диполями атомов и молекул, известно как «сила Лондона».
Энергия этого взаимодействия прямо пропорциональна квадрату полярности электрона A и обратно пропорциональна расстоянию между двумя индивидами или молекулами шестой силы. 6
Образование связи по донорно-акцепторному механизму
В дополнение к гомогенному механизму ковалентной связи, описанному в предыдущем разделе, взаимодействие разнородно заряженных ионов — протона H+ и отрицательного иона водорода H-, называемого гидрид-ионом, — также имеет гетерогенный механизм.
По мере сближения ионов облако из двух электронов (пар электронов) гидрид-иона притягивается к протону, который в итоге становится общим в обоих водородных ядрах. Другими словами, они становятся парой связанных электронов. Частица, отдаваемая электронной парой, называется донором, а частица, принимаемая электронной парой, называется приемником. Этот механизм ковалентной связи называется донорно-рецепторной связью. 7
Поскольку распределение плотности электронов между ядрами в молекуле водорода одинаково независимо от механизма образования, неправильно называть химическую связь, возникающую по донорно-приемному механизму, донорно-приемной связью.
Виды ковалентной связи
Существует три типа ковалентных химических связей с различными механизмами образования, а именно
1. простые ковалентные связи. Для их формирования каждый человек предоставляет безошибочный электрон. Когда образуется простая ковалентная связь, нагрузка индивидуума остается неизменной.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью. Такую связь имеют простые вещества, например: О2, n2, кл.2. Однако могут образовываться как неметаллические, так и необычные неполярные связи. Бесчисленные неполярные связи также могут быть образованы неметаллическими элементами, электроны которых имеют одинаковое значение, например, в молекулах pH.3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществленной парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами, то такое соединение называется ковалентной полярной связью .
2. обязательства донора и реципиента. Для образования этого типа ковалентной связи оба электрона предоставляются одним из участников. Второй человек, участвующий в формировании связи, называется реципиентом. В полученной молекуле стандартная нагрузка донора увеличивается на единицу, а стандартная нагрузка реципиента уменьшается на единицу.
3. полусвязка. Может рассматриваться как полярная связь донорного рецептора. Этот тип ковалентной связи образуется между неподеленной парой электронов (например, азот, фосфор, сера, галоген) и человеком с двумя неподеленными электронами (кислород, сера). Формирование полусвязки происходит в два этапа.
1. передача электронов от человека с парой некомпетентных электронов к человеку с двумя некомпетентными электронами. В результате человек с однозначной парой электронов превращается в радикал-катион (положительно заряженная частица с однозначными электронами), а человек с двумя непонятными электронами — в радикал-анион (отрицательно заряженная частица с однозначными электронами). 2. обобщение некомпетентных электронов (как в случае простых ковалентных связей).
Когда образуется полуполитическая связь, человек с однозначной парой электронов увеличивает нагрузку на один, а человек с двумя однозначными электронами уменьшает нагрузку на один.
σ-связь и π-связь
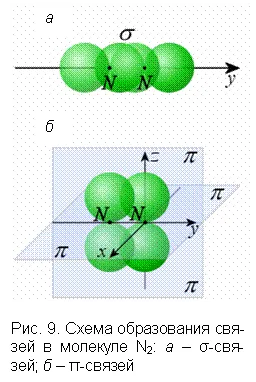
Сигма (σ)-, пи (π)-связи — приближенное описание видов ковалентных связей в молекулах различных соединений, σ-связь характеризуется тем, что плотность электронного облака максимальна вдоль оси, соединяющей ядра атомов. При образовании
В молекуле этилена С2н4 Имеется двойная связь ch.2= ch2, его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвертого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют
в линейной молекуле ацетилена.
Существует t-связь между атомом углерода и водородом, а также связь между двумя атомами углерода и две связи — между теми же атомами углерода. Есть две связи — поверх пули галстука на двух взаимных вертикальных уровнях.
Все шесть атомов углерода молекулы циркуляции бензола6h6Тот же уровень. Связи действуют между углеродами на уровне кольца — одинаковые связи существуют между каждым атомом углерода и атомом водорода. Каждый атом углерода занимает три электрона для создания этих связей. Четвертое облако электронов в атомном организме атома углерода находится в виде восьми штук, расположенных перпендикулярно уровню молекулы бензола. Каждое такое облако покрыто так же, как и облако электронов соседнего атома углерода. В молекуле бензола нет трех отдельных связей, а есть единая шестиэлектронная система, общая для всех атомов углерода. Связи между атомами углерода в молекуле бензола точно такие же.








