Атомы кислорода (а также атомы азота, фтора и неона) не имеют стимулированных состояний, поскольку на более высоких энергетических уровнях нет свободных орбиталей, на которые могут быть переданы электроны.
Кислород и его характеристики
Кислород — восьмой элемент периодической таблицы. Он обозначается латинским термином «кислород». Помещен в период 2. Он считается неметаллическим. Основная нагрузка составляет 8.
Кислород — самый распространенный элемент в земной коре. Он находится в свободном состоянии в окружающем воздухе и в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых сделаны растения и животные. Массовая доля кислорода в коре Земли составляет около 47%.
Как простое вещество, кислород представляет собой бесцветный газ без запаха. Он немного тяжелее воздуха. В нормальных условиях литр кислорода весит 1,43 г, а литр воздуха — 1,293 г. Кислород растворим в воде, но в небольших количествах, 100 объемов воды при 0 o c растворят 4,9, а при 20 o c -3,1 объема кислорода.
Атомная и молекулярная масса кислорода
Соответствующий атомный вес ar — Это человеческий молекулярный вес вещества, деленный на 1/12 молекулярного веса углерода-12 (12 c).
Относительная атомная масса атомарного кислорода составляет 15,999 а.е.м.
Соответствующая молекулярная масса mr — Это молекулярный вес молекулы, деленный на 1/12 молекулярного веса углерода-12 (12 c).
Известно, что молекулы кислорода являются двугранными, т.е. o2. Относительная молекулярная масса молекулы кислорода равна
Аллотропия и аллотропные модификации кислорода
Кислород может существовать в виде двух гомологичных модификаций — кислорода o2 и озон о3 (физические свойства кислорода объяснены выше).
При нормальных условиях озон представляет собой газ. Его можно отделить от кислорода сильным охлаждением. Озон концентрируется до синей жидкости, кипящей при температуре (-111,9 o c).
Растворимость озона в воде намного больше, чем растворимость кислорода: в 100 объемах воды при 0 °C растворится 49 озоновых опухолей.
Образование озона под действием кислорода может быть выражено уравнением.
Кислород — это невесомый металл, состоящий из групп меди и очень активный. Кислород как простое вещество представляет собой газ без цвета, запаха и вкуса и находится во влажном состоянии — голубая прозрачная жидкость и в твердом состоянии — голубые кристаллы. Он состоит из двух атомов кислорода (тип O₂).
Кислород
Кислород (лат. oxygen) — элемент группы через D.I. периода 2. Менделеев. Первым открывается группа меди, элемент группы.
Он бесцветен, не имеет запаха и на 21% состоит из воздуха.

Общие характеристики группы через элемент
Общее название элементов via o, s, se, te и po — медь. Медь (греч. copper — руда + genos — половой орган) входит в состав многих минералов. Например, кислород составляет 50% массы земной коры.
O к PO (к вершине периодической таблицы) Увеличивает: индивидуальные радиусы, металлы, основные и восстановительные свойства. Электроны, энергия ионизации, сродство к электрону уменьшается.
Среди элементов группы VIA, O, S и SE являются неметаллами. ТЭ и ПО — это металлы.
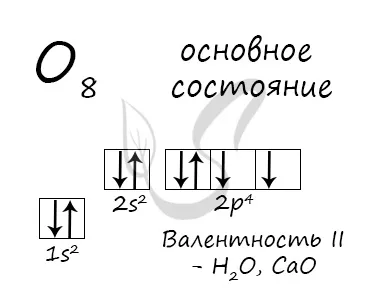
- O — 2s 2 2p 4
- S — 3s 2 3p 4
- Se — 4s 2 4p 4
- Te — 5s 2 5p 4
- Po — 6s 2 6p 4
Основные состояния атомов кислорода.
Атомы кислорода (а также атомы азота, фтора и неона) не имеют стимулированных состояний, поскольку на более высоких энергетических уровнях нет свободных орбиталей, на которые могут быть переданы электроны.
Атомы кислорода имеют два неспаренных электрона, максимальная сила II.
Ассоциация «Природа
- Воздух — в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Принято.
В промышленности кислород получают из жидкого воздуха. Также широко используются кислородные системы с мембранами, выполненными в виде фильтров для отделения кислорода (мембранная технология).
В лаборатории перманганат калия (марганцовка) или вертиго разлагается при нагревании с выделением кислорода. Используются каталитические реакции для разложения пероксида водорода.
В подводных лодках для получения кислорода используются следующие реакции

Химические свойства.
Он является самым активным неметаллом после фтора и образует бинарные соединения со всеми элементами, кроме гелия, неона и аргона. Реакция с кислородом чаще всего является экзотермической (горение) и ускоряется с повышением температуры.
Во всех реакциях, кроме взаимодействия с фтором, кислород выступает в качестве окислителя.
2C + O2 = (t)2CO (неполное окисление — монооксид углерода, соотношение 2:1)
C + O2 = (t)CO2 (полное окисление — углекислый газ, соотношение 1:1)
F + O2 →OF2 (Фторид кислорода, O +2)
Кислород реагирует с металлами с образованием оксидов, пероксидов и перекисей. Реакции с активными металлами происходят без нагревания.
Известны реакции горения воды и фтора.

Все органические вещества сгорают с образованием углекислого газа и воды.
Кислород используется в виде кислородных коктейлей, кислородных подушечек и т.д. для концентрирования дыхательных газовых смесей при респираторных заболеваниях и для лечения астмы.
Кислород как простое вещество
Кислород сам по себе существует в виде молекул. Молекулы кислорода состоят из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O.2.
Поскольку относительная атомная масса кислорода равна 16, относительная молекулярная масса простого вещества кислорода составляет
![]()
Таким образом, молекулярная масса кислорода составляет
![]()
Как и у всех газов, молекулярный объем кислорода при нормальных условиях составляет
![]()
Когда мы говорим о кислороде как об отдельном веществе, мы имеем в виду вещество с формулой O.2. Примеры: «Железные изделия быстро ржавеют в атмосфере жидкого кислорода»; «Кислород необходим для сжигания дров». В этих примерах речь идет о соединениях с формулой O.2.
История открытия кислорода
История открытия самого важного для человечества газа — долгая и запутанная. Об открытии кислорода впервые сообщил британский химик Дж. Пристли в 1774 году. Его получают путем нагревания вещества HgO. Однако в то время Дж. Пристли не знал, что получил новое газообразное вещество, и считал его разновидностью воздуха. Ранее, в 1772 году, К. Кислород был взят из сланца, но он опубликовал свой отчет только в 1777 году.
В 1774 году Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он немедленно приступил к экспериментам и уже в 1775 году представил в Академии наук выставку под названием «Меморандум о свойствах веществ, которые при сгорании соединяются с металлами и увеличивают их вес».
Происхождение названия «кислород» связано с образованием кислоты при растворении в воде некоторых композитных материалов, содержащих атомы этого элемента. А. Лавуазье считал, что кислород является необходимым компонентом всех кислот и что он «производит» кислоты. В 1779 году, чтобы прояснить этот момент, Лавуазье назвал газ «кислотообразующим», или сокращенно кислородом.
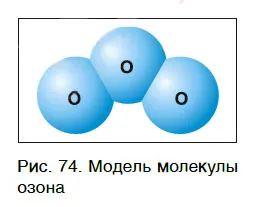
Помимо кислорода, существует еще одно единое вещество, молекулы которого состоят исключительно из атомов кислорода. Это озон — молекула, содержащая три атома кислорода (рис. 74), формула которой — O.3.
В обычных условиях озон представляет собой газ с сильным неприятным запахом. Его используют вместо хлора для дезинфекции воды, так как он очень токсичен для всех живых организмов.
Небольшое количество озона образуется в воздухе во время гроз и в результате взаимодействия смолы хвойных пород с кислородом. Озон оказывает противомикробное действие на бактерии, поэтому лесной воздух (особенно в хвойных лесах) обладает терапевтическим эффектом.
Небольшое количество озона также производится фотокопировальными машинами и лазерными принтерами. Эти устройства следует использовать только в хорошо проветриваемых помещениях.
Озоновый слой существует в верхних слоях атмосферы Земли (высота около 30-40 км). Озоновый слой содержит озон, который преобразуется из кислорода под воздействием солнечного излучения. Некоторые компоненты этого излучения вредны для жизни и растений на Земле и поглощаются озоновым слоем. Без озонового слоя жизнь на Земле постепенно прекратилась бы.
Многие ученые считают, что вещества, образующиеся в результате деятельности человека, разрушают озоновый слой. В основном это ХФУ (соединения, используемые в холодильных установках и дезодорантах) и выбросы от самолетов и ракет. Когда эти вещества попадают в озоновый слой, они могут истончить или даже растворить его. Образуется так называемая «озоновая дыра». В результате образования и расширения озоновой дыры могут произойти серьезные экологические катастрофы.
Кислород является компонентом многих органических веществ и присутствует во всех живых клетках. Она составляет примерно 25% от числа атомов и 65% от массовой доли живых клеток.
Биологическая роль кислорода
Кислород является основой жизни всех живых организмов на Земле и одним из основных биоэлементов. Он содержится в молекулах всех наиболее важных веществ (липидов, белков, углеводов и нуклеиновых кислот), участвующих в структуре и функционировании клеток. Все живые организмы содержат гораздо больше кислорода, чем любой другой элемент (до 70%). Например, в теле среднего взрослого человека весом 70 кг содержится 43 кг кислорода.
Кислород поступает в живые организмы (растения, животные и люди) через дыхательные пути и потребление воды. Если вспомнить, что самым важным дыхательным органом человеческого тела является кожа, то становится понятно, сколько кислорода может получить человек, особенно на берегу летних водоемов. Трудно определить, сколько кислорода необходимо человеку, поскольку это зависит от многих факторов, включая возраст, пол, вес, площадь поверхности тела, диету и внешнюю среду.
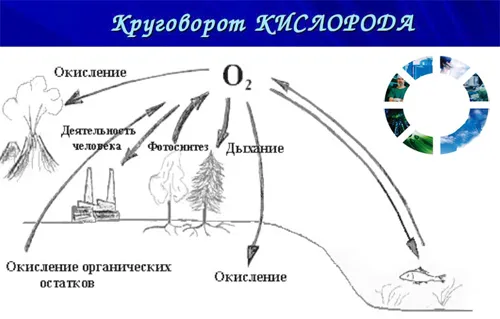
Применение кислорода в жизни
Кислород используется практически везде — от металлургии до производства ракетного топлива и взрывчатых веществ, используемых в проектах горных дорог, от медицины до пищевой промышленности.
В пищевой промышленности кислород зарегистрирован как пищевая добавка E941, как пропеллент и упаковочный газ.
Автор: Виктория Н. (специально для Calorizator.ru) Эта статья не может быть скопирована полностью или частично.
Перекись водорода — еще одно вещество, используемое для получения кислорода на школьных уроках химии. Даже 3%-ный раствор быстро разлагается под воздействием катализатора, выделяя чистый газ. Все, что вам нужно сделать, это собрать его. Катализатор тот же — оксид марганца MnO2.
Получение кислорода
1. промышленные методы — дистилляция жидкого воздуха и электролиз воды.
2. кислород получают в лаборатории: 1. щелочной раствор или кислородсодержащая соль (Na2 Итак.4 и т.д.).
2. путем термического разложения перманганата калия KMnO4 : 2KMnO4 = K2 MnO4 + MnO2 + O2 ↑,.
Белтритовая соль KClO3 : 2KClO3 = 2KCl + 3O2 ↑ (катализатор MnO)2 ).
Перекись бария BaO.2 : 2BaO2 = 2BaO + O2 ↑ (катализатор MnO)
3. разложение пероксида водорода: 2H2 O2 = H2 O + O2 ↑ (катализатор MnO)2 ).
4. разложение нитрата: 2KNO3 → 2KNO2 + O2
В космических кораблях и подводных лодках кислород производится из смеси K2 O2 и K2 O4 : 2K2 O4 + 2H2 O = 4KOH + 3O2 ↑4KOH + 2CO2 = 2K2 CO3 + 2H2 O
При использовании K2 O2 используется, общая реакция выглядит следующим образом: 2K2 O2 + 2CO2 = 2K2 CO3 + O2 ↑ (катализатор MnO)
Если вы хотите смешать K2 O2 и K2 O4 в равных (т.е. одинаковых молярных) количествах на моль CO2 поглощенное, молярное количество O2.2.
Химические свойства кислорода
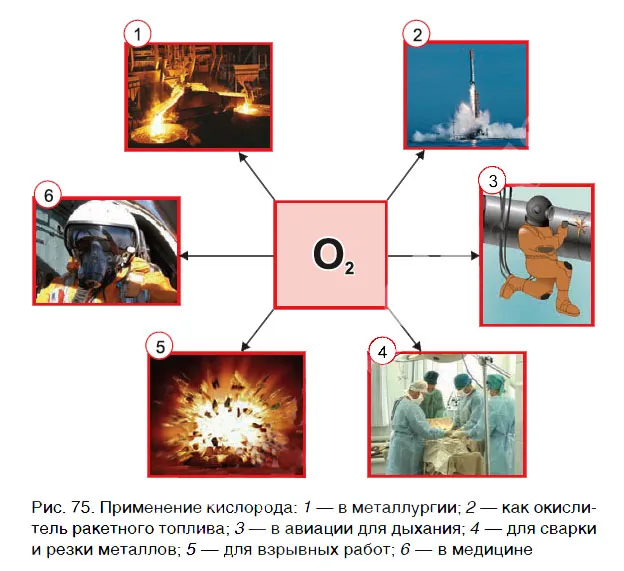
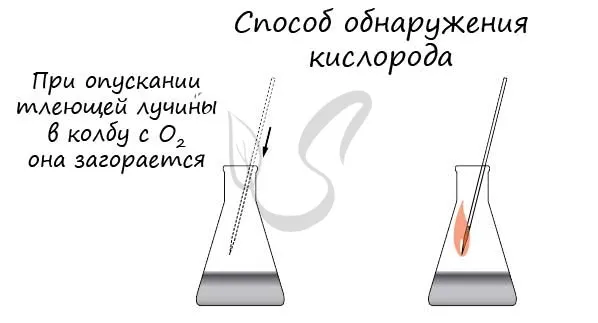
Кислород поддерживает горение. Горение — это быстрый процесс окисления вещества, сопровождающийся выделением большого количества тепла и света. Чтобы доказать, что в пробирке есть кислород и нет других газов, в пробирку нужно поместить лампу накаливания. В кислороде светящийся стержень ярко вспыхивает. Сгорание различных веществ в воздухе — это процесс окисления, в котором окислителем является кислород. Окислитель — это вещество, которое «отнимает» электроны у восстановителя. Отличные окислительные свойства кислорода легко объясняются структурой его внешней электронной оболочки.
Ядро кислорода находится на уровне 2 и относительно близко к атомному ядру. Поэтому ядро сильно притягивает к себе электроны. В валентной оболочке кислорода шесть электронов 2s22p 4. В результате кислороду не хватает двух электронов в октаэдре, и он склонен реагировать как окислитель, принимая электроны из электронных оболочек других элементов.

Кислород имеет вторую по величине электроотрицательность по шкале полинга (после фтора). Поэтому в большинстве соединений с другими элементами кислород имеет отрицательную степень окисления. Только соседние периодические фториды являются более сильными окислителями, чем кислород. Поэтому соединения кислорода и фтора являются единственными, в которых кислород имеет положительную степень окисления.
Поэтому кислород является вторым по силе окислителем среди всех элементов периодической таблицы. Это объясняет большинство его важных химических свойств. Все элементы, кроме Au, Pt, He, Ne и Ar, реагируют с кислородом, и кислород является окислителем во всех реакциях (за исключением его взаимодействия с фтором).
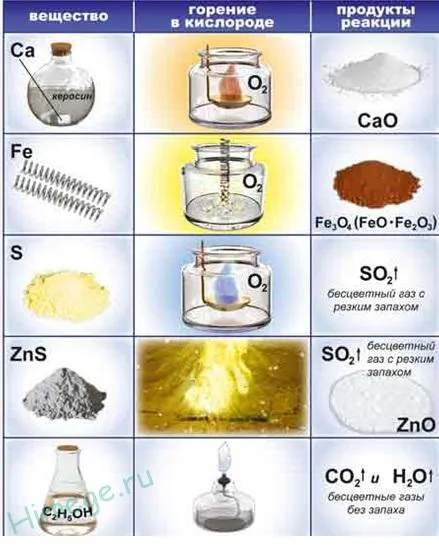
Кислород легко реагирует со щелочами и щелочными металлами: см. также.
Тонкий железный порошок (называемый самовоспламеняющимся железом) самовозгорается на воздухе и образует Fe2 O3 При предварительном нагреве стальная проволока сгорает в кислороде:.
При нагревании кислород реагирует с неметаллами (серой, графитом, водородом, фосфором и т.д.).
Почти все реакции с участием кислорода O2 За некоторыми исключениями, являются экзотермическими.
N2 + O2 → 2NO-Q
Эта реакция происходит при температурах или разрядах выше 1200°C.
Кислород может окислять сложные вещества.
2H2 S + 3O2 → 2SO2 + 2H2 O (избыточный кислород), и
2H2 S + O2 →2S + 2H2 O (дефицит кислорода),.
4NH3 + 5O2 → 4NO + 6H2 O (присутствие катализатора Pt),.
Кислород — самый распространенный элемент в земной коре. Он находится в свободном состоянии в окружающем воздухе и в связанном виде входит в состав воды, минералов, горных пород и всех веществ, из которых сделаны растения и животные. Массовая доля кислорода в коре Земли составляет около 47%.
Получение кислорода в промышленности
Из-за чрезвычайно высокого содержания кислорода в воздухе и воде (21% и 88% соответственно) основными промышленными методами получения состава являются фракционная перегонка жидкого воздуха и электролиз воды.
Первый метод особенно обширен. В конце концов, многие из этих газов можно извлечь из воздуха. Однако он не очень чистый. Если требуется высококачественный продукт, используются процессы электролиза. В качестве сырья используется либо вода, либо щелочь. Гидроксид натрия или гидроксид калия используется для повышения электропроводности раствора. В целом, суть процесса заключается в разделении воды.
Получение в лаборатории
Среди экспериментальных методов широко используются методы термической обработки.
При высоких температурах они разлагаются и выделяют газообразный кислород. Этот процесс в основном катализируется оксидом марганца (IV). Кислород собирается путем вытеснения воды и обнаруживается с помощью флуоресцентных стержней. Известно, что в кислородной атмосфере пламя горит очень сильно.
Перекись водорода — еще одно вещество, используемое для получения кислорода на школьных уроках химии. Даже 3%-ный раствор быстро разлагается под воздействием катализатора, выделяя чистый газ. Все, что вам нужно сделать, это собрать его. Катализатор тот же — оксид марганца MnO2.
Для описания процесса может быть задано уравнение. Кислород полностью высвобождается для лабораторных и исследовательских целей.
Существует гомологичная модификация кислорода. Этот тип соединения — O3 и называется озоном. Это газ, образующийся в природных условиях в результате воздействия ультрафиолетового излучения и молний на кислород в воздухе. В отличие от самого О2, озон имеет приятный свежий запах. Его можно почувствовать в воздухе после дождя при ударе молнии и грома.
Аллотропные модификации кислорода
Разница между кислородом и озоном заключается не только в количестве молекул, но и в структуре кристаллической решетки. С химической точки зрения, озон является еще одним мощным окислителем.
Жидкий кислород








