Суточная доза составляет примерно 900 мг, и в основном он поступает из мяса, рыбы и сои. Дефицит серосодержащего витамина B1 вызывает берибери, который может проявляться в виде тремора, нервной раздражительности, паралича нервов и даже сердечной недостаточности.
6. Химические свойства серы
При комнатной температуре сера реагирует только с ртутью. При повышении температуры его активность значительно возрастает. При нагревании сера вступает в прямую реакцию со многими простыми веществами, кроме благородных газов, азота, селена, теллура, золота, платины, иридия и йода. Азот и сульфид золота получают косвенным путем.
Взаимодействие с металлами.
Сера обладает окислительными свойствами, и в результате взаимодействия образуются сульфиды.
Взаимодействие с водородом происходит при 150-200°C:.
Взаимодействие с кислородом.
Сера сгорает в кислороде при 280°C и в воздухе при 360°C, образуя смесь оксидов.
Взаимодействие с фосфором и углеродом
Сера реагирует с фосфором и углеродом при нагревании без воздуха.
Взаимодействие с фтором.
Уменьшает присутствие серы в сильных окислителях:.
Взаимодействие с композитными материалами
При взаимодействии с композитными материалами сера действует как восстановитель.
Реакции диспропорционирования
Сера может вызывать реакции диспропорционирования, реагируя со щелочами с образованием сульфидов и сульфитов.
8. Сероводород
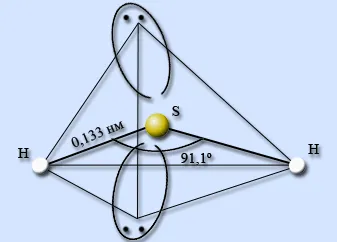
Водородным соединением серы является сероводород H 2 S. Сероводород является ковалентным соединением. Структура молекулы похожа на структуру молекул воды, атомы серы находятся в sp 3 гибридизации, но в отличие от воды, молекулы сероводорода не образуют водородных связей друг с другом. Атомы серы менее электроотрицательны и имеют больший размер, чем атомы кислорода, что приводит к меньшей плотности заряда. Активный угол HSH составляет 91,1°, а длина связи H-S — 0,133 нм.
Физические свойства
При нормальных условиях сероводород представляет собой бесцветный газ с сильным характерным запахом тухлых яиц. ТМел. = -86°C, TТемпература кипения. = -60°C, слабо растворим в воде, 2,58 мл H2S. Очень токсичен, вдыхание может вызвать паралич и смерть. В природе он выделяется в составе вулканических газов и образуется при разложении растительных и животных организмов. Он растворим в воде и при растворении выделяет слабый сероводород.
В водном растворе сероводород обладает свойством слабой двухвалентной кислоты: это слабокислотное вещество.
Сероводород горит на воздухе синим пламенем. При ограничении доступа воздуха образуется свободная сера.
При избыточном доступе воздуха при сгорании сероводорода образуются оксиды серы (IV).
Сероводород обладает восстановительными свойствами. В зависимости от условий, сероводород может быть окислен до серы, диоксида серы и серной кислоты в водном растворе.
Например, он обесцвечивает бромированную воду.
Взаимодействует с хлорированной водой:.
Поскольку при реакции выделяется большое количество тепла, для поджигания струи сероводорода можно использовать диоксид свинца.
Взаимодействие сероводорода с диоксидом серы используется для получения серы из дымовых газов металлургии и производства серной кислоты.
С этим процессом связано образование природной серы в вулканических процессах.
Когда диоксид серы и сероводород одновременно пропускают через щелочной раствор, образуются тиосульфаты.
Бог в основном добывается непосредственно в недрах путем естественного божественного плавления. Серные руды экспортируются по-разному, в зависимости от условий. Почти все серные месторождения сопровождаются накоплением токсичных газов — сернистых соединений. Кроме того, не следует игнорировать возможность самострела.
Какие вещества реагируют с серой
Бог является элементом группы D.I. периода 3. Менделеев. Это относится к группе через медь.
Sulphur-S — простое вещество ярко-желтого цвета. Они использовались еще до нашей эры как часть священных благовоний в религиозных церемониях.

Базовое и стимулированное состояние личности человека.
S- и P-электроны могут испаряться и переходить на D-уровень. Как всегда, число валентных электронов отражает число возможных связей в индивидууме.
При различных электронных конфигурациях сера может принимать следующие значения: II, IV и VI.
Природная ассоциация
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2s3 — Блеск сурьмы, би2s3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
Там, где наблюдается вулканическая активность, есть залежи природной серы.

В промышленности сера извлекается из природного газа, содержащего соединения серы: H2S, so.2.
Сера может попасть в организм при разложении кремния.
В лабораторных условиях серу можно проглотить, бросив два кислотных раствора — серную кислоту и гидролиз.
В воздухе сера окисляется, образуя диоксид серы, поэтому2. Он реагирует со многими неметаллами, но только с фтором без нагревания.

При нагревании бог энергично взаимодействует со многими металлами, образуя сульфиды.
При воздействии густых кислот (при длительном нагревании) сера окисляется с образованием диоксида серы или серной кислоты.
Бог реагирует со щелочами.
Бог реагирует с солями. Например, в кипящих растворах сера может реагировать с солями серы, образуя

Сульфид водорода — H2s
Бесцветный газ с характерным запахом тухлых яиц. Воспламеняемость. Используется в химической промышленности и в медицинских целях (гидратные ванны).
Гидротерий образуется в результате реакции сернистого алюминия с водой и взаимодействия серы с серой.

Водород хорошо растворим в воде и является слабой кислотой. Он реагирует с основными оксидами, основаниями и кислыми солями (на основе основания к кислоте).
KOH + H.2S = KHS + H2O (водородный калий, избыток кислоты).
Металл в порядке возрастания напряжения до того, как водород вытеснит водород из кислоты.
Феномен отчуждения обусловлен способом синтеза различных молекул простых веществ (синтез) или расположением индивидов или молекул в кристаллической решетке (форма формы).
Оксид серы (IV), диоксид серы, сернистый газ, сернистый ангидрид (SO2)
Методы получения диоксида серы.
- Взаимодействие концентрированной H2SO.4 с восстановителями, например с неактивными металлами:
Физические свойства диоксида серы.
При нормальных температурах SO2 — Сильный, бесцветный газ. Он достаточно растворим в воде — при 20°C, поскольку 1 литр воды растворяет 40 литров.2.
Химические свойства диоксида серы
SO.2 — Это типичный кислотный оксид. В промежуточном состоянии окисления (+4), SO2 Он может обладать свойствами как окислителя, так и восстановителя.
- При растворении в воде SO2 частично соединяется с молекулами воды с образованием слабой сернистой кислоты.
- Как кислотный оксид, SO2 вступает в реакции с щелочами и оксидами щелочных и щелочноземельных металлов:
- При взаимодействии с окислителями SO2 проявляет восстановительные свойства. При этом степень окисления серы повышается:
Обесцвечивание раствора перманганата калия KMNO4 Это качественная реакция для обнаружения диоксида серы и сульфат-ионов
- SO2 проявляет окислительные свойства при взаимодействии с сильными восстановителями, восстанавливаясь чаще всего до свободной серы:
Оксид серы (VI), триоксид серы, серный ангидрид (SO3)
Методы получения безводного сульфата
- SO3 Может быть взята из SO2 путем каталитического окисления последнего кислородом:
Физические свойства сернистого ангидрида
В нормальных условиях да3 Бесцветная жидкость с характерным пряным запахом. ВДВ, значит.3 «Он дымчатый и сильно впитывает влагу».
SO.3 — Он тяжелее воздуха и особенно растворим в воде.
Химические свойства сернистых ангидридов
Оксид серы (VI) является кислотным оксидом.
- Как кислотный оксид, SO 3 взаимодействует с щелочами и основными оксидами, образуются средние или кислые соли:
SO.3 + MGO → MGSO4 (путем слияния):.
- SO 3 проявляет сильные окислительные свойства, так как сера в находится в максимальной степени окисления (+6).
Реагирует с восстановителями:.
- При растворении в концентрированной серной кислоте образует олеум (раствор SO3 h2SO.4).
Сернистая кислота (H2SO.3)
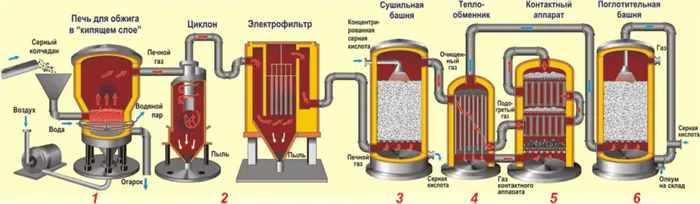
Как получают серную кислоту.
Когда он растворяется в воде, то2 образует слабую серную кислоту, которая частично разлагается.
Физические свойства серной кислоты
Серная кислота h2SO.3 — Кислородная двухосновная кислота. В нормальных условиях он нестабилен.
Сила серной кислоты — IV, степень окисления — +4.

Химические свойства серной кислоты
Общие свойства кислот.
- Сернистая кислота – слабая кислота, диссоциирует в две стадии. Образует два типа солей:
- кислые – гидросульфиты
В тяжелой промышленности сера является важным элементом стали. Он также используется в качестве нитрата серы в фейерверках и других взрывчатых веществах. В Грузии Бог убивает паразитов, таких как паутинные клещи и плесень.
Серный ангидрид и серная кислота
Бог ангидрит.3 — Это бесцветная жидкость, которая бурно реагирует с водой:.
Серная кислота h2SO.4 — Он является сильной кислотой и в концентрированном виде активно поглощает из воздуха (это свойство используется для осушения различных газов) и некоторых сложных веществ.

Кроме того, сильная окислительная среда, концентрированная серная кислота, окисляет оксид углерода: это мощная окислительная среда.
Поэтому концентрированная серная кислота вызывает сильные ожоги на коже и заряжается при контакте с тканью, бумагой и другими материалами.
Окисляющая среда (+6 — самая высокая степень окисления серы!) Концентрированная серная кислота реагирует почти со всеми металлами (кроме железа и драгоценных металлов) без выделения водорода.

Работа 15.7: Уравняйте эти цифры, используя метод электронного баланса. Определите, какой из них является окисляющим фактором в каждом случае.
Однако серная кислота и ее соли и сульфаты на самом деле не обладают окислительными свойствами (благодаря индивидуальной сере): они являются окисляющими факторами.

Работа 15.8: Определите, кто является окислителем в этой реакции.
Растворы серной кислоты обладают всеми свойствами сильных кислот.
Работа 15.9: Напишите уравнение, отражающее эти свойства. (Если у вас возникли трудности, см. урок 2.2).
Качественная реакция на это.4 2 — образование белых сосудов4 Он нерастворим в кислоте:.
Серная кислота имеет множество применений. Он используется в приготовлении моющих средств, лекарств, красителей, удобрений и других необходимых веществ.

Суточная доза составляет примерно 900 мг, и в основном он поступает из мяса, рыбы и сои. Дефицит серосодержащего витамина B1 вызывает берибери, который может проявляться в виде тремора, нервной раздражительности, паралича нервов и даже сердечной недостаточности.
Химические свойства и применение серы
Бог — это активный неметалл.
В химических реакциях он может быть окислительной и восстановительной средой.
Как окислитель, сера реагирует с металлами, водородом и некоторыми неметаллами.
При комнатной температуре сера реагирует со всеми щелочными и щелочноземельными металлами, ртутью, медью, серебром и сульфидами.

Эта реакция используется в лабораториях для удаления ртути из разливов, где пары очень токсичны.
На щели, куда могла попасть ртуть, посыпают серную пыль.
Сера реагирует не только с серебром, но и с водородом, присутствующим в воздухе, образуя черные серебристо-серные отложения.


С химической точки зрения окислителем в этой реакции является не сера, а кислород.
Пот человека содержит небольшое количество водорода (продукт серосодержащих белков).
Поэтому серебряные украшения со временем дубеют.
Сера реагирует с большинством металлов и водородом при нагревании.
Сера является окислительной средой, связанной с углеродом и фосфором, с некоторой степенью окисления -2, и уменьшает среду, связанную с фтором, кислородом и хлором, с окислением +4 и +6.
Многие сернистые соединения неметаллов токсичны.
Фторид.6,. Это называется разрушением серы и представляет собой тяжелый газ без запаха и цвета, почти не токсичный из-за своей высокой химической стойкости.
Он интересен тем, что используется для демонстрации смещения легких газов и воздействия тяжелых газов на голосовые связки. Эффекты после вдыхания серы противоположны эффектам после вдыхания солнца.
Сера широко используется и как простое вещество, и как соединение (в основном в виде серной кислоты).
Основная сера используется в строительстве.
В медицине как внешний фактор в мазях (об этом уже говорилось ранее).
В защите растений сжигание серы используется в качестве удобрения для сельскохозяйственных культур: токсичные оксиды серы (IV)2 Уничтожает грибки и паразитов
В производстве бетона, пищевых красителей и серной кислоты.
Сера используется в производстве каучука — она образуется, когда каучук вступает в реакцию с серой.
Во время этой реакции длинные полимерные цепи каучука соединяются между собой разводными мостиками.
Этот процесс известен как вулканизация.

Кроме того, сера является важным химическим элементом.
Он является компонентом белков и основной составной частью клеток растительных и животных организмов.
Замечено, что при недостатке серы в организме кости становятся хрупкими и уязвимыми, наблюдается выпадение волос.
В продуктах питания серы много в бобовых (горох, чечевица), овсяных хлопьях и яйцах. Все продукты, содержащие много белка.
Сероводород
Бог реагирует с водородом с образованием летучего соединения водорода h2S.
Он представляет собой бесцветный газ и пахнет тухлыми яйцами.
Точнее, тухлые яйца пахнут водородом, потому что он образуется при расщеплении белков.

Слегка растворим в воде: 2,5-кратный объем водорода растворим в большом количестве воды при комнатной температуре.
Большое количество водорода присутствует в вулканических газах, его очень много в воде многих металлических источников и в морской воде всего мира, особенно в Черном море на глубине 150 метров.
В этой части урока есть больше информации!

Черное море названо так потому, что во время грозы его воды становятся очень черными.
Это явление объясняется высокой концентрацией воды и сульфидов в воде.

В лаборатории сероводород собирают под действием сероводорода.
Гидротеио является активным восстановителем во всех реакциях, так как индивидуальная окисляемость низкая (-2).
Он легко горит: на воздухе с образованием серы и воды.

В чистом кислороде сероводород превращается в оксид серы (IV), потому что2 .

При растворении в воде сероводород растворим, поэтому такие растворы обладают кислотными свойствами.
В больших количествах сероводород токсичен — он разрушает гемоглобин.
Однако минеральные источники, содержащие воду, уже давно используются в медицине в виде сероводородных ванн для лечения ревматизма и кожных заболеваний.

Большинство природных минералов серы являются сульфидами.
Они используются для производства серы, а также для плавки металлов.
Войдя в систему или зарегистрировавшись, вы можете пройти тестирование и получить свой результат.
Серная кислота
Серная кислота h2Итак. 4 — Это важный ресурс для химической промышленности и ее продукции.

Серная кислота уже активно использовалась алхимиками в качестве «масла пумы».
Серная кислота из-за сульфата тяжелых металлов издавна называлась купоросом.
И нефть, потому что это чистая серная кислота:.
- тяжелая (в 2 раза тяжелее воды) маслянистая жидкость
- без запаха
- не летучая
- гигроскопичная (быстро поглощает пары воды из воздуха)
Его можно смешивать с водой в любом соотношении, при смешивании выделяется большое количество тепла.
Например, если вы нальете небольшое количество воды в концентрированную серную кислоту, выделяемого тепла будет достаточно, чтобы вскипятить ее, и вы сможете сразу же распылить кислоту в воду.

Поэтому при разбавлении серной кислоты добавляйте кислоту только к небольшому количеству воды, постоянно помешивая, а не добавляйте воду к кислоте.
Помните об этом, если вам нужно разбавить электролит для аккумулятора.
Серная кислота образуется, когда оксиды серы (VI) реагируют с водой.
![]()
Оксид серы (VI) SO3 -бесцветная летучая жидкость, которая превращается в прозрачные хлопья при температуре ниже 17°C и закипает при 44°C.
Это типичный кислотный оксид, обладающий всеми свойствами кислотных оксидов и реагирующий с основными и амфотерными оксидами и основаниями с образованием сульфатов (сульфатов).
Свойства разбавленной и концентрированной серной кислоты различны.
Серная кислота является окислителем, так как сера имеет максимальную степень окисления +6.
Однако его окисляющие свойства проявляются только в концентрированном виде.
Разбавленная серная кислота является сильной кислотой. Он растворяет большинство металлов, выделяя водород, и реагирует с основными и амфотерными оксидами и основаниями с образованием сульфатов.
Концентрированная серная кислота является окислителем, растворяя больше металлов, чем разбавленная серная кислота, и образуя оксид серы (IV) SO2 сера, сера S или сероводород H2S (чем активнее металл, тем ниже степень окисления серы в продукте реакции).
Однако концентрированная серная кислота также реагирует с неметаллами (серой, фосфором и углеродом), окисляя их до оксидов или кислот.
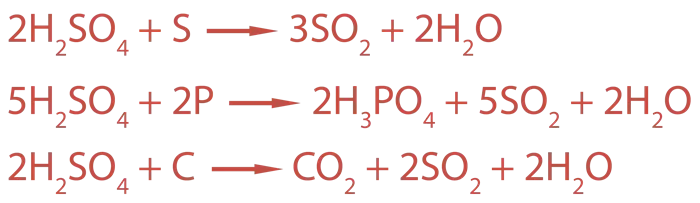
Концентрированная серная кислота гигроскопична и поглощает водяной пар, поэтому ее используют в качестве сушильного агента.
Газы, которые не реагируют с ним, пропускают через пробирку, содержащую концентрированную серную кислоту, для высушивания.
Этот метод подходит для сушки двуокиси углерода CO2, хлористый водород HCl, хлор Cl2 и водорода H2 .








