Например, гидроксидные комплексы разлагаются под воздействием избытка углекислого газа. В этом случае он вступает в реакцию с CO2 NaOH и вступает в реакцию с образованием кислых солей (в избытке CO2), амфотерный гидроксид алюминия не реагирует с углекислым газом и просто выпадает в осадок.
Все химические свойства алюминия
Алюминий является амфотерным металлом. Электронная конфигурация атома алюминия — 1s22s 2 2p 6 3s 23p1. Таким образом, во внешней электронной оболочке имеется три валентных электрона — два в плоскости 3s и один в плоскости 3p. Благодаря своей структуре, он вступает в реакцию, в результате которой атом алюминия теряет три электрона с внешней размерной границы и приобретает состояние окисления +3. Алюминий обладает высокой реакционной способностью и очень сильными восстановительными свойствами.
с кислородом
Когда чистый алюминий вступает в контакт с воздухом, атомы алюминия в его поверхностном слое немедленно реагируют с атмосферным кислородом, образуя очень тонкую оксидную пленку толщиной в несколько десятков слоев, состоящую из Al2O3защищая алюминий от дальнейшего окисления. Кроме того, даже при очень высоких температурах большое количество алюминиевых образцов не окисляется. Однако мелкий алюминиевый порошок очень легко сгорает в пламени горелки.
с галогенами
Алюминий очень активно реагирует со всеми галогенами. Таким образом, реакция между смешанным порошком алюминия и йода происходит уже при комнатной температуре после добавления капли воды в качестве катализатора. Уравнение взаимодействия йода с алюминием:.
С бромом, который представляет собой темно-коричневую жидкость, алюминий также реагирует без нагревания. Просто добавьте образец алюминия в жидкий бром. Интенсивная реакция начинается сразу после выделения большого количества тепла и света.
Алюминиево-хлорная реакция происходит, когда нагретая алюминиевая фольга или мелкодисперсный алюминиевый порошок добавляются в бутылку, наполненную хлором. Алюминий эффективно сгорает в хлоре в соответствии со следующей формулой
с серой
При нагревании до 150-200°C или после поджигания смеси алюминиевой пудры и серы начинается интенсивная экзотермическая реакция, в результате которой между ними выделяется свет.
-Сульфид алюминия.
с азотом
Когда алюминий реагирует с азотом при температуре около 800°C, образуется нитрид алюминия.
с углеродом
При температуре около 2000°C алюминий реагирует с углеродом, образуя карбид алюминия (метанид). Он содержит углерод и метан со степенью окисления -4.
Взаимодействие алюминия со сложными веществами
с водой
Как описано выше, стабильная и прочная пленка оксида алюминия2O3 предотвращает окисление алюминия на воздухе. Эта оксидная защитная пленка также делает алюминий инертным к воде. Когда оксидная защитная пленка удаляется с поверхности путем обработки водным раствором щелочи, хлорида аммония или солей ртути (амальгама), алюминий энергично реагирует с водой с образованием гидроксида алюминия и газообразного водорода.
с оксидами металлов
После воспламенения смеси алюминия и оксидов менее активных металлов (справа от алюминия в активной последовательности) начинается очень интенсивная, высокоэкзотермическая реакция. Так, в случае взаимодействия алюминия с оксидом железа (III) возникают температуры 2500-3000oC. В результате этой реакции образуется расплавленное железо высокой чистоты.
Этот метод получения металла из оксида путем восстановления алюминием называется алюминотермией или алюмотермией.
с кислотами-неокислителями
Взаимодействие алюминия с неокисляющими кислотами, т.е. почти со всеми кислотами, кроме плотной сульфатной и азотной, приводит к образованию соответствующей кислоты и газообразного водорода — соли алюминия.
с кислотами-окислителями
-концентрированной серной кислотой
Взаимодействие алюминия с густой серной кислотой в нормальных условиях и при низких температурах не связано с явлением, известным как пассивность. При нагревании реакция становится возможной и приводит к образованию алюминия, воды и сероводорода, образующегося в результате восстановления серы, которая входит в состав серной кислоты.
Глубокое восстановление серы с некоторым окислением +6.2SO.4) состояние окисления -2 (hin2s), из-за очень высокой восстановительной способности алюминия.
— концентрированной азотной кислотой
Концентрированная азотная кислота также проходит через алюминий при нормальных условиях, что позволяет хранить ее в алюминиевых резервуарах. Как и в случае с густой серной кислотой, реакция происходит преимущественно потому, что взаимодействие азотной кислоты с алюминием становится сильнее при сильном нагревании.
— разбавленной азотной кислотой
Взаимодействие с алюминием и разбавление по сравнению с густой азотной кислотой приводит к получению более глубокого продукта восстановления азота. Вместо нет, в зависимости от разбавления, n2O и NH4Нет.3:.
со щелочами
Алюминий реагирует с обоими водными растворами щелочей.
Чисто щелочные, а также плавленые:.
В обоих случаях реакция начинается с растворения защитной пленки оксида алюминия.
В случае водных растворов алюминий, лишенный защитного покрытия из оксида алюминия, начинает реагировать с водой в соответствии с уравнением.
Гидроксид алюминия, имеющий сродство к воде, реагирует с растворимыми в воде растворами гидроксида натрия с образованием растворимого тетрагидроксифосфата натрия.
Алюминий — реакционноспособный металл, но прочные оксидные пленки определяют его прочность в нормальных условиях. Почти во всех химических реакциях алюминий обладает восстановительными свойствами.
История открытия алюминия
Издавна люди знали о связи этого металла — выпускников глины. Он использовался как средство для набухания и связывания компонентов смеси и был незаменим при производстве изделий из кожи. О существовании чистого оксида алюминия стало известно во второй половине 18 века. В данном случае, однако, не было чистой субстанции.
Ученый Х. К. Эрстед был первым, кто смог выделить металл из хлорида. Именно он обработал соль амальгамой калия и экспортировал серый порошок из смеси. Это был алюминий в чистом виде.
Затем стало ясно, что химические свойства алюминия проявляются в его высокой активности, сильной восстановительной способности. Именно поэтому с ним уже давно никто не работает.

Однако в 1854 году французские черти смогли получить металлические стержни путем электролиза расплава. Этот метод актуален и сегодня. Производство этого ценного материала получило особенно широкое распространение в 20 веке, когда была решена проблема производства большого количества электроэнергии на заводах.
Сегодня металл является одним из самых популярных и широко используемых в строительстве и быту.
Например, гидроксидные комплексы разлагаются под воздействием избытка углекислого газа. В этом случае он вступает в реакцию с CO2 NaOH и вступает в реакцию с образованием кислых солей (в избытке CO2), амфотерный гидроксид алюминия не реагирует с углекислым газом и просто выпадает в осадок.
Алюминий
Алюминий — самый распространенный металл в земной коре. Свойства алюминия позволяют активно использовать его в стальных конструкциях. Он легкий, мягкий, фальсифицируемый и обладает высокой коррозионной стойкостью.
Алюминий характеризуется высокой химической активностью и обладает высокой электро- и теплопроводностью.

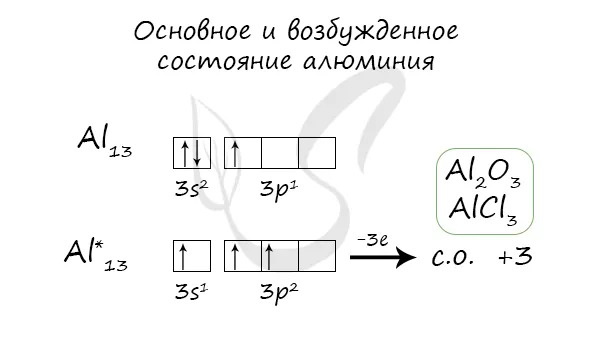
Основные и стимулирующие ситуации
Когда алюминий входит в стимулированное состояние, два электрона S-субстрата испаряются, а электроны переносятся на P-субстрат.
Природная ассоциация
- Al2O3 — корунд
- 3BeO*Al2O3*6sio2 -Berylli (предметы Aquamarin -Fe и Emerald -CR)2O3)
- Al2O3*6sio -Cr2O3 — красный рубин
- Al2O3 с примесью Fe +2 /Fe +3 /Ti
- Al2O3*h2O — боксит

Производство
Алюминий производится путем электролиза расплавленного алюминия2O3 криолит (на3альф.6). Галлий, индий и концентраты производятся аналогичным образом путем электролиза оксидов и солей.
Химические свойства.
Он реагирует с галогенами (кроме фторида) и кислородом при комнатной температуре с образованием оксидных пленок.
AL + B2 → ALB3 (бром-алюминий-алюминий).
При нагревании алюминий вступает в реакцию с фтором, серой, азотом и углеродом.
аль + ф2 → (t)alf3 (фторид алюминия)
Al + S → (t)al2s3 (сульфид алюминия)
Al + n2 → (t)aln (нитрид алюминия)
Al + c → (t)al4c3 (карбид алюминия)

Алюминий является амфибией (от греческого — двойной) и реагирует как с кислотами, так и с основаниями.
al + naoh + h2o → naal (ah)4 + h2↑ (тетрагидроксианемин натрия — если алюминий чистый, выделяется водород).
Во время тугоплавкости, по мере испарения воды, комплексная соль не образуется — вместо нее (при использовании) образуется средняя соль — соль алюминия (академическая — сложный оксид).
При комнатной температуре из-за образования оксидной пленки не образуется — al2O3 — В воздухе. Реакция продолжается, когда оксидная пленка разрушается при нагревании щелочного раствора или при амальгамировании (покрытии металла слоем ртути).

Алюминий (лат. aluminium + греч. thermae — тепло) — металлический и неметаллический способ производства, включающий восстановление оксидов алюминием. Процесс может достигать температуры до 2400°C.
Алюминиевый театр, FE, CR, MN, CA, TI, V, W.

Оксид алюминия.
Оксид алюминия образуется в результате реакции с кислородом — алюминий на воздухе покрывается оксидной пленкой. При нагревании алюминий как нерастворимое основание легко разлагается на оксиды и воду.
Эта особенность металла придает ему высокую коррозионную стойкость. Это свойство алюминия, наряду с другими характеристиками, делает его очень популярным металлом, широко используемым в повседневной жизни. Кроме того, алюминий имеет небольшой вес, но при этом сохраняет высокую прочность и дуракоустойчивость.
Алюминий и вода
Алюминий реагирует с водой в следующих реакциях2: 1.
В результате этих реакций образуются следующие соединения алюминия.
- модификация гидроксида алюминия байерит и водород (1)
- модификация гидроксида алюминия богемит и водород (2)
- оксид алюминия и водород (3)
По совпадению, эти реакции представляют большой интерес для разработки компактных водородных установок для водородных2 автомобилей.
Все эти реакции термодинамически прочны при температурах от комнатной до температуры плавления алюминия 660ºC. Они также способны к экзотермии. Это означает, что они возникают при выделении тепла 2.
- При температуре от комнатной до 280 ºС наиболее устойчивым продуктом реакции является Al(OH)3.
- При температуре от 280 до 480 ºС наиболее устойчивым продуктом реакции является AlO(OH).
- При температуре выше 480 ºС наиболее устойчивым продуктом реакции является Al2O3.
Поэтому оксид алюминия2O3 Термодинамически более стабилен, чем AL(OH)3 при повышении температуры. Продуктом реакции алюминия с водой при комнатной температуре является гидроксид алюминия AL(OH)3.
Реакция (1) показывает, что алюминий должен самопроизвольно реагировать с водой при комнатной температуре. Однако на практике некоторые виды алюминия, погруженные в воду, не реагируют с водой при комнатной температуре или в кипящей воде. Причина этого заключается в том, что алюминий имеет тонкий когерентный слой оксида алюминия на поверхности al2O3. Этот оксидный слой прочно удерживается на поверхности алюминия и не дает ему вступать в реакцию с водой. Поэтому для инициирования и поддержания реакции алюминия с водой при комнатной температуре этот слой оксида должен быть удален или окончательно разрушен.
Алюминий и галогены
Алюминий бурно реагирует со всеми галогенами.
Слои соответственно:.
Реакция водорода с фтором, хлором, бромом и йодом:.
Алюминий сильно реагирует с: серной кислотой, соляной кислотой, азотной кислотой, образуя соответствующие соли: сернокислый алюминий: сернокислый алюминий, азотная кислота: сернокислый алюминий.2SO.4Сульфат алюминия Al -SO, хлорид алюминия Alcl3 и нитрат алюминия (нет.3)3.
Реакция алюминия с разреженными кислотами:.
Не реагирует с плотными сульфатами и соляной кислотой при комнатной температуре. При нагревании вступает в реакцию с образованием солей, оксидов и воды.
Для полноты картины приводится список основных реакций, связанных с алюминием, приведенный в основной книге «Алюминий 3».

Наиболее важные реакции, связанные с алюминием 3.
1. химические вещества. Первые 118 элементов, отсортированные по алфавиту /ed.Wikipedians -2018
2. реакция алюминия с водой для получения водорода /Джон Петрович и Джордж Томас, Министерство энергетики США, 2008 г.
3. 13-й элемент: Энциклопедия / А. Дроздов -Русская библиотека, 2007.
Гидроксид алюминия также образуется при взаимодействии растворимых солей алюминия с растворимыми карбонатами, серой и сульфидами. Сульфиды, карбонаты и сульфид алюминия необратимо гидролизуются в водном растворе.
Алюминий и его химические свойства

Фото кредиты.
С точки зрения химических реакций, чистый алюминий является сильным восстановителем и особенно активен в свободной форме. Для многократного увеличения активности необходимо удалить оксидную пленку. Алюминий может реагировать с серой, галогенами, кислотами и щелочами. В нормальных условиях этот металл не вступает в реакцию с водой. Без нагревания он может реагировать только с хлором, бромом, йодом и 3 лошадьми. Важной химической особенностью алюминия является его способность восстанавливать другие элементы и их соединения.
В какие реакции вступает алюминий
Взаимодействие с неметаллами: алюминий реагирует с углеродом, серой, азотом и другими неметаллами (многие не реагируют только после нагревания). Реакции выделяют много тепла.
Взаимодействие кислот (например, соляной кислоты): выделяется водород.
Оксидные взаимодействия: реакция замещения атомов металла на оксид алюминия приводит к выделению большого количества тепла и получению нового металла в свободной форме.
Солевые взаимодействия, т.е. растворы определенных активных солей.
Взаимодействие со щелочами: из-за сильного взаимодействия с растворами щелочей, их перерывы не следует хранить в алюминиевых контейнерах.
Плавка алюминия — это процесс восстановления металлов, сплавов и неметаллов путем обработки оксидов металлическим алюминием. Это свойство алюминия позволяет металлургам извлекать из него такие тугоплавкие вещества, как молибден, вольфрам, цирконий и ванадий.
Физические свойства алюминия как простого вещества
Как простое вещество, алюминий является серебристым металлом. Он может окисляться на воздухе и покрывается плотной оксидной пленкой.
Эта особенность металла придает ему высокую коррозионную стойкость. Это свойство алюминия, наряду с другими характеристиками, делает его очень популярным металлом, широко используемым в повседневной жизни. Кроме того, алюминий имеет небольшой вес, но при этом сохраняет высокую прочность и дуракоустойчивость.
Не все вещества обладают комбинацией этих свойств, известных человеку.
Качественной реакцией на ионы алюминия является взаимодействие избытка солей алюминия со щелочами. В результате образуется белый аморфный осадок гидроксида алюминия.
Строение атома
Алюминий — 13-й элемент в периодической таблице. Это период III, группа III, главная подгруппа.
Свойства и применение алюминия связаны с его электронной структурой. Алюминий имеет положительно заряженное ядро (+13) и 13 отрицательно заряженных электронов, расположенных на трех энергетических уровнях. Электронная конфигурация человека — 1S 2 2S 2P 6 3S 2 3P 1.
На внешнем энергетическом уровне есть три электрона, которые определяют фиксированный Барретт III. В реакции с веществом алюминий может стимулироваться, отдавая все три электрона для образования ковалентной связи. Как и другие активные металлы, алюминий является сильным восстановителем.
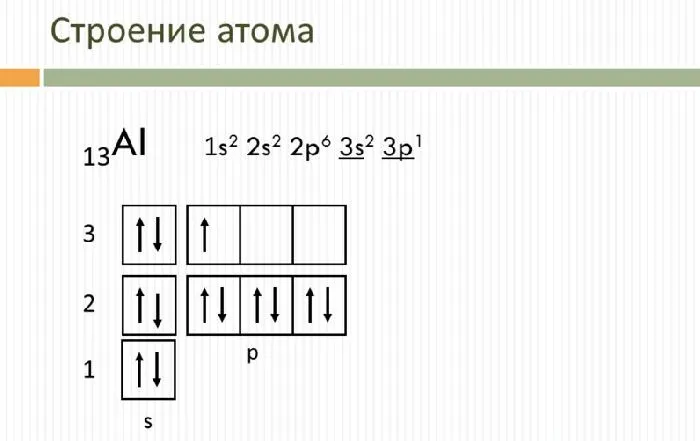
Рисунок 1.Структура алюминиевых лиц.
Алюминий является амфотерным металлом, образующим амфотерные оксиды и гидроксиды. В зависимости от условий, соединения обладают кислотными или основными свойствами.
Физическое описание
- лёгкостью (плотность 2,7 г/см 3 );
- серебристо-серым цветом;
- высокой электропроводностью;
- ковкостью;
- пластичностью;
- температурой плавления – 658°C;
- температурой кипения – 2518,8°C.
Этот металл используется для изготовления оловянных контейнеров, фольги, проволоки и сплавов. Алюминий используется в производстве микрочипов, зеркал и сложных материалов.

Рисунок 2. Жестяные банки.
Алюминий парамагнитен. Металл магнитно притягивается только в присутствии магнитного поля.
Химические свойства.
В сельской местности алюминий быстро окисляется и покрывается оксидной пленкой. Это защищает металл от коррозии и предотвращает его реакцию с густыми кислотами (нитратами и сульфатами).
В нормальных условиях реакции алюминия возможны только после удаления оксидной пленки. Большинство реакций происходит при высоких температурах.
Основные химические свойства предметов приведены в таблице.
Горит при высоких температурах и выделяет тепло
Реагирует с серой при температуре выше 200°C, с фосфором — 500°C, азотом — 800°C и углеродом — 2000°C.
Реагирует в обычных условиях с йодом — при нагревании в присутствии катализатора (воды)
При нормальных условиях реагирует с разбавленными кислотами, при нагревании — с густыми кислотами.
Реагирует с водными растворами щелочей при плавлении
Заменяет наименее активные металлы
Алюминий не вступает в прямую реакцию с водородом. Реагирует с водой после удаления оксидной пленки.

Рисунок 3. Реакция алюминия с водой.








