Радикальные имена образованы от тривиальных латинских названий кислоты и суффикс — il (формил, ацетил, пропионил, масляная кислота и т.д.).
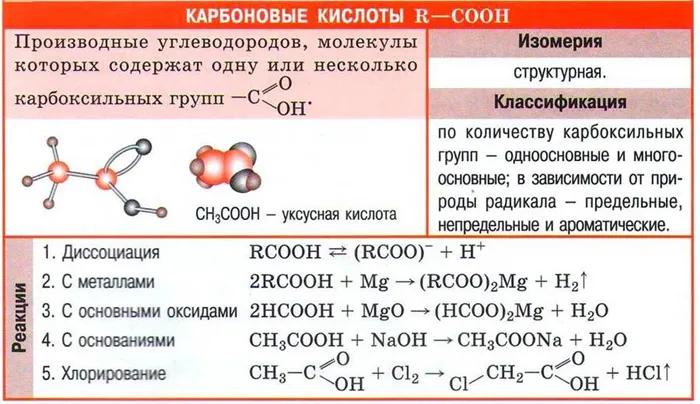
Карбоновые кислоты
Карбоновыми кислотами называют Производные углеводородов, содержащие одну или несколько карбоксильных групп.
Количество карбоксильных групп характеризует основность кислоты.
В зависимости от количества карбоксильных групп. карбоновые Кислоты делятся на монобазовые кислоты карбоновые кислоты (с одной карбоксильной группой), дибазовые кислоты (с двумя карбоксильными группами) и полибазовые кислоты.
Это зависит от типа радикала, присоединенного к карбоксильной группе, карбоновые Кислоты далее подразделяются на сложные эфиры, ненасыщенные и ароматические кислоты. Кислоты и ненасыщенные жирные кислоты классифицируются под общим термином названием ряд алифатических или жирных кислот.
Одноосновные карбоновые кислоты
Гомологический ряд моносинтетических ненасыщенных веществ карбоновых кислот (иногда их называют жирными кислотами) начинается с муравьиной кислоты.
Тип гомологической серии
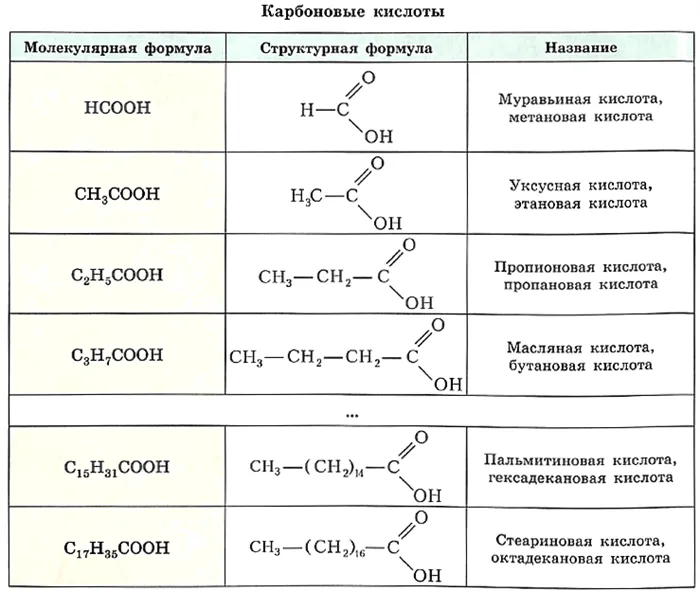
Номенклатура ИЮПАК позволяет многим кислотам сохранять свою тривиальность названия, обычно указывает на природный источник, из которого была выделена кислота. кислота, Например, муравьиная кислота, уксусная кислота, масляная кислота, валериановая кислота и т.д.
Для более сложных случаев названия кислот производят от названия Углеводороды с тем же числом атомов углерода, что и в молекуле кислоты, с добавлением суффикса -овая и слова кислота. Муравьиная кислота Н—СООН называетсметаномасляная кислота, -уксусная кислота кислота СН3-СООН -этаноловая кислота и т.д.
Поэтому кислоты рассматриваются как как Производные углеводородов, в которых одно кольцо превращено в карбоксил:
При составлении названий Кислоты с разветвленной цепью в соответствии с рациональной номенклатурой называются как Производные уксусной кислоты, в которых атомы водорода в молекуле заменены радикалами, например, триметилуксусная кислота кислота (СН3)3С — СООН.
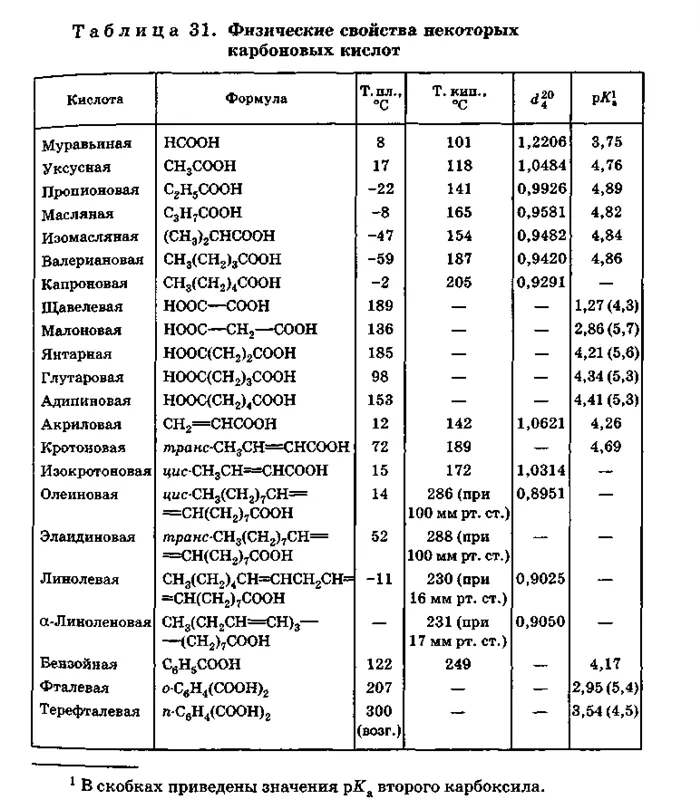
2 Физические свойства карбоновых кислот
Если рассматривать только с чисто формальной точки зрения, то карбоксильная группа является как Как комбинация карбонильной и гидроксильной функций. В действительности их взаимное влияние настолько велико, что полностью меняет их свойства.
В случае карбоксилатов поляризация двойной связи C=0 обычно значительно увеличивается за счет отщепления дополнительной пары свободных электронов от соседнего атома кислорода гидроксильной группы:
Это приводит к значительному ослаблению связи O-H в гидроксильной группе и небольшому отщеплению атома водорода в виде протона (H + ). Возникновение пониженной электронной плотности (δ+) у центрального атома углерода карбоксильной группы также приводит к притяжению σ-электронов соседней связи С-С к карбоксильной группе и возникновению (как пониженная электронная плотность (δ+) на а-углеродном атоме кислоты.
Все карбоновые Кислоты имеют кислую реакцию (обнаруживаемую маркерами) и образуют соли с гидроксидами, оксидами и карбонатами металлов и с активными металлами:
Карбоновые кислоты в большинстве случаев лишь слабо растворимы в водном растворе и слабо кислотами, значительно хуже, чем у кислотам, как соляная, азотная и серная кислоты. Так, если одна молекула растворена в 16 литрах воды, то степень растворения муравьиной кислоты составляет 0,06, уксусной кислоты — 0,0167, тогда как как соляная кислота При таком разбавлении он отделяется почти полностью.
Для большинства монобазисных карбоновых кислот рК а = 4,8, только формиат кислота имеет более низкий pKа (около 3,7), что можно объяснить отсутствием электроноотнимающего эффекта алкильных групп.
В безводном минерале кислотах карбоновые Кислоты протонируют кислород и образуют карбонильные катионы:
Сдвиг электронной плотности в нерасщепленном карбоновой нерасщепленной кислоты, как упоминалось выше, уменьшает электронную плотность у гидроксильного атома кислорода и увеличивает ее у карбонильного атома. Этот сдвиг еще больше усиливается под действием кислотного аниона:
Результатом сдвига является полное выравнивание заряда с анионом, который фактически находится в форме карбоксилатного аниона с А-координацией.
Первые четыре члена серии карбоновых Кислоты — это подвижные жидкости, которые смешиваются с водой во всех отношениях. Кислоты, молекулы которых содержат от пяти до девяти атомов углерода (как изомасляная кислота), являются маслянистыми жидкостями. кислота)являются маслянистыми жидкостями, их растворимость в воде низкая.
Высшие кислоты (от C10) представляют собой растворимые твердые вещества, практически нерастворимые в воде, которые разлагаются при нормальных условиях в процессе дистилляции.
Муравьиная, уксусная и пропионовая кислоты имеют сильный запах; средние кислоты имеют неприятный запах, а высшие кислоты не имеют запаха.
Физические свойства карбоновых На физические свойства кислот влияет высокая степень связи, которая возникает при образовании водородных связей. Кислоты образуют прочные водородные связи, так как Их связи O-H сильно поляризованы. Кроме того, карбоновые кислоты способны образовывать водородные связи с участием атома кислорода карбонильного диполя, который обладает высокой электроотрицательностью. В твердом и жидком состоянии карбоновые Кислоты существуют в основном в виде циклических димеров:
Такие димерные структуры также в некоторой степени сохраняются в газообразном состоянии и в разбавленных растворах в неполярных растворителях.
Карбоксильная группа влияет на углеводородный радикал, делая определенные связи С-Н в нем более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.
Физические свойства и способы получения карбоновых кислот
Низшие карбоновые Кислоты — это жидкости с сильным запахом, хорошо растворимые в воде. По мере увеличения углеводородного радикала растворимость кислот уменьшается, а температуры кипения и плавления увеличиваются. Пальмитиновая и стеариновая кислоты растворимы в воде. вещества, нерастворимы в воде.
Реакции окисления являются наиболее распространенным способом синтеза кислот. карбоновых Кислоты — это реакции окисления. Отправная точка вещества в этих синтезах являются спирты и альдегиды:
Пищевая уксусная кислота производится биотехнологическим способом, т.е. путем сбраживания сахаросодержащих растворов специальными микроорганизмами.
(c) Отрывок из справочника «Химия: Справочник по химии в таблицах / М.: Айрис-пресс Верлаг
Химические свойства карбоновых кислот
Обратите внимание, что химические свойства карбоновых кислот, как и неорганических кислот обусловлены их способностью разделяться с образованием катиона водорода:
Почему уравнение электролитического разложения соляной кислоты имеет знак равенства, а аналогичное уравнение для уксусной кислоты — противоположный знак? Дело в том, что уксусная кислота, в отличие от соляной, слабая, и лишь небольшая часть ее молекул распадается на ионы в водном растворе.
Из-за присутствия в растворе катионов водорода. карбоновые Для уксусных кислот характерно: они имеют кислый вкус, изменяют цвет маркеров, реагируют с активными металлами, основными и амфотерными оксидами, основаниями и солями. Давайте рассмотрим свойства карбоновых Кислоты, такие как уксусная кислота CH3ЧОХ.
Уксусная кислота реагируют с активными металлами с образованием солей (ацетатов) и выделением водорода:
Оксиды металлов реагируют с уксусной кислотой с образованием соли металла и воды:
При реакции уксусной кислоты со щелочами или нерастворимыми в воде основаниями также образуются соль и вода:
С солями уксусная кислота также взаимодействует. В данном случае, как и для того, чтобы произошла реакция ионного обмена, должно быть выполнено одно из следующих условий: Образование осадка, выделение газа или образование слабого электролита. Например, когда уксусная кислота реагирует с карбонатом кальция, выделяется углекислый газ:
Одно из важнейших химических свойств карбоновых С кислотами вы уже знакомы. В присутствии концентрированной серной кислоты в качестве катализатора кислоты реагируют со спиртами с образованием сложных эфиров. Сама реакция вам уже знакома, это реакция этерификации. Таким образом, взаимодействие уксусной кислоты и этилового спирта приводит к образованию сложного эфира — этилового эфира уксусной кислоты:
Нахождение в природе и применение карбоновых кислот
Карбоновые кислоты широко распространены в природе. Они содержатся во фруктах и ягодах и не только придают им кислый вкус, но и защищают их от порчи и нашествия вредителей.
Муравьиная кислота Он выделяется секреторными железами муравьев и некоторых видов медуз. Ощущение жжения от листьев крапивы также связано с раздражением кожи муравьиной кислотой.
Области применения карбоновых Широко распространено использование муравьиной кислоты в промышленности, технике и технологии, а также в быту. Муравьиная кислота используется для гравировки тканей и бумаги, при обработке кожи и в производстве лекарств, как Муравьиная кислота используется в качестве консерванта во фруктовых соках и в зеленых кормах для животных. Он также используется в качестве местного анестетика. Он также используется для окрашивания текстиля и бумаги.
Используется уксусная кислота как приправу к пище, как в качестве растворителя для красок, в производстве фармацевтических продуктов, таких как аспирин, в производстве пластмасс, токсичных химикатов и красителей. Уксусная эссенция, 70%-ный раствор уксусной кислоты, является коммерчески доступной. С уксусной кислотой в таких концентрациях следует обращаться очень осторожно! Его пары могут вызвать ожоги дыхательных путей, а употребление неразбавленного уксуса приводит к летальному исходу. Держите вещество подальше от детей и домашних животных.








