Изомеры (равные и частично общие, часть греч. одинаковые), наличие соединений (в основном органических) с одинаковым элементным составом и одинаковой молекулярной массой, но разными физическими и химическими свойствами. Такие соединения называются изомерами.
Изомерия органических соединений
В органической химии изомеры широко распространены, их суть заключается в том, что существует множество различных веществ, имеющих одинаковый молекулярный тип, но различную структуру и, следовательно, различные химические и физические свойства. В этом случае знание только молекулярного типа не дает полного представления о свойствах вещества. Знание структурного (графического) типа вещества может дать нам такое представление.
Существуют различия между строительными блоками, положениями, геометриями (CIS, trans) и оптическими изомерами органических соединений.
Структурная изомерия органических соединений
В этом случае порядок превращения индивидов в изомеры одинаков, но их пространственное расположение различно. Эти изомеры называются пространственными или стереоизомерами. Стереоизомеры, стереогруппы которых представляют собой многочисленные связи или маленькие круги, называются геометриями.
Наличие геометрических изомеров позволяет нескольким связям иметь функциональные группы. Разница между изомерами заключается в пространственном расположении рабочих групп по отношению к уровню двойных связей.
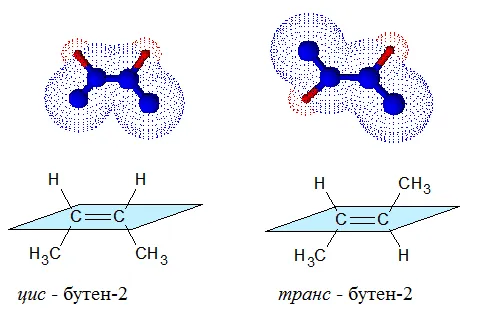
Названия этих изомеров производятся с помощью цис- и транс-.
В цис-сомере два одинаковых заместителя у разных атомов углерода с двойной связью находятся по одну сторону от двойной связи.
В трансмономере идентичные заместители находятся на противоположных сторонах двойной связи.
Если все заместители в пределах нескольких связей различны, используются названия e, z (entgegen- «z» от zusammen — вместе). Чтобы определить тип конфигурации (e- или z-), необходимо сравнить древность заместителей, т.е. индивидуальные номера.
Z-конфигурация имеет один изомер с двумя верхними заместителями на одной стороне двойной связи, а e-конфигурация имеет один изомер с двумя верхними заместителями на противоположной стороне двойной связи.
Например, тип 1-бром-1-хлор-2-2-нителия показан на схеме. Изомеры этилена имеют следующие заместители: H (атомный номер -1), BR (атомный номер -35), N (атомный номер -7), CL (атомный номер -17).
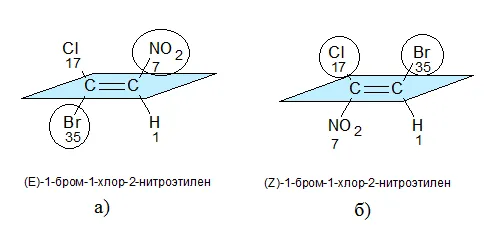
(a) первый атом углерода имеет BR (35) в качестве верхнего заместителя, а второй атом углерода имеет N (7). Эти заместители находятся на противоположных сторонах нескольких связей. Поэтому он является изомером e.
(b) первый атом углерода имеет верхний заместитель (17), а второй атом углерода имеет Br (35). Эти заместители находятся на одной стороне нескольких связей. Следовательно, это изомер Z.
Если заместители, связанные непосредственно с ненасыщенным атомом углерода («первый слой»), одинаковы, то заместители во «втором слое» сравниваются с «третьим слоем».
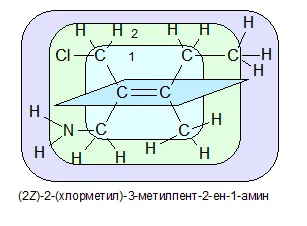
В представленном примере все заместители «первого слоя» одинаковы — это C. Поэтому необходимо изучить «второй слой». Во втором слое первый уголь, присоединенный к двойной связи, имеет CL в качестве верхнего заместителя — второй атом углерода C.
Оптическая изомерия органических соединений
В начале 19 века было обнаружено, что некоторые вещества отклоняют уровень поляризации под определенным углом, когда через них проходит поляризованный свет. Кроме того, существуют два (изомерных) соединения, которые отклоняют уровни поляризации с одинаковой величиной, но разными знаками (слева и по часовой стрелке). Такие вещества называются изомерами (противоположными или анти-изомерами).
Смеси, содержащие равные количества левого и правого изомеров, визуально инертны и называются ракельными смесями.
Визуальная активность характерна для веществ, содержащих один или несколько асимметричных атомов углерода (т.е. углеродов, связанных с четырьмя различными заместителями). Например:.
Два визуальных изомера различаются как объекты и их кумиры. Когда они накладываются друг на друга, они не совпадают, как левая рука и правая рука, когда они накладываются друг на друга. Такие молекулы называются молекулами ручной работы (греч. ‘hand’ — рука). С другой стороны, если молекула совпадает со своим кумиром, она беспрепятственно движется.
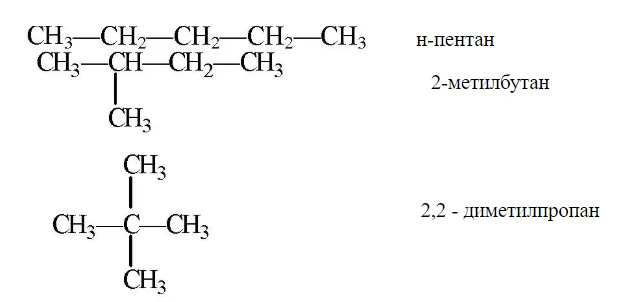
В органических молекулах соединения, содержащие такие индивиды, как кремний, азот и фосфор, в дополнение к углеродам, связанным с четырьмя различными заместителями, могут иметь стереоось или уровень, а также руководство.
На уровнях оптические изомеры рисуются в проекции Фишера типа
При теоретическом исследовании изомеров все чаще используются топологические методы. Появились математические формулы для расчета количества изомеров. Стереохимическая номенклатура, содержащаяся в разделе E Правил номенклатуры ИЮПАК по химии, была разработана для обозначения интервалов, которые являются изомерами разных типов.
Изомер
Изомеры (равные и частично общие, часть греч. одинаковые), наличие соединений (в основном органических) с одинаковым элементным составом и одинаковой молекулярной массой, но разными физическими и химическими свойствами. Такие соединения называются изомерами.
Дискуссии между Й. Либигом и Ф. Вёлером привели к открытию того, что существуют два совершенно разных Agcno соединения двух совершенно разных Agcno соединений. Другим примером была винная кислота и кислота в винограде после изучения J. 1830; J. Berzelius изобрел термин изомер и предположил, что различия были обусловлены «сложными лицами различного распределения в обычных лицах» (т.е. молекулами). Настоящее объяснение изомеры получили только во второй половине 19 века, благодаря теории химического строения А. М. Батлерова и стереохимическому учению Ж. Г. Вант-Гоффа (Vant-Goff). Г. Вант-Гоффа (пространственная изомерия).
Структурная изомерия
Структура ISME является результатом различий в химическом строении. Этот человек включает в себя:.
Изомерия углеводородной цепи (углеродного скелета)
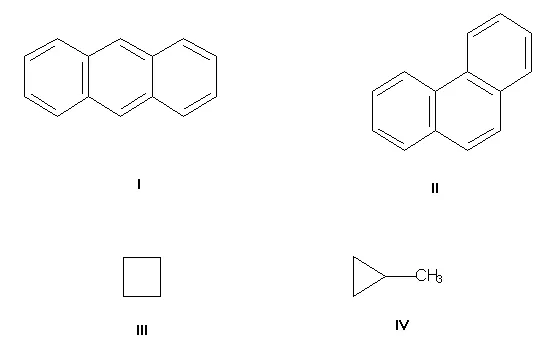
Изомеры углеродного скелета, обусловленные различными связями атомов углерода. Самый простой пример — бутан.3-ch2-ch2-ch3 и изобутан (ch3)3ch. Другими примерами являются антрацит и фенан (типы I и II, соответственно), циклобутан и метилоциклопропан (III и IV).
Валентная изомерия

Валентные измеры (особый тип структуры ISME). Изомеры могут превращаться друг в друга только путем перестройки связей. Например, изомерами бензола (V) являются бициклы 2.2.0-AXA-2.5 диния (VI, «бензендеваль»), Присмана (VII, «бензол Ланденбурга») и бензивала (VIII).
Изомерия функциональной группы
Характер работы операционных групп различен. Например, этанол (гл.3-ch2-о) и диметил (ch3-o-ch3)
Изомерия положения
Типы структурных изомеров, характеризующиеся различиями в положении двойных связей в одной и той же функциональной группе или в одном и том же углеродном каркасе. Примеры: 2-хлорбутановая кислота и 4-хлорбутановая кислота.
Пространственная изомерия (стереоизомерия)
Энантиомерия (оптическая изомерия)
Пространственные изомеры (стереоизомеры) возникают в результате различий в пространственной конфигурации молекул с одинаковой химической структурой. Изомеры этого типа подразделяются на противоположные (визуальные изомеры) и бинарные изомеры.
Антимоды (визуальные изомеры, зеркальные изомеры) — это пары оптических веществ, характеризующиеся одинаковой величиной светового вращения с противоположным знаком, но все остальные физические и химические свойства идентичны (свойства беговой дорожки в дополнение к реакциям с другими визуально активными веществами и физическим). Необходимым и достаточным основанием для появления оптических антиподов является приписывание молекуле одной из следующих точечно-симметричных групп nг, г n, T, O, I (вручную). Наиболее часто упоминается асимметричный атом углерода, т.е. связанный с четырьмя различными группами заместителей.
Другие индивиды, например, кремний, азот, фосфор и сера, также могут быть асимметричными. Существование асимметричных личностей обусловлено не только противоположными причинами. Например, производные алмаза (IX), железа (X), 1,3-дифениларена (XI) и 6,6′-динитро-2,2′-дифеновой кислоты (XII) имеют оптические аналоги. Визуальная активность последней связи обусловлена атрофией, т.е. пространственной изомерией, вызванной отсутствием вращения вокруг простой связи. Обратная картина наблюдается также в спиральных конфигурациях белков, нуклеиновых кислот и объявлений (XIII).
(R)-, (S)- номенклатура оптических изомеров (правило наименования)
Четыре группы асимметричных углеводородов, связанных сAi, Ai, Ai, Ai, Ai, Ai, Ai, Ai, Ai, Ai.Другая древность обусловлена последовательностью: a> b> c> d. В простейшем случае древность определяется порядковым номером человека, связанного с асимметричным атомом углерода: Br (35), Cl (17), S (16), O (8), N (7), C (6), H (1).
Например, в бромхлористоводородной кислоте:.
Древние альтернативы для асимметричных атомов углерода: Br (a), Cl (b), группа COOH (C), C в H (D).
В бутаноле-2 кислород является верхним заместителем (a), а водород — нижним заместителем (d).
Заместители CHS3 и ч2CH3. В этом случае древность определяется количеством или числом других индивидов в группе. Приоритет в этильной группе сохраняется, поскольку первый человек связан с другим C (6), а остальные H (1), в то время как в метильной группе приоритет сохраняется, поскольку углерод связан с тремя людьми или порядковым номером 1. В сложных случаях сравнение продолжается до тех пор, пока все лица не достигнут разных номеров класса. При наличии двойных или тройных связей люди, связанные с ними, оцениваются как два и три человека соответственно. Таким образом, группа -COH считается C(O, O, H), а группа -COOH считается C(O, O, OH). Карбоксигруппа старше альдегидной группы, так как содержит три члена под номером 8.
Для альдегида d-глицерина группа OH (a) является самой старой, за ней следует группа CHO (b).2OH (c) и H (d):.
Следующим шагом является определение расположения группы: соответствующая, r (lat. rectus) или левая рука, s (lat. inister). Повернув соответствующую модель, точку зрения ориентируют так, чтобы младшая группа (d) находилась внизу и рассматривалась через ось, проходящую через четырехугольник и затененный край группы (d). Альдегидные группы D-глюцилинов.
Явление, когда соединения образуются из одинакового числа индивидов, но имеют различные конформации или пространственное расположение индивидов, называется изомерией. Изомеры отличаются по своим химическим свойствам от своих природных химических свойств. Изомеры встречаются во всех органических соединениях.
Изомерия статическая и динамическая
Основные типы изомеров:.
- статическая – изомеры образуются в результате химического процесса изомеризации;
- динамическая – несколько изомеров существуют одномоментно и легко переходят друг в друга.
Статические изомеры включают углеродные скелеты, положения кратных связей, функциональные группы, порядок и валентность.
Примерами динамических изомеров являются основные таутосии, где инвертированные изомеры возникают из-за внутримолекулярного переноса протонового водорода.
Стереоизомерия
В пространственных изомерах одного и того же структурного типа люди молекулы имеют разные космические ориентации.
Чем структурные изомеры отличаются от пространственных: первые изучают порядок молекул на уровне, вторые — порядок индивидуумов внутри опухоли.
Стереоизомы различают по геометрии (CIS-Trans) и зрению.
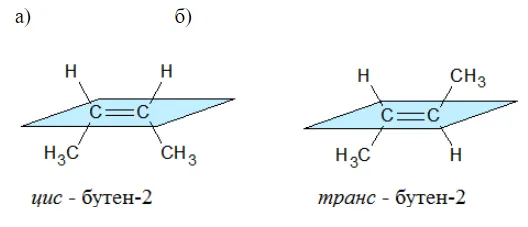
Цис-транс — изомерия (геометрическая)
Геометрические изомеры присутствуют в веществах с двойными связями или кругами.
Геометрические изомеры подразделяются в зависимости от уровня, на котором находится ПМ или петля.
Изомеры с одинаковыми заместителями по одну сторону плоскости называются цис-изомерами.
Соединения с заместителями на противоположной стороне кольца или на уровне кольца называются транс-изомерами.
Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-
Оптическая изомерия
При исследовании веществ одного и того же структурного типа в полемометре было обнаружено явление вращающихся уровней поляризации. Такие вещества были названы визуально активными веществами.
Исследования показали, что молекулы этих веществ являются рукотворными, то есть несовместимыми с отражением в зеркале. Инклюзивные вещества существуют в виде двух оптических антистержней, один из которых направлен по часовой стрелке (+), а другой — по левой (-).
Признаки оптических изомеров можно определить с помощью пул-метра.
Ручная причина — наличие асимметричных атомов углерода, присоединенных к четырем различным заместителям.
Рукотворные молекулы не могут быть подобраны друг к другу из-за зеркальной симметрии.
Пример пары колониальных изолятов, представляющих зеркальные отражения:.
(s) — (+) — молочная кислота (слева) и (r) — (-) — молочная кислота (справа).

Для представления факторов зрительного нерва используются типы проекций Э. Фишера.
Правила построения формул Фишера
Стереоизомеры с асимметричными атомами углерода изображаются на уровне как форма проекции, предложенная Э. Фишером в конце XIX века.
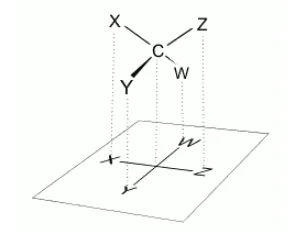
Правила представления проекции Фишера:.
- Углеродный скелет располагается в пространстве вертикально, нумерация атомов углерода идет сверху вниз.
- Горизонтальные связи в проекции направлены к наблюдателю, а вертикальные – от него.
Правила использования проекции Фишера включают следующее
- проекция корректна только в плоскости чертежа;
- нельзя разворачивать чертеж на 90° и 270°, так как вертикальные и горизонтальные линии меняются местами;
- допускается разворот на 180°.
Номенклатура стереоизомеров основана на древнем правиле асимметричных заместителей атомов углерода (определяемых как порядковые номера в периодической таблице). При этом учитывается древнее направление убывания: убывание по часовой стрелке характеризуется как R.
Представьте себе следующее: аналог типа изомера есть везде и нигде, даже в человеческом организме. Но это известно тем, кто внимательно прочитал нашу статью. Давайте уточним, какие вещества называются изомерами и какие типы изомеров выделяют в органической химии.
Классификация
Существует два типа изомеризации.
- структурная – соединения отличаются строением молекул;
- пространственная – одинаковые по составу и строению вещества различаются пространственным расположением атомов.
Описание каждого типа приведено в таблице.
Значение.
Изомеры отличаются положением метильной группы -CH3 в углеродной цепи (может быть присоединен к любому атому углерода).
Изомеры различаются по положению:.
- кратных связей – разное положение двойных связей в молекуле: СН2= CH-CH2-ch3 (бутен-1) и CH3-CH = CH-CH3 (бутен-2);
- функциональной группы – присоединение группы к любому атому углерода в цепи: СН3-ch2-ch2-ch2OH (бутанол-1) и CH3-ch2-CHL-CHH3 (бутанол-2);
- заместителя – перемещение радикала в углеродной цепи: CH3-CHCl-CH2-ch3 (2-хлорбутан) и CH2Cl-CH2-ch2-ch3 (1-хлорбутан)
В зависимости от расположения функциональных групп образуются различные категории веществ: CH3-ch2-OH (этанол) и CH3-o-ch3 (диметиловый эфир).
Визуальное или зеркальное отражение
Изомеры отражают друг друга.
Изомеры отличаются положением корня относительно плоскости. Класс соединений, содержащих двойные связи, и свойства циклических соединений. Существует два типа:
- цис-изомерия – радикалы находятся по одну сторону плоскости;
- транс-изомерия – радикалы лежат по разным сторонам плоскости

Рисунок 2.Пространственная изомерия.
Чем больше атомов углерода в молекуле, тем больше изомеров может образоваться в соединении.
Номенклатура
Изомеры названы в трех частях.
- номер атома углерода, к которому присоединены дополнительные группы;
- название группы;
- название главной цепи.
Основная цепь атомов углерода является главной цепью. Например, если цепь из пяти атомов углерода соединяется с цепью из двух атомов углерода, то цепь из пяти атомов углерода считается первичной цепью.
Атомы отсчитываются с конца в точке разветвления или во многих точках разветвления. Структурная формула изомера помогает четко определить, какой атом стоит на первом месте.
Примеры изомеров с названиями:.
Изомеры имеют одинаковую молекулярную формулу, но разные типы структуры.








