Третье предложение теории строения органических ассоциаций, касающееся взаимного влияния индивидов на молекулы, подтверждается сравнением свойств этих аминов и аммиака.
Номенклатура аминов
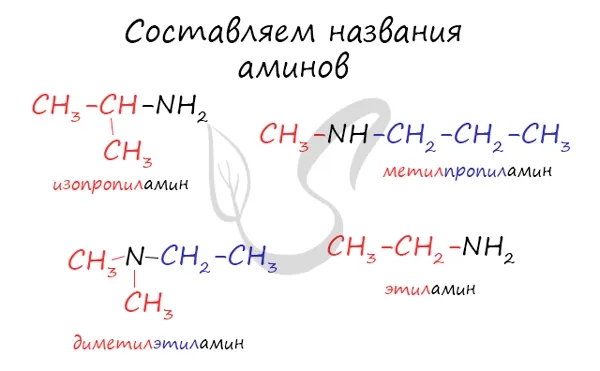
- Названия аминов образуют из названий углеводородных радикалов и суффикса амин. Различные радикалы перечисляются в алфавитном порядке.
При наличии одинаковых корней используются префиксы DI и TRI.
- Первичные амины могут быть названы как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2.
В этом случае аминная группа обозначается префиксом amino.
| 1-Аминопропан | 1,3-Диаминобутан |
| ch.3-ch2-ch2-NH2 | NH2-ch2-ch2-ch (nh)2) — ch3 |
- Для смешанных аминов, содержащих алкильные и ароматические радикалы, за основу названия обычно берется название первого представителя ароматических аминов – анилин .
Например, n-метиланилин:.
Символ N- ставится перед названием алкильного корня, указывая на то, что этот корень присоединен к атому азота, а не к заместителю бензольного кольца.
Изомерия аминов
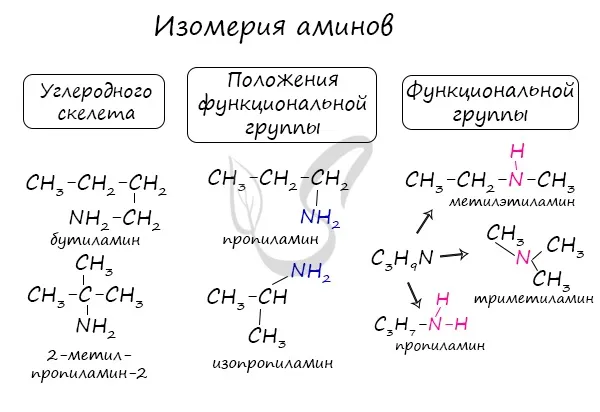
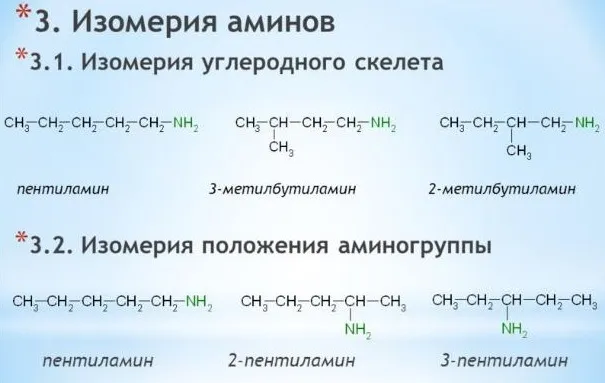
Амины характеризуются изомерами углеродного каркаса, изомерами аминной группы и различными типами функциональности амина.
Амины характеризуются изомерами углеродного сапога (начиная с C4h9NH2).
| Например. Тип c4н9NH2 соответствуют два амина-изомера углеродного скелета. |
| н -Бутиламин (1-аминобутан) | Изобутиламин (1-амин-2-метилпропан) |
Изомерия положения аминогруппы
аминоиды характеризуются изометричностью положения аминной группы (начиная с C3h9n).
| Например. Тип c4н11N соответствуют амины положения аминогруппы. |
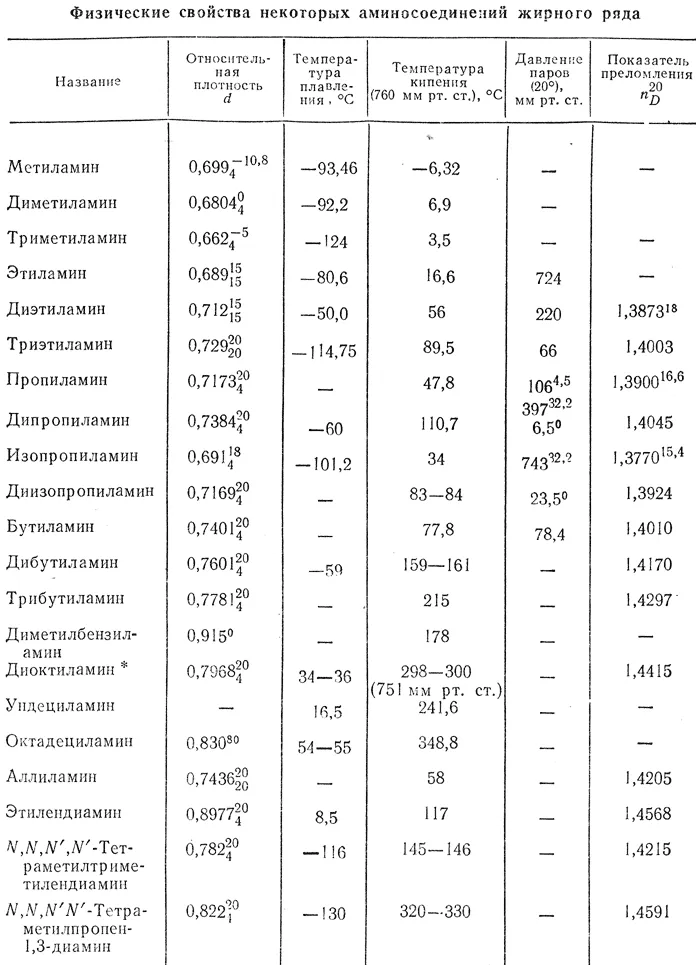
Более простые амины (метиламин, диметиламин, триметиламин) являются газами. Другие низшие амины являются жидкостями, которые хорошо растворяются в воде. Они имеют характерный запах, похожий на запах аммиака.
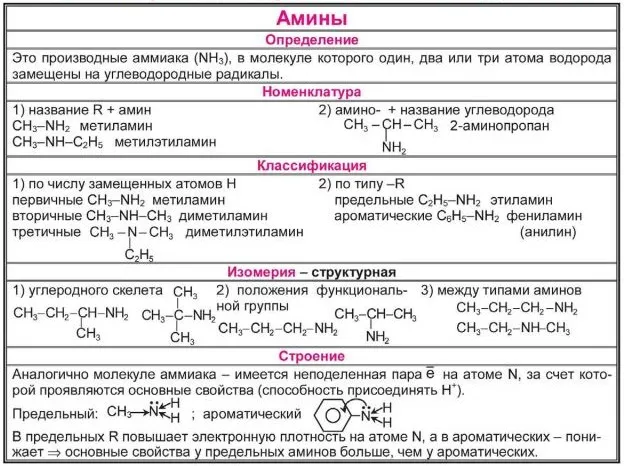
Амины
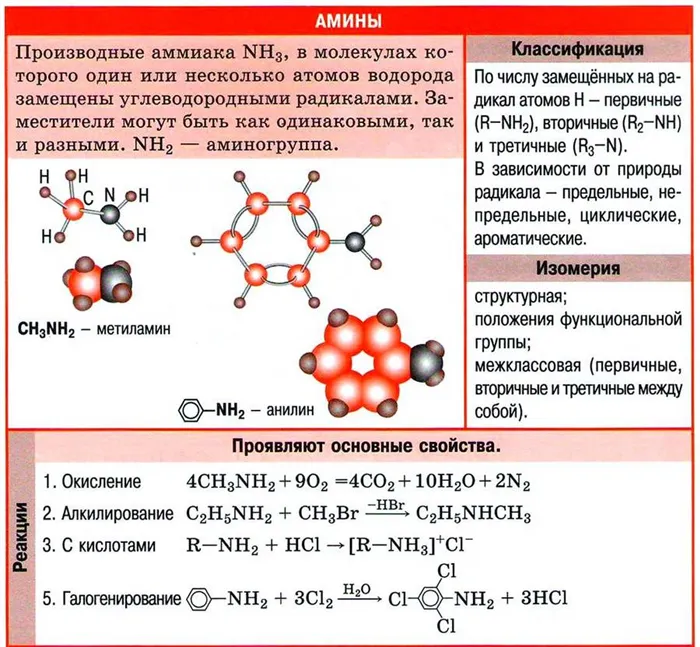
Амины — это органические соединения, продукты замещения водорода в NH3 из различных углеводородных корней. Функциональные группы аминов2.
Что-то вроде амина.
Амины классифицируются как первичные, вторичные или третичные амины в зависимости от количества углеводородов.

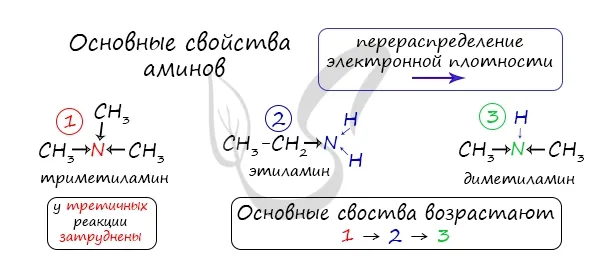
Помните, что первичные свойства аминов настолько сильны, насколько велика электронная плотность у атома азота. Однако в третичных аминах три углеводородных корня являются основной проблемой химической реакции.
Поэтому третичные амины обладают более слабыми основными свойствами, чем вторичные амины. Основные свойства возрастают в следующем порядке: третичные амины (слабые основные свойства) → первичные амины → вторичные амины (хорошо развитые основные свойства).
Номенклатура и изомеры аминов
Названия аминов образуются путем добавления окончания ‘amine’ к названию соответствующего углеводородного корня: метиламин, этиламин, пропиламин, изопропиламин, бутиламин и т.д. Если корней несколько, они перечислены в алфавитном порядке.
Распространенные типы аминных соединенийnh2n+3N. Атомы углерода находятся в sp3 Гибридизация.
Аминоиды характеризуются структурными изомерами, углеродным скелетом, положением функциональной группы и изомерами аминных групп.
Прием.
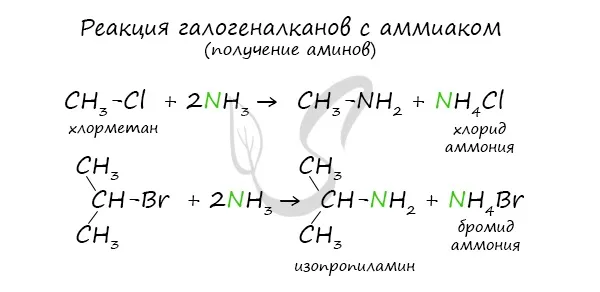
Эта реакция основана на замене атомов галогена в галогене на аминные группы, что приводит к образованию солей амина и аммония.
В этой реакции нитрильная группа преобразуется в ахиновую группу и образуется вода.
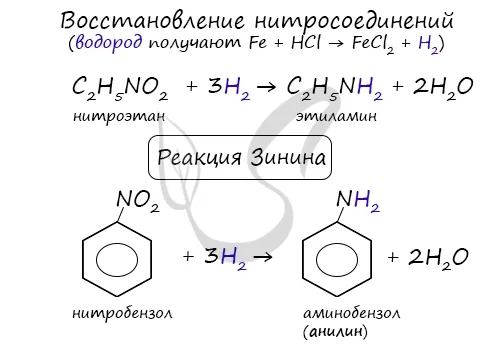
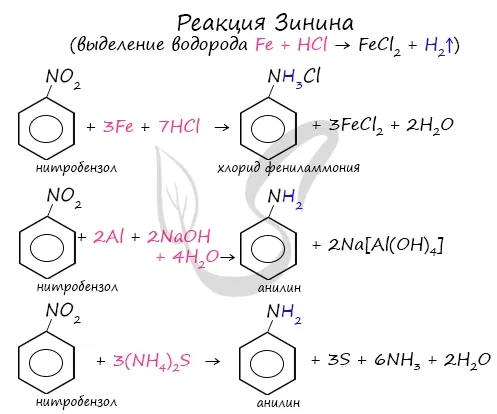
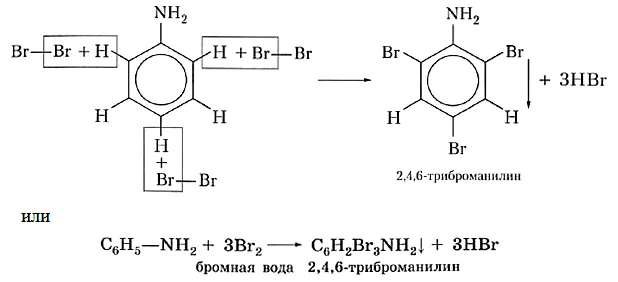
Известна реакция ароматических нитросоединений (например, анилина) с получением аминов, предложенная Н. Н. Зининым в 1842 году. Можно использовать различные вариации. Самое главное, что в начале реакции выделяется водород.
В ходе реакции происходит разрушение углеродных групп и их отщепление от молекулы в виде воды.
Поэтому гексаметилэненлимин, используемый в производстве нейлоновых волокон, получают в промышленности.
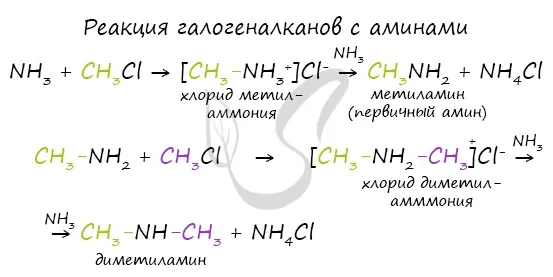
В промышленности амины получают в результате реакции аммиака со спиртами, где гидроксильная группа замещается аминной группой.
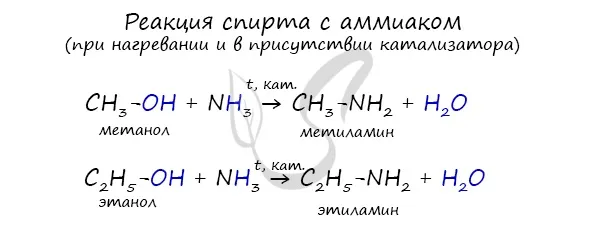
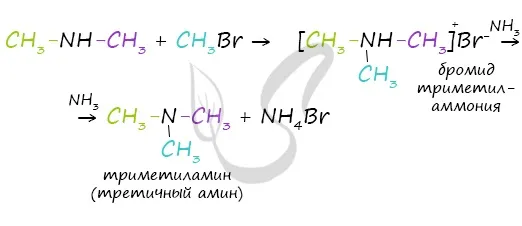
В ходе реакции галогенированного аммиака возможно образование аминов, первичных, вторичных и третичных аминов.
Подскажите, реагируют ли третичные амины с галогенами? Если да, то как развивается реакция и каковы ее последствия? Например, если триметиламин вступает в реакцию с хлоромесном?
Физические свойства аминов
Более простые амины (метиламин, диметиламин, триметиламин) являются газами. Другие низшие амины являются жидкостями, которые хорошо растворяются в воде. Они имеют характерный запах, похожий на запах аммиака.
Первичные и вторичные амины могут образовывать водородные связи. Это значительно повышает их температуру кипения по сравнению с соединениями того же молекулярного веса, которые не могут образовывать водородные связи.
Анилин представляет собой маслянистую жидкость, несколько нерастворимую в воде и кипящую при температуре 184°C.
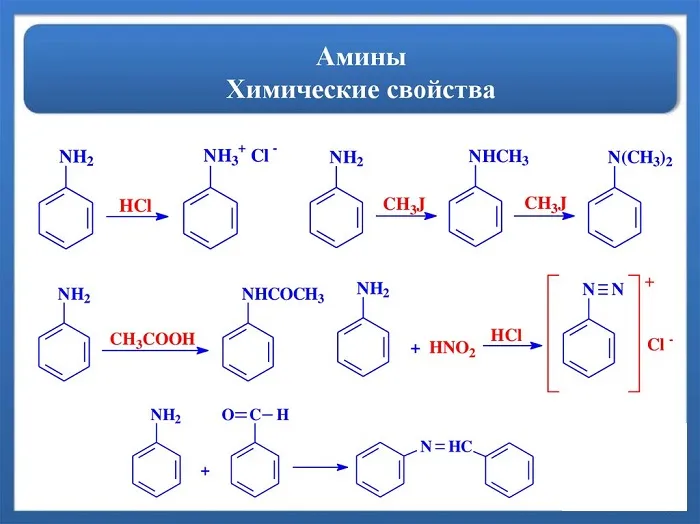
Химические свойства аминов
Химические свойства аминов в основном определяются наличием неделимой электронной пары на атоме азота.
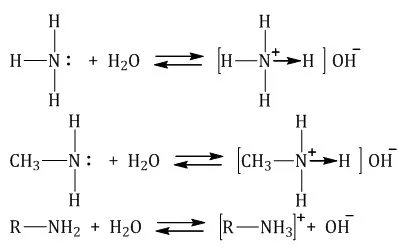
Амины в качестве оснований. Атомы азота аминогруппы могут образовывать ковалентные связи по донорно-акцепторному механизму, при котором они действуют как доноры благодаря неразрывным электронным парам, подобно атомам азота в молекулах аммиака. Поэтому амины, такие как аммиак, могут связываться с катионами водорода. Другими словами, они могут функционировать как основания.
1. реакция аммония с водой с образованием гидроксид-ионов.
![]()
2. реакция с кислотами. Аммиак реагирует с кислотами, образуя соли аммония. Аминокислоты также могут реагировать с кислотами: см.
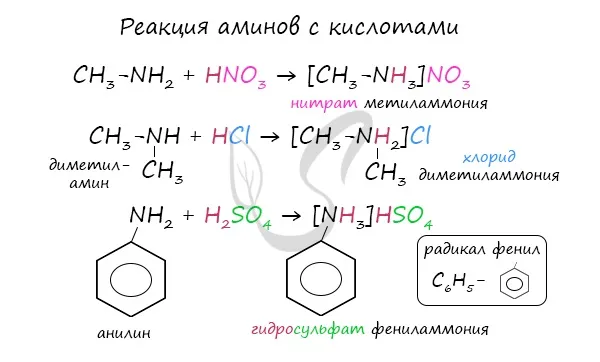
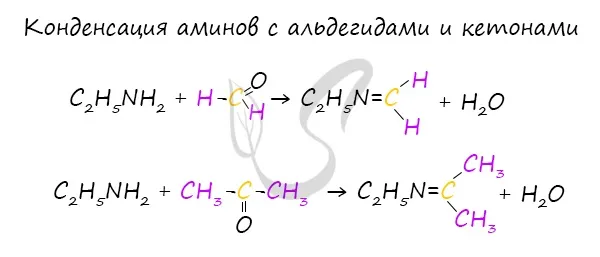
Основные свойства алифатических аминов выражены сильнее, чем у аммиака. Это связано с наличием одного или нескольких алкильных заместителей, положительный индуктивный эффект которых увеличивает электронную плотность атома азота. Увеличение электронной плотности превращает азот в более сильного донора электронных пар, усиливая его фундаментальные свойства.
Сжигание аммония. Амины сгорают в воздухе с образованием углекислого газа, воды и азота.
![]()
Амины широко используются в лекарственных препаратах и полимерных материалах. Анилин является наиболее важным соединением в этой категории и используется в производстве анилиновых красителей, фармацевтических препаратов (сульфаниламиды) и полимерных материалов (аниликоформальдегидная смола).
Общая формула для членов этой гомологической серии — Cnh2 n + 1NH2 или Cnh2n + 3N.
Получение аминов.
Алкилирование аммиаком (основной метод), которое осуществляется путем нагревания алкилгалогенидов с аммиаком.
При избытке алкилгалогенида первичные амины могут вступать в реакцию алкилирования и превращаться во вторичные или третичные амины.
2. восстановление нитросоединений:.
Используется сульфид аммония (реакция гиннинга), цинк или железо в кислой среде, алюминий в щелочной среде или водород в газовой фазе.
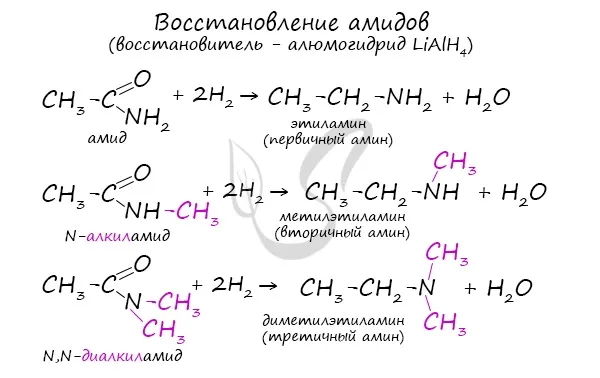
Восстановление нитрилов. Используйте LiAlH.4 :.
4. ферментативное декарбоксилирование аминокислот:.
Химические свойства аминов.
Все амины являются сильными основаниями, но алифатические — более сильные, чем аммиак.
Водные растворы по своей природе являются щелочными:.
Амины реагируют с кислотами с образованием солей.
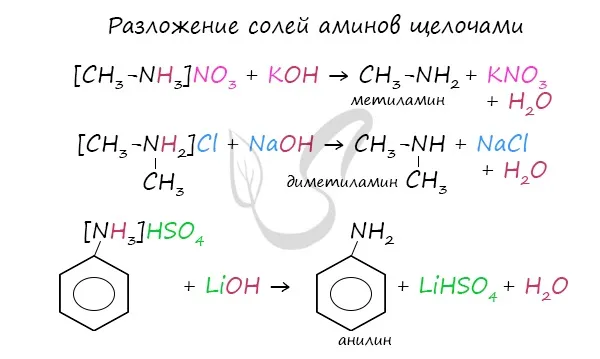
Соли представляют собой растворимые твердые вещества, хорошо растворимые в воде и несколько нерастворимые в неполярных жидкостях. При реакции со щелочами образуются свободные амины.
2.Образование комплексных соединений с переходными металлами:.
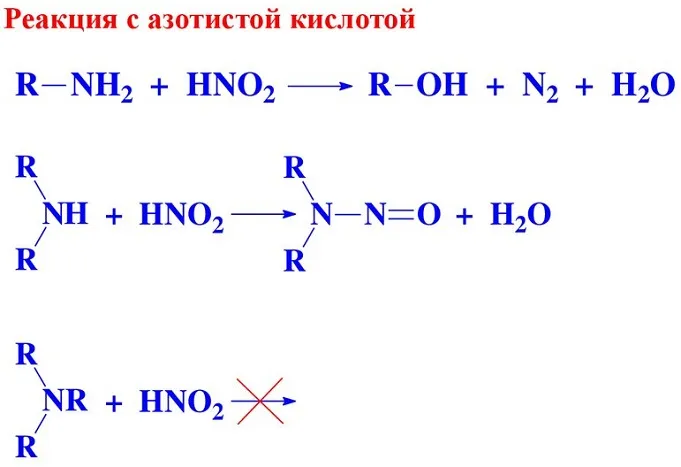
3. реакция с азотной кислотой: образуется по следующей схеме.
4. сжигание аминов. В результате образуются углекислый газ, азот и вода.
Для некоторых аминов используются простые названия: C6 H5 N H2 анилин (системное название фениламин).
Области применения аминов
Последние амины широко используются в органических композициях для производства фармацевтических препаратов, синтетических волокон, пластмасс и стимуляторов роста растений. Последний амин также встречается в природе. Это результат разложения природных органических веществ, которые содержат азот и часто имеют неприятный запах, похожий на запах гниющей рыбы.
Основные объемы анилина, производимого в промышленности, используются в производстве полимеров (полиуретанов), лекарств, взрывчатых веществ, гербицидов и красок.
Аминные группы являются одними из самых сложных органических соединений, так же как и амины. Эти вопросы рассматриваются в следующем обзоре.
Справочная таблица «Амины»
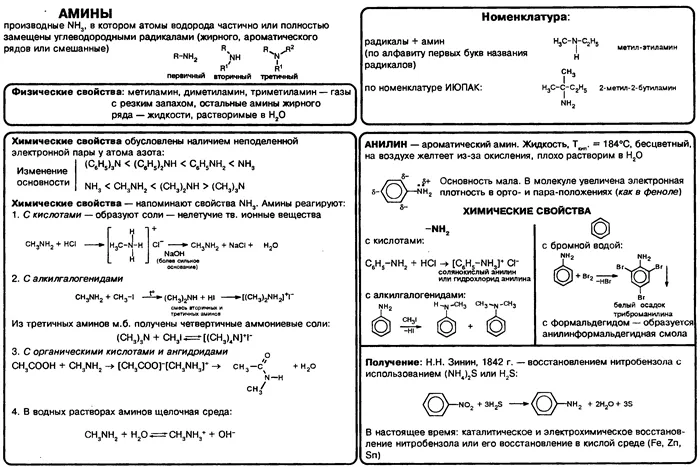
Конспект курса химии «Амины». Отрывки из учебника «Химия. 10 класс: учебник общеобразовательной организации: базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков.-М.: Просвещение.
По мере увеличения количества и размера углеводородных корней растворимость аминов в воде уменьшается. Ароматические амины не растворимы в воде.
См. также
Информация должна быть проверяемой. В противном случае он может быть оспорен и удален. Вы можете отредактировать эту статью, чтобы добавить ссылку на достоверный источник. Этот сигнал был установлен 12 мая 2011 года.
Фонд Викимедиа. 2010.
Полезное
Смотреть что такое «Амины» в других словарях:
Амины — Амины, или аммонийные углеводороды, представляют собой огромную категорию органических соединений, полученных в результате замещения аммиачного водорода на различные углеводородные остатки. Наиболее известными и изученными являются … Энциклопедический словарь Ф.А. Брокгауз и Дж. А. Эффрон.
Амины являются органическими соединениями и представляют собой продукты замещения атомов водорода аммиака NH3 из органических корней r: первичных RNH2, вторичных R2NH и третичных R3N (R, CH3, C2H5, C6H5). Амины, содержащие две, три, четыре или более групп NH2 в молекуле, являются… … ….
Амины — амины, органические производные аммиака, т.е. аммиак, в котором один или несколько индивидов замещены алкильным углеводородом (см.) или арилом. В зависимости от количества сторонников аммиака различают первичный RNH2, большая медицинская энциклопедия
Амины — это органические соединения, образующиеся при замене одного или нескольких атомов водорода в аммиаке на органический корень R. A
Амины — органические соединения распространенных типов RNH2 (первичный амин), R2NH (вторичный) и R3N (третичный), где R — органический остаток. Они используются в производстве красителей, взрывчатых веществ, фармацевтических препаратов и полимеров. Их амины и производные являются… … Современная энциклопедия.
Амины — (греч.). Название, данное некоторым органическим продуктам, получено путем замены спиртового или водородного остатка на водород аммиака. Иностранный словарь на русском языке. А.Н. Чудинов, 1910. класс аминов (гр.) Органические … Словари иностранных языков.
Амины — амины, органические соединения общего типа RNH2 (первичные амины), R2NH (вторичные амины), R3N (третичные амины), R — органический остаток. Используется в производстве красителей, взрывчатых веществ, фармацевтических препаратов и полимеров. Амины и их производные … … Иллюстрированный энциклопедический словарь.
Химия. Класс органических соединений, являющихся продуктами замещения атомов водорода в аммиаке на углеводородные корни, широко применяется в синтезе красителей, лекарств и полимеров. Крысин 1998.Rex. SIS 1964: ami/nes … Исторический словарь французского языка.
Амины — органические соединения, продукты замещения атомов водорода аммиака NH3 от органических корней r: первичных RNH2, вторичных R2NH и третичных R3N (R.CH3, C2H5, C6H5). Аминокислоты, содержащие две, три, четыре или более групп NH2 в молекуле, являются… Называется энциклопедическим словарем.
Амины — это азотсодержащие органические соединения, образующиеся путем замещения одного или нескольких атомов водорода в молекуле углеродной цепи, проявляя тем самым сильные нуклеофильные свойства для реакции (связывания и … …
При горении аминов азот чаще всего выделяется в молекулярной форме, так как для реакции азота с кислородом требуется очень высокая температура. Выделение углекислого газа является обычным явлением при сгорании органических веществ.
Получение аминов
Промышленное производство этих азотсодержащих соединений началось с получения анилина русским химиком-органиком Н. Н. Зининым в 1842 году. Реакции, названные в честь знаменитого химика, включают восстановление нитробензола сульфидом аммония. Уравнение.
Промышленная схема производства анилина выглядит следующим образом
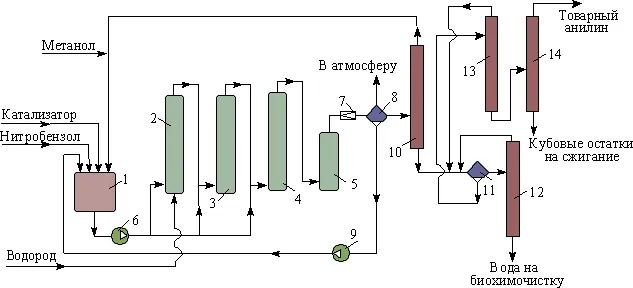
Другие методы производства, используемые в промышленности и лабораториях, включают в себя
Восстановление лития-алюминия-алюминия, где
Реакции восстановления для получения первичных аминов, где исходным материалом является нитрил
Различные типы алкильных реакций, в которых алкильные группы встраиваются в молекулы аммиака или низших ферментов.
Применение
Амины широко используются в промышленности, в основном в качестве сырья.
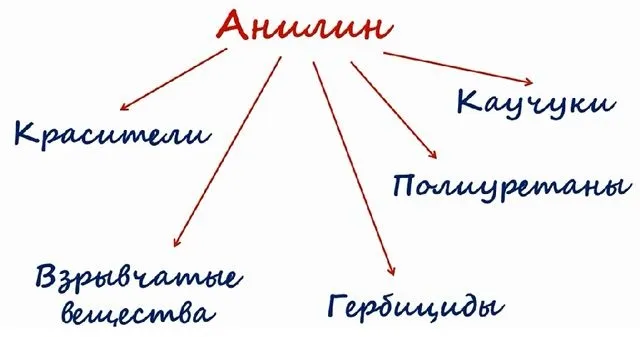
Известны следующие приложения:.
в качестве сырья для производства нейлона и других синтетических волокон; и
в качестве сырья для полиуретановых волокон и других полимеров; и
В качестве основы для получения анилиновых красителей
Состав факторов борьбы с вредителями (фунгициды, репелленты, инсектициды и т.д.)
в качестве катализатора в химической промышленности и металлургии; и
в фармацевтической и косметической промышленности.
Широкое применение находит анилин, который активно используется для производства красителей, различных видов лекарств, смол формальдегида и взрывчатых веществ.
Вредное воздействие аминов
Почти все представители этой категории химических веществ представляют опасность для здоровья. Анилин, наиболее распространенный, имеет токсичные пары, которые легко проникают в организм через кожу. Отравление этим веществом вызывает одышку, посинение губ и тахикардию.

Первая помощь включает промывание кожи, очистку воздуха и немедленную медицинскую помощь.








