При написании статей о реакциях ОВ важно соблюдать не только законы сохранения массы вещества до и после взаимодействия, но и равенство (баланс) электрических нагрузок исходного реагента и полученного продукта.
Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
Среди тысяч химических превращений, покоренных человеком, процессы окисления и восстановления занимают особое и величайшее место.
Это суть самой жизни. Круговорот веществ на нашей планете, фотосинтез, дыхание, биологический метаболизм — везде происходят взаимосвязанные реакции окисления и восстановления.
Понятие о степени окисления (С.О.)
Основная характеристика химических веществ R.O.
являютсяКонвенциональный. Он относится к нагрузке человека на химическое вещество, которое приобретает этого человека в процессе поставки или приема электронов от других элементов.
Существует положительная С.О. для элемента, отдающего электроны, и отрицательная С.О. для элемента, принимающего электроны.
Важно помнить. В веществе молекулы электрически нейтральны и представляют собой сумму SO Все, кто составляет эти молекулы, всегда равны нулю.
Это позволит вам найти SO. в зависимости от типа соединения.
Сущность окислительно-восстановительных реакций
Изменения и взаимодействия между веществами и SO. из составляющих их элементов называется восстановительной реакцией.
Эта трансформация является их главной характерной особенностью
Другое определение или реакция — это химическое превращение, которое происходит путем передачи электронов от одной частицы (восстановитель среды) к другой (окислитель).
2Na 0 + Cl2 0 = 2Na + cl-
Приведенный выше пример ОВОС можно гипотетически представить как состоящий из двух полупористых потоков.
2NA 0-2E- = 2NA + -, где электрическая частица (электрон) удаляется от атома натрия, который в данном случае является восстановителем. Выполняется окисление.
Вторая половина процедуры CL.2 + 2e — = 2cl- оксид хлора, поглощающий электроны, участвует в его восстановлении.
Схема поможет вам понять эти процедуры и термины, используемые для их описания.
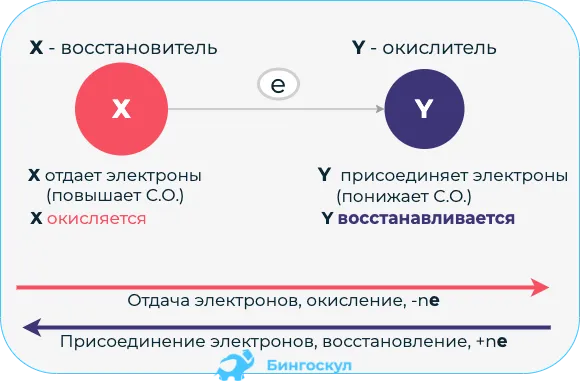
Совет, чтобы не запутаться в этих терминах:.
-
Составить аббревиатуру по первым буквам терминов:
Окислительное устройство — например, -e- восстановление → лобелия — окисление → дал SBI
Редуцирующий фактор — это человек, который возвращает электроны. Он дает грабителей, злых окислителей. Предает — окисление, восстановитель — одно и то же.
Таким образом, индивид, молекула или ион, к которому принадлежит электрон, называется средним восстановителем. Частицы, которые приобретают электроны, называются окислителями.
Какие реакции относятся к окислительно-восстановительным
Окислительно-восстановительные реакции играют решающую роль в организме человека. Без них метаболические и дыхательные процессы были бы невозможны. Большинство химических реакций природного и промышленного производства относятся к фоновым реакциям.

Прежде чем дать определение окислительно-восстановительным реакциям, необходимо ввести некоторые понятия. Первый из них — это состояние окисления. Это бремя, под которым находится вещество каждого человека. Сложите состояние окисления всех людей и получите ноль. Таким образом можно найти состояние окисления человека, для которого можно получить различные значения.
Окисление — это процесс высвобождения электронов из человека, в то время как уменьшение — это добавление электронов. Окисление — это вещество, которое может принимать электроны (восстановление). Восстанавливающий фактор — это вещество, которое может отдавать электроны (окисляться).
Какие реакции относятся к окислительно-восстановительным?
Окислительно-восстановительные реакции приводят к изменению степени окисления атомов реагирующих веществ. Окисление вызывает увеличение степени окисления, а восстановление — уменьшение. В неорганической химии такие процессы можно представить как перенос электронов от восстановителя к окислителю.
Существуют различные типы окислительно-восстановительных реакций.1 В межмолекулярных реакциях атомы, изменяющие свою степень окисления, находятся в одном и том же веществе. Примером может служить реакция, в результате которой из диоксида серы образуется сернистый газ. 2.Во внутримолекулярных реакциях атомы, изменяющие степень окисления, находятся в разных веществах. Примером может служить реакция разложения дихромата аммония. 3. автоокисление или авторедукция. В этой реакции окислитель и восстановитель — одно и то же вещество.
Метод электронного баланса
Почти во всех окислительно-восстановительных уравнениях очень трудно найти коэффициенты левой и правой частей уравнения. Для этой цели был изобретен простой и элегантный метод электронного баланса. Его суть заключается в том, что количество отданных электронов всегда равно количеству полученных электронов.
В результате реакции образуется оксид алюминия. Во-первых, необходимо правильно определить степени окисления атомов вещества в правой и левой частях уравнения. Степени окисления кислорода и алюминия изменились. Подсчитайте количество электронов, произведенных алюминием. Это должно быть равно количеству электронов, полученных кислородом. Необходимо составить два уравнения и установить соответствующие коэффициенты, чтобы преобразовать их в тождества. Эти коэффициенты должны быть заменены на соответствующие атомы в исходном уравнении.
В некоторых окислительно-восстановительных реакциях два или более элементов меняют свою степень окисления. Во время реакции сульфида фосфора3 с азотной кислотой, фосфором, серой и азотом степень окисления меняется. Фосфор дает четыре электрона, сера — 18 электронов, а азот — один электрон.
Классификация ОВР: примеры
Можно выделить следующие типы окислительно-восстановительных реакций
- межмолекулярное окисление-восстановление (окислитель и восстановитель находятся в составе разных молекул);
- внутримолекулярное окисление-восстановление (окислитель находится в составе той же молекулы, что и восстановитель);
- диспропорционирование (окислителем и восстановителем является атом одного и того же элемента);
- репропорционирование (окислитель и восстановитель образуют в результате реакции один продукт).
Примеры химических превращений, относящихся к различным типам СИЗ:.
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
3Br2 + 6KOH = 5KBr + KBrO3 + 6H2O
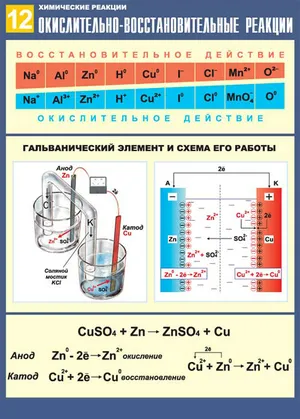
Токовые и бестоковые ОВР
Реакции восстановления также можно разделить на текущие и нетекущие.
В первом случае речь идет о производстве электроэнергии либо путем химических реакций (такие источники энергии могут использоваться в двигателях, радиоприемниках и контрольном оборудовании), либо путем электролиза. Другими словами, химические реакции осуществляются с помощью электричества (может использоваться электролиз). (для производства различных веществ и для обработки металлических поверхностей и изделий из них).
Примерами распространенных ТИА являются такие процессы, как горение, коррозия металлов, дыхание и фотосинтез.
Метод электронного баланса ОВР в химии
Уравнения большинства химических реакций эквивалентны простому подбору стехиометрических коэффициентов. Однако выбор коэффициентов ЭПР может привести к ситуациям, когда число атомов некоторых элементов не может быть уравнено без нарушения эквивалентности атомных номеров других элементов. В уравнениях для этих реакций коэффициенты подбираются методом электронного баланса.
Этот метод основан на том, что общее количество электронов, полученных окислителем, и общее количество электронов, отданных восстановителем, приводятся к равновесию.
Метод состоит из нескольких этапов
- Записывается уравнение реакции.
- Определяются СО элементов.
- Определяются элементы, которые в результате реакции изменили свои степени окисления. Отдельно записываются полуреакции окисления и восстановления.
- Подбираются множители для уравнений полуреакций так, чтобы уравнять принятые в полуреакции восстановления и отданные в полуреакции окисления электроны.
- Подобранные коэффициенты проставляются в уравнение реакции.
- Подбираются остальные коэффициенты реакции.
На простом примере взаимодействия алюминия с кислородом удобно написать уравнение шаг за шагом.
- Подбираем коэффициенты, при умножении на которые сравняется количество принятых и количество отданных электронов будет одинаковым:
Коэффициенты Al0-3e = Al +3 4,.
O2 0 + 4e = 2O-2 коэффициент 3.
4 Al + 3 O2 = Al2O3
- Видно, что для уравнивания всей реакции достаточно поставить коэффициент перед продуктом реакции:
4AL + 3O2 = 2 AL2O3
Примеры заданий на составление электронного баланса
Можно решить следующие задачи по уравнению.
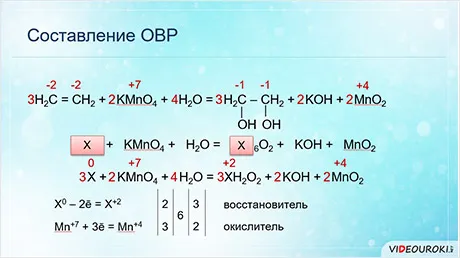
- Взаимодействие перманганата калия с хлоридом калия в кислой среде с выделением газообразного хлора.
Калий KMNO4 (перманганат калия, «марганцовка») является сильным окислителем благодаря тому, что степень окисления Mn в KMNO4 равна +7. Его часто используют для получения эфирного хлора в лаборатории в следующей реакции.
KCl + KMNO4 + H2SO4 = Cl2 + MnSO4 + K2SO4 + H2O
K +1 Cl -1 +K +1 Mn +7 O4 -2 +H2 +1 S +6 O4 -2 = Cl2 0 +Mn +2 S +6 O4 -2 +K2 +1 S +6 O4 -2 + H2 +1 O -2
Как показано после схемы COR, индивиды хлора присваивают электроны и увеличивают CO до 0, в то время как атомы марганца потребляют электроны.
Mn +7 +5e = Mn +2 сила 2,.
2cl -1 -2e = Cl2 0 множитель 5.
Расставьте коэффициенты в уравнении в соответствии с выбранным множителем.
10 K +1 CL -1 +2 K +1 MN +7 O4 -2 +H2SO4 = 5 CL2 0 +2 MN +2 S +6 O4 -2 +K2SO4 +H2O
Пусть количество оставшихся предметов будет одинаковым.
10KCL + 2KMNO4 + 8 H2SO4 = 5CL2 + 2MNSO4 + 6 K2SO4 + 8 H2O
- Взаимодействие меди (Cu) с концентрированной азотной кислотой(HNO3) с выделением газообразного оксида азота (NO2):
Влияние реакционной среды
Природа среды влияет на появление конкретного ЭПР. Роль среды реакции можно увидеть на примере взаимодействия перманганата калия (KMNO4) и сульфата натрия (Na2SO3) при различных значениях pH.
Видно, что изменение кислотности среды приводит к образованию различных продуктов из одного и того же вещества. Если кислотность среды изменяется, то это происходит и с другими реактивами, поступающими в ПОО. Аналогично, как и в приведенном выше примере, реакции с участием двух окрашенных CR2O7 2- протекают в разных средах с образованием разных продуктов реакции.
В кислой среде продуктом будет Cr 3+.
В щелочной среде продукты превращаются в CRO2 и CRO3 3+.
Реакции, которые называют окислительно-восстановительными (ОВР), происходят с изменением степеней окисления атомов, находящихся в составе молекул реагентов. Эти изменения происходят в связи с переходом электронов от атомов одного элемента к другому.
Окислительно-восстановительные реакции. Классификация ОВР

Этот видеоурок знакомит учащихся с основными окислительными и восстановительными факторами, процессами окисления и восстановления и классификацией ОВР. Видеоролик знакомит с различными способами определения факторов реакций, повышающих степень окисления (как органических, так и неорганических).
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоматериалам набора, необходимо приобрести их по списку и добавить в личный кабинет.


Конспект урока «Окислительно-восстановительные реакции. Классификация ОВР»
К концу 18 века кислородная теория окисления получила широкое распространение в химии. Согласно этой теории, окисление — это процесс соединения веществ с кислородом, а восстановление — процесс удаления из них кислорода. Согласно этой теории, в химических реакциях, происходящих в результате изменения состояния окисления индивида, происходит перенос электронов от одной частицы к другой. Такие частицы могут быть индивидами или ионами.
Аэдальные процессы лежат в основе многих природных явлений, в основе промышленного производства и важных функций человека, животных и растений, невозможны.
Все химические реакции можно разделить на два типа. Это реакции, которые протекают без изменения степени окисления. Это означает, что степень окисления всех элементов молекулы исходного вещества равна степени окисления этих элементов в продукте реакции. Так, в реакции между серной кислотой и гидроксидом калия степень окисления элементов в исходное вещество равна степени окисления элементов в продуктах реакции.
Реакции, связанные с изменением степени окисления элемента, являются красноватыми реакциями. Это означает, что степени окисления всех или определенных элементов в исходном веществе не равны степеням окисления этих элементов в молекулах продукта реакции.
Например, если магний, кислород и кислород и кислород изменяют свою степень окисления, магний изменяется от нуля до двух и от нуля до минус двух.
Изменение степени окисления в реакции покраснения обусловлено полным или частичным переносом электронов от людей одного элемента к людям другого элемента. В этой реакции каждый человек магния отбирает два электрона, и эти электроны переходят в молекулу кислорода. Каждая молекула кислорода связывается с двумя электронами, поэтому молекула кислорода связывается с четырьмя электронами.
Реакция омыления между железом и хлором является восстановительной реакцией, так как железо изменяет степень окисления на ноль, а хлор изменяет степень окисления с нуля на минус один.
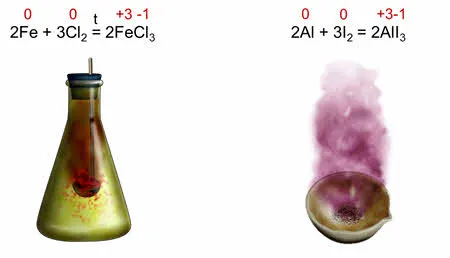
Реакция окисления между алюминием и йодом также является кислотным окислением, при этом алюминий изменяет свою степень окисления от нуля до трех, а йод — от нуля до минус одного.
Рассмотрим реакцию между перманганатом калия и соляной кислотой.
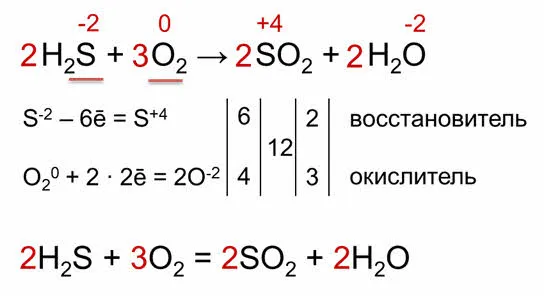
В этой реакции окисленный атом хлора превращается в нейтральный атом хлора путем вычитания окисленного атома из молекулы зольного хлора, отдавая каждый электрон по отдельности. В калии ранг окисления и семь атомов марганца объединяют по пять электронов, в результате чего образуется атом марганца со степенью окисления и двумя окислами.
Таким образом, дилерская реакция окисления представляет собой комбинацию процессов снабжения и потребления.
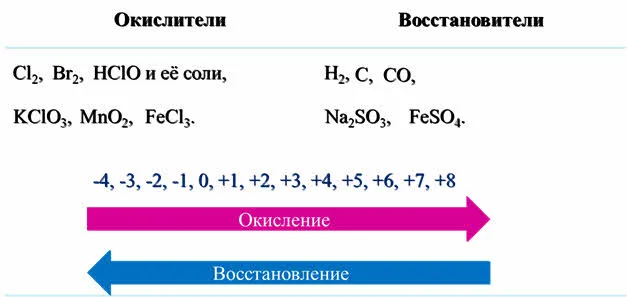
Процесс эмиссии электронов называется окислением. Процесс окисления приводит к повышению степени окисления элемента.
Важнейшими средствами окисления являются также сложные вещества, содержащие элементы с более высокой степенью окисления: перманганат калия, дихромат калия, нитрат калия и его соли, соли серной кислоты, оксид оксида 4, хлорная кислота и соли.
Влияние реакционной среды
Природа среды влияет на появление конкретного ЭПР. Роль среды реакции можно увидеть на примере взаимодействия перманганата калия (KMNO4) и сульфата натрия (Na2SO3) при различных значениях pH.
- Na2SO3 + KMnO4 = Na2SO4 + MnSO4 + K2SO4 (pH <,7 кислая среда),
- Na2SO3 + KMnO4 = Na2SO4 + MnO2 + KOH (pH =7 нейтральная среда),
- Na2SO3 + KMnO4 = Na2SO4 + K2MnO4 + H2O (pH >,7 щелочная среда).
Видно, что изменение кислотности среды приводит к образованию различных продуктов из одного и того же вещества. Если кислотность среды изменяется, то это происходит и с другими реактивами, поступающими в ПОО. Аналогично, как и в приведенном выше примере, реакция с участием двух цветов CR2O72 будет протекать с образованием различных продуктов реакции в разных средах.
Метод электронного баланса сравнивает К.О.С. в левой и правой частях уравнения. Тип производимого вещества должен быть известен.
Окислительно-восстановительные реакции

Взаимодействие веществ, которое приводит к изменению состояния окисления элемента, называется реакцией восстановления (RR). Это изменение вызвано перераспределением электронов между реципиентом и донором.
Общее описание
РТР предполагает обмен людьми. Реципиент или окислительный фактор принимает электроны, а донор или восстановительный фактор возвращает их. Реципиент возвращается (приобретает недостающие электроны), а донор окисляется (электроны теряются). Эти этапы происходят одновременно и зависят друг от друга.
Обмен электронами происходит за границей. Это приводит к возникновению ковалентных связей.
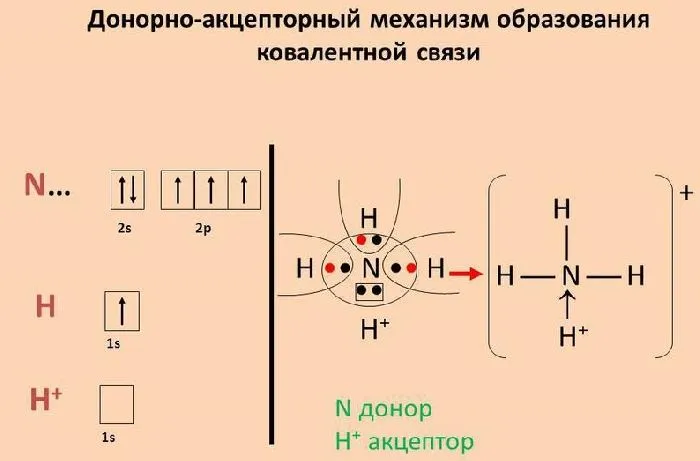
Рисунок 1.Механизм образования ковалентной связи между донором и приемником.
Под состоянием окисления понимается состояние человека, которое указывает на состояние окисления конкретного человека. Это значение не отражает фактическую нагрузку человека и используется для удобства расчета пенсии и формулы.
Состояние окисления записывается в виде числа в верхней части ячейки. Знаки плюс и минус указывают, является ли элемент восстановителем (+) или окислителем (-). Свободные элементы, которые являются простыми веществами, всегда имеют степень окисления «ноль».
Примеры окислительно-восстановительных реакций:.
- 2Mg 0 + O2 0 → 2Mg +2 O -2 (магний отдал два электрона, кислород – принял);
- H2 0 + F2 0 → 2H +1 F -1 ;
- 2Na 0 + Cl2 0 → 2Na +1 Cl -1 ;
- Cu +2 S +6 O4 -2 +Fe0 → Fe+2S +6 O4 -2 + Cu 0 .
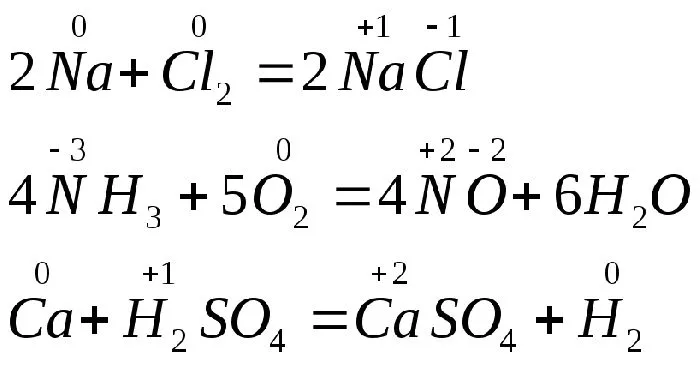
Рисунок 2.Пример записи уравнения ИЛИ.
Все металлы являются восстановителями. Они легко отдают внешние электроны и активно реагируют с неметаллами. Элементы с неметаллическими свойствами могут выступать в качестве восстановителей и окислителей, в зависимости от реакции. Значения могут быть взяты из определенных таблиц.
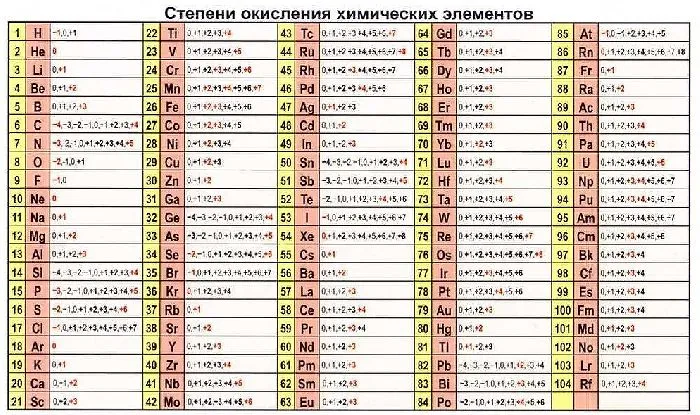
Рисунок 3.Таблица окислительных состояний элементов.
В ходе реакции степень окисления реципиента увеличивается, а донора — уменьшается.
Классификация
-
межмолекулярные – атомы окислителя и восстановителя находятся в молекулах разных веществ:
Процесс окисления (доставка электронов) записывается со знаком минус. Это указывает на количество электронов, приобретенных окислителем: S-2-2ē→S 0, Al0-3ē→Al+ 3, Fe+2-→→Fe+3. Восстановительные процессы (добавление электронов) записываются со знаком плюс: Mn +4+2ē→Mn+2, S 0+2ē→S-2, Cr+6+3ē→Cr+3.








