Учебники могут включать следующие вопросы. ‘Найдите массу 0,75 моль азота N2’. Начните с нахождения массы азота. Согласно таблице Менделеева, она составляет 14 г. Поскольку одна молекула состоит из двух лиц, масса молекулы азота как простого вещества равна 28, что дает массу 21 г для молекулы 0,75.
Как правильно рассчитать молярную массу в химии?
Молекулы — это маленькие частицы, массу которых невозможно измерить на обычной шкале. Для удобства ученые ввели термин «молекула». Отсюда происходит термин «молекулярный вес».
Молекулярная масса (m) — это масса моля, выраженная в г/моль. Во многих случаях это то же самое, что и относительный индивидуальный или молекулярный вес.
Как найти молярную массу в химии
- определение массы атома;
- умножение атомной массы на количество атомов;
- в сложных веществах суммирование всех масс атомов, умноженных на число атомов.
Задача. Найдите молекулярную массу фторида. f2.
- Решение. Атомная масса Аr Фторид f равен 19. Фторид — это газ.2 равна 38 г/моль.
Выпуск. Cacl Кальций кальция подошвенной массы2.
Учитывая химическую формулу, молекула хлорида кальция содержит два атома хлора, поэтому относительные индивидуальные веса хлора должны быть умножены на два.

Особенности молярной массы
Выпуск. Найдите молекулярную массу и относительную индивидуальную массу калия.
Решение. Индивидуальные веса элементов можно найти по журналу Дмитрия Ивановича Менделеева.
Поскольку калий К является металлом, а не газом, это означает, что индивидуальный вес не должен умножаться на какой-либо показатель.
Таким образом, относительный индивидуальный и молекулярный вес калия совпадают.
Выпуск. Рассчитайте относительную индивидуальную и молекулярную массу кислорода.
Решение. Рассчитайте относительную индивидуальную массу ar 16 для кислорода. Поскольку кислород является газом, относительную индивидуальную массу необходимо умножить на индекс 2.
Поэтому относительная атомная масса и молекулярный вес кислорода не одинаковы.
Если при постоянном давлении добавляется газ с большей молекулярной массой, плотность газовой смеси увеличивается; если добавляется газ с меньшей молекулярной массой, плотность газовой смеси уменьшается.
Урок 5. Моль и молярная масса
В уроке 5 «Молекулы и молекулярный вес» из цикла «Глупая химия» вы узнаете, как рассматривать молекулу как количественную единицу материи, определять число Авогадро, определять молекулярный вес и решать задачи, связанные с количеством Материя. Поскольку этот урок опирается на основы химии, рассмотренные в предыдущих курсах, рекомендуется временно посмотреть его еще раз, если вы изучаете химию с нуля.

Единица измерения количества вещества
Ранее в этом уроке мы обсуждали только отдельные молекулы и индивидуумы и выражали массу в терминах отдельных единиц массы. В реальной жизни работа с отдельными молекулами ничтожно мала, и поэтому ею невозможно манипулировать. Для этого химики взвешивают вещества, которые не являются A.U.M. Но в граммах.
Для перехода от шкалы молекулярного веса на лабораторные весы используется единица измерения количества вещества, называемая моль. Один моль содержит 6,022-10 23 частиц (индивидуальных или молекулярных) и является безразмерным. Число 6,022-10 23 называется числом Авогадро и определяется как количество частиц в 12 граммах 12 атомов углерода. (10 23).

Как уже упоминалось, термин «молекула» применяется не только к молекулам, но и к индивидуумам. Например, если мы говорим о молекулах соляра (ОН), то 6,022-10 означает, что 23 человека многочисленны. Аналогично, один моль воды (h2(O) 6,022-10 23 точечных количества. Однако чаще всего молекулы называют молекулами.
Молярная масса вещества
Молекулярная масса — это масса одного моля вещества, выраженная в граммах. Молекулярный вес моля любого химического вещества можно легко найти из таблицы Мендели, поскольку молекулярный вес численно равен индивидуальной массе, но имеет другую размерность (молекулярный вес имеет размерность Г/моль). Вычислить и сохранить рассчитанный молекулярный вес, количество вещества и число молекул.
- Молярная масса формула M=m/n
- Количество вещества формула n=m/M
- Число молекул формула N =Na·n
где m — масса вещества, n — число веществ (число молекул), m — молекулярная масса, n — число молекул и na — Число Авогадро. Благодаря молекулярному весу вещества химики могут измерять лабораторные особи и молекулы, просто взвешивая их. Это удобное использование понятия молекулы.
На этой диаграмме показаны четыре различные бутылки с веществом, каждая из которых содержит только один моль вещества. Вышеперечисленные типы можно использовать для повторной проверки.
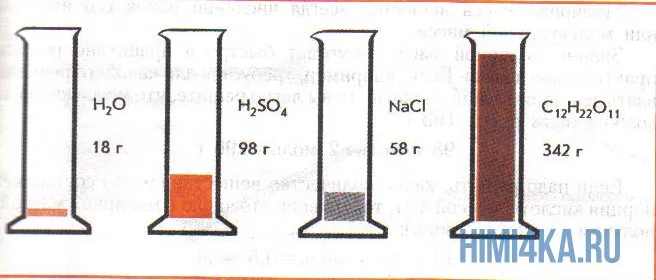
Доля массы рассчитывается по типу Ω (вещества) = m (вещества) / m (раствора). Полученное число показывает процент массы в виде одного процента, который вы можете умножить на 100 %, если хотите перевести его в проценты. Это показано в примере.
Решение задач по химии
Эта статья относится к базовой химической концепции, которую совершенно невозможно решить. Чтобы разобраться в этом вопросе, попробуйте понять концепцию натуральной величины.
В этой статье мы постараемся привести как можно больше примеров. Во время учебы вы найдете множество примеров на эту тему.

Относительные индивидуальные массы — ar
Масса человека, выраженная в индивидуальных единицах массы. Относительные индивидуальные веса приведены в D.I. Менделеев. Так, атом водорода имеет атомную массу = 1, кислорода = 16 и кальция = 40.
Соответствующая молекулярная масса равна mr
Относительный молекулярный вес — это сумма относительных индивидуальных весов всех элементов, входящих в состав вещества. Например, найдите соответствующие молекулярные веса кислорода, воды, перманганата калия и купоросной меди.
Моль и число Авогадро.
Это единица измерения вещества (в системе единиц СИ), которая определяется как количество вещества. 10 23.
Число Авогадро (постоянная Авогадро, na) — это число частиц (молекул, индивидов и ионов) в молекулах любого вещества.

Прежде всего, я хотел бы понять физическое значение изучаемой вами концепции. Молекула является международной единицей измерения количества вещества и указывает на число индивидов, молекул или ионов, содержащихся в определенной массе или количестве вещества. В молекуле любого вещества содержится 6,02 x 10 23 чел/молекула/ион — это самое важное, что нужно понять сейчас.
Иногда, если есть проблема, вам дадут число Авогадро и попросят найти количество кротовых нор. Количество вещества в химии символизируется n, n (эллинское «сердце»).
Вычислим, используя тип: n = n/na Это количество вещества из 3,01 x 10 23 молекул воды и 12,04 x 10 23 атомов углерода.
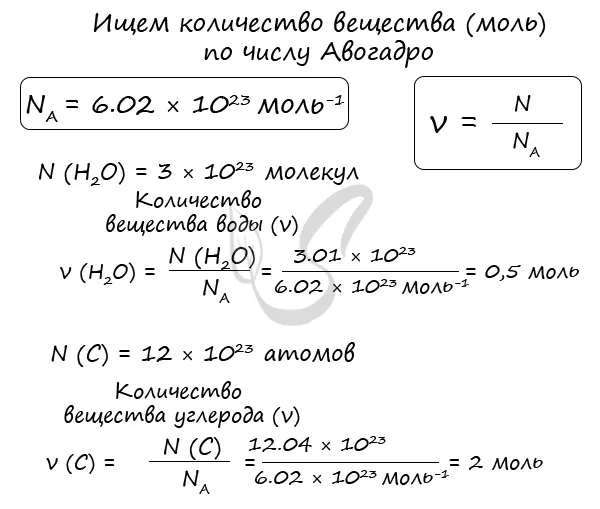
Мы нашли количество воды и углеродного вещества (моль). Это может показаться очень абстрактным, но без знания того, как использовать число Авогадро для нахождения количества вещества, невозможно решить задачу по химии.
Молекулярный вес — m
Молекулярная масса — это масса молекулы вещества, выраженная в «г/моль» (граммах/моль). Численно она совпадает с относительной молекулярной массой, изученной ранее.
Рассчитайте молекулярный вес Caco3, hcl и n2
m(hcl) = ar(h) + ar(cl) = 1 + 35,5 = 36,5 г/моль
м (н)2) = ar(n) x 2 = 14 x 2 = 28 г/моль
Полученные знания должны быть последовательной, а не грубой системой. Примечание: Вы только что рассчитали молекулярную массу, т.е. массу молекулы вещества. Вспомните число Авогадро.
Вы увидите, что хотя в одном моле присутствует одинаковое количество молекул (один моль вещества содержит 6,02 x 10 23 точек), они имеют разный молекулярный вес. Следовательно, 6,02 x 10-23 молекул n2 молекула весит 28 грамм, а такое же количество молекул HCl весит 36,5 грамм.
Это происходит потому, что хотя число молекул одинаково, их массы различны, так как 6,02 x 10 23- они имеют разные лица в своем составе.
Молекулярная масса — это масса молекул вещества. Молекула — это количество вещества, которое содержит определенное число мелких частиц, участвующих в химическом процессе. Число молекул в молекуле называется числом Авогадро. Эта величина постоянна и не изменяется.
Способы вычисления средней молярной массы газовой смеси

Здесь: молекулярное число газа, — молекулярный вес газа, — количество газа в АА (- небольшое количество газа в смеси газов.
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле:
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании и

При смешивании газов с разным молекулярным весом, при одинаковом давлении, средний молекулярный вес (при нулевом давлении) и плотность полученной газовой смеси принимает значение между молекулярным весом и плотностью газовой смеси. Например, во время смешивания

Если при постоянном давлении добавляется газ с большей молекулярной массой, плотность газовой смеси увеличивается; если добавляется газ с меньшей молекулярной массой, плотность газовой смеси уменьшается.
Закон объемных отношений
В химических реакциях отношение количества реагирующего газа к количеству образующегося газа равно отношению коэффициентов. Например:.
Арифметические соотношения опухолей, молекул и молекул равны друг другу.
Следующие расчеты могут быть выполнены для смесей


3) Отношение двух массовых коэффициентов газа:.
Чтобы скопировать материал с сайта evkova.org, посетите www.evkova.orgにアクティブリンクが必要です.
Сайт был создан группой преподавателей некоммерческой организации по дополнительному обучению молодежи.
Сайт написан, поддерживается и управляется группой учителей
Telegram и логотип Telegram являются торговыми марками Telegram Corporation FZ-LLC.
Данный сайт предназначен для информационных целей и ни в коем случае не является публичным тендером, как это определено в статье 437 Гражданского кодекса Российской Федерации. Анна Евкова не оказывает услуг.
Решение: молекулярная масса (индивидуальные единицы массы) веществ, перечисленных в таблице Менделеева. Каждое названное вещество имеет следующие массы.
Что такое молярная масса?
Основателем теории индивидуальных масс был ученый Дальтон, который составил таблицу индивидуальных масс и рассматривал кусок водорода как единицу.
Молекулярная масса — это масса молекул вещества. Молекула — это количество вещества, которое содержит определенное число мелких частиц, участвующих в химическом процессе. Число молекул в молекуле называется числом Авогадро. Эта величина постоянна и не изменяется.

Рисунок 1.Типы чисел Авогадро.
Таким образом, молекулярная масса вещества — это масса молекул, содержащих 6,02*10^23 элементарных частиц.
Число Авогандро названо в честь итальянского ученого Амедео Авагандро. Он показал, что число молекул одного и того же количества газа всегда одинаково.
Молекулярный вес в международной системе СИ измеряется в кг/моль, но обычно выражается в граммах/моль. Это количество обозначается английской буквой М. Формула молекулярного веса такова
где m — масса вещества, а v — количество вещества.

Рисунок 2.Расчет молекулярной массы.
Как найти молярную массу вещества?
Чтобы рассчитать молекулярный вес вещества, используйте таблицу Менделеева. Возьмем такое вещество, как серная кислота, формула которой имеет вид2 Итак.4. Затем перейдите к таблице, чтобы узнать атомный вес каждого компонента кислоты. Серная кислота состоит из трех элементов: водорода, серы и кислорода. Атомные массы этих элементов равны 1, 32 и 16 соответственно.
Видно, что общая молекулярная масса равна атомной массе 98 единиц (1 * 2 + 32 + 16 * 4). Таким образом, масса одной молекулы серной кислоты равна 98 граммам.
Если составными частями вещества являются молекулы, то молекулярный вес вещества численно равен его относительному молекулярному весу. Если составными частями вещества являются атомы, молекулярная масса вещества может быть равна относительной атомной массе.
До 1961 года атом кислорода рассматривался как единица атомной массы, но 1/16 часть атома, а не весь атом. Однако химические и физические единицы массы не были одинаковыми. Химическая масса была на 0,03% выше физической.
Сегодня в физике и химии используется единая система измерений. Стандартная э.м.с. 1/12 часть массы атома углерода.

Рисунок 3.Формула единиц атомной массы углерода.
Молекулярный вес газов и паров можно измерить очень легко. Достаточно использовать контроль. Газообразное вещество того же объема будет иметь ту же массу, что и другое вещество при той же температуре. Известный метод измерения количества пара заключается в определении объема воздуха, который отталкивается. Такая процедура выполняется с помощью бокового выхода, ведущего к измерительному устройству.
Понятие молекулярного веса очень важно в химии. Его расчет необходим для создания макромолекулярных комплексов и многих других реакций. Фармацевты используют молекулярный вес для определения концентрации конкретного вещества внутри вещества. Молекулярный вес также важен для биохимических исследований (элементарный обмен).
Сегодня, благодаря достижениям науки, известен молекулярный вес почти всех компонентов крови, включая гемоглобин.
Вам предлагается самостоятельно решить следующую задачу (решение ниже): «Найти молекулярную массу неизвестного вещества, плотность неизвестного вещества по кислороду равна 3,5».
Молярная масса

Этот видеоклип поможет учащимся узнать, что такое молекулярный вес и как его измеряют. С помощью этого курса нетрудно научиться использовать молекулярный вес для решения задач. Это связано с тем, что подробные объяснения и решения являются проблематичными.

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к видеоурокам этого и других комплектов, необходимо приобрести их в каталоге и добавить в личный кабинет.


Конспект урока «Молярная масса»
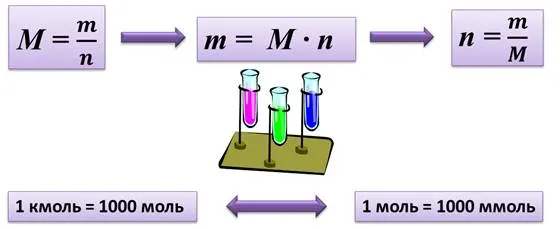
Масса молекул вещества — это его молекулярный вес. Молекулярная масса — это также физическая величина, равная отношению между массой и количеством вещества. Поэтому молекулярный вес численно равен относительному молекулярному весу, но в отличие от него существует одна единица измерения — г/моль или кг/моль.
Поэтому молекулярный вес может быть определен с помощью следующего уравнения
М =
Поэтому остальные уравнения также применимы.
m = n-M
n =
Количество вещества можно измерить в киломолях и миллимолях, а также в молях. Так, 1 киломоль = 100 0моль — 1 моль = 100 млмоль. молекулярные веса также имеют соответствующие названия. Тысячелетние массы и их единицы — кг/кмоль, а тысячелетние — мг/моль.
Используйте новые типы для решения проблемы.
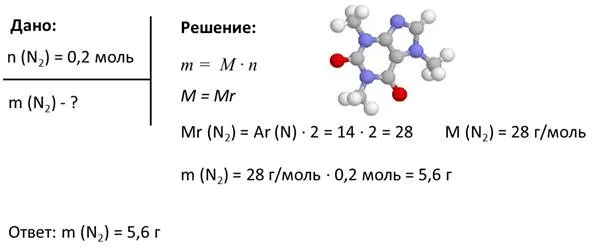
1. найти массу n2 а количество вещества составляет 0,2 моль.
В нашем термине дано количество вещества азота 0,2 моль. Мы должны найти его массу. Чтобы решить эту задачу, мы используем данный тип для нахождения массы количества вещества. Для этого, однако, нам необходимо знать молекулярный вес азота, который равен относительному молекулярному весу. Чтобы найти его, умножьте относительные индивидуальные веса азота на два, так как в молекуле их два. Замените значения и получите результат 28. Это связано с тем, что относительная молекулярная масса равна 28. Таким образом, молекулярная масса составляет 28 г/моль. Поскольку теперь легко найти массу, мы умножаем молекулярную массу на количество вещества, т.е. 28 г/моль х 0,2 моль. Результат — 5,6 г. Таким образом, масса 0,2 моль азота составляет 5,6 г.
2. найти количество вещества SIO2 Масса составляет 120 г.
В нашей постановке задачи дана масса вещества — 120 г. Мы должны найти его количество. Чтобы решить задачу, используйте этот тип для нахождения количества вещества на массу. Однако для этого нам необходимо знать молекулярный вес SIO2. Для этого найдите относительную молекулярную массу. Увеличьте относительный индивидуальный вес кремния в два раза по отношению к относительному атомному весу кислорода. Удалите значение, чтобы получить 60. Таким образом, молекулярная масса составляет 60 г/моль. Теперь вы также можете найти количество вещества. Для этого можно разделить 120 г на 60 г/моль. В результате получается 2 моль. Это означает, что масса 2 моль SIO2 120 g.








