Оксиды бария, свинца и бора добавляются в огнеупорные стекла специального назначения с высокой механической прочностью. Витражное стекло изготавливается путем добавления оксида кобальта (синее стекло) и оксида хрома (зеленое стекло), а оксид свинца используется для изготовления хрустального стекла.
Как получить оксид кремния
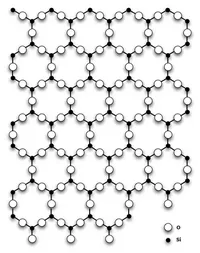
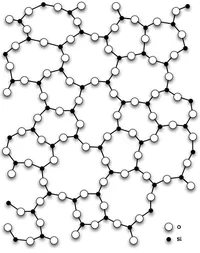
Диоксид кремния (оксид кремния (IV), диоксид кремния, SiO2) представляет собой бесцветный кристалл, tТемпература плавления. 1713-1728°C, обладает высокой твердостью и прочностью.
Содержание
- Относится к группе кислотных оксидов.
- При нагревании взаимодействует с основными оксидами и щелочами.
- Растворяется в плавиковой кислоте.
- SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образованию переохлажденного расплава — стекла.
- Один из лучших диэлектриков (электрический ток не проводит).
Диоксид кремния имеет несколько полиморфных модификаций.
Наиболее распространенным является альфа-бумага, которая кристаллизуется в треугольных сварных швах.
В нормальных условиях диоксид кремния чаще всего встречается в виде полиморфного альфа-рабита, который обратимо преобразуется в бета-рабита при температуре выше 573°C. При дальнейшем повышении температуры кварц преобразуется в тридимит и кристобалит. Эти полиморфные модификации стабильны при высоких температурах и низких давлениях. При высоких температурах и давлениях диоксид кремния сначала превращается в корсит, а затем в стисовит (впервые найденный на месте ядерных взрывов). Согласно некоторым исследованиям, стисовит занимает большую часть мантии, поэтому вопрос о типе SiO2 является самым распространенным на Земле, и до сих пор нет окончательного ответа.
Существует также аморфная модификация — кварцевое стекло.
Химические свойства.
Диоксид кремния SiO2 -кислотный оксид, который не реагирует с водой.
Химически устойчив к кислотам, но реагирует с плавиковой кислотой: реагирует с плавиковой кислотой.
Эти две реакции широко используются при травлении стекла.
Для SiO2 щелочными и основными оксидами, а также с карбонатами активных металлов, он образует силикаты — очень слабые нерастворимые в воде силикаты с общей формулой xH2O-ySiO2 (на самом деле это одно и то же, но в литературе часто упоминается как кремниевая кислота, а не кремниевая кислота).
Например, ортосиликат натрия может быть получен следующим образом
Смесь силиката кальция и натрия:.
Из силиката натрия.2O-CaO-6SiO2 используется для изготовления оконного стекла.
Следует отметить, что большинство силикатов не имеют стабильного состава. Из силикатов только силикат натрия и силикат калия растворимы в воде. Водные растворы этих силикатов называются растворимыми стеклами. Вследствие гидролиза эти растворы характеризуются сильно щелочной средой. Для гидролизованных силикатов характерно образование коллоидных, а не реальных растворов. Подкисление растворов силиката натрия или калия приводит к выпадению желатиноподобного белого осадка гидратированной кремниевой кислоты.
SiO4/2Группа SiO, в которой атом Si окружен тетраэдром из четырех атомов кислорода O. Каждый атом кислорода связан с двумя атомами кремния. SiO4/2 Могут быть соединены между собой различными способами. В силикатах, SiO4/2 фрагменты — это острова, цепи, ленты, многослойные слои и скелеты.
SiO2 используется в производстве интегральных схем, различных электронных компонентов и волоконной оптики, что обеспечивает стабильную работу этих устройств.
Кремний
Кремний — неметаллический элемент группы IVa периодической таблицы D.I. Менделеев. Второй по распространенности элемент в земной коре после кислорода.
В чистом виде он практически не встречается в природе. Чаще всего он встречается в виде диоксида кремния — SiO2 -песок, песчаник, кварц и глина.

Кремнезем (кремний) Долина.
Регион в Калифорнии (США), характеризующийся высокой концентрацией высокотехнологичных компаний, занимающихся производством компьютеров и микропроцессоров.
Кремний является природным полупроводником и основным материалом, используемым для изготовления микросхем. Кремний ближе, чем вы думаете: в гаджетах, которыми вы пользуетесь 😉

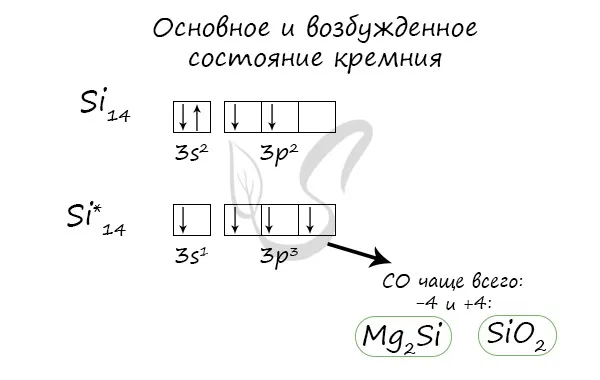
Основные возбужденные состояния кремния
Когда атомы кремния возбуждены, электроны в s-подложке испаряются, и один из них перемещается на p-подложку.
Природные соединения
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист

Состав.
Промышленный кремний производится путем восстановления кремния в электропечи с использованием алюмотермита.
В лаборатории мелкий белый песок прокаливают с магнием.
Химические свойства.
При нормальных условиях кремнезем реагирует только с фтором без нагревания.
При нагревании кремний вступает в реакцию с другими галогенами (Cl, Br, I), углеродом и кислородом. При очень высоких температурах (1200°C) кремний реагирует с кислородом, образуя оксид кремния II, бессолевой оксид.

В этих реакциях кремний проявляет свою окислительную способность.
Ca+Si → Ca2Si (силикозид кальция).
С целью травления (удаления поверхностного слоя материала) изделия из кремния можно погрузить в щелочной раствор.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомную структуру и является очень прочным и твердым. Он плавится при температуре +1730°C.
В промышленных процессах кремний нагревают в атмосфере кислорода для получения оксида IV.
Силикат натрия реагирует с уксусной кислотой в лаборатории. Кремниевая кислота быстро разлагается до SiO2осадки и вода.

С химической точки зрения, SiO2 кислотостойкий, но реагирует с газообразным фтористым водородом (газообразный) и плавиковой кислотой (жидкий).
SiO2 Кислотный оксид, соответствующий кремниевой кислоте. Реагирует с основными оксидами и щелочами с образованием кислых солей, называемых силикатами.

Реакция оксида кремния IV с карбонатами происходит еще реже, поскольку большинство кислотных оксидов не реагируют с солями.
По внешнему виду оксид кремния представляет собой прозрачный кристалл. Его плотность составляет 2,648 г/см³. Оксид кремния начинает плавиться при +1600°C и закипает при +2230°C.
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) представляет собой твердое атомарное кристаллическое вещество. В природе он встречается в виде кварца, речного песка, диоксида кремния и других модификаций.

Химические свойства
Оксид кремния (IV) является типичным кислотным оксидом. Окисляется слабо за счет окисления при +4°C.
Будучи кислотным оксидом, кремнезем (IV) реагирует с щелочными растворами и плавится, вступая в реакцию с основными оксидами в расплаве. В этом случае образуются силикаты.
Например, диоксид кремния реагирует с гидроксидом калия.
Другой пример: диоксид кремния взаимодействует с оксидом кальция.
SiO2 +CaO → CaSiO.3
Оксид кремния (IV) не реагирует с водой, поскольку кремниевая кислота нерастворима.
Оксид кремния (IV) вступает в реакцию при сплавлении с карбонатами щелочных металлов. Общее правило заключается в том, что менее летучий оксид заменяет наиболее летучий оксид из соли во время легирования.
Например, оксид кремния (IV) реагирует с карбонатом калия. В результате образуется силикат калия и диоксид углерода. 4:
4Диоксид кремния реагирует только с плавиковой кислотой или газообразным фтористым водородом.
При температуре выше 1000°C оксид кремния реагирует с активными металлами, образуя кремний.
Например, оксид кремния реагирует с магнием с образованием оксида кремния и магния.
SiO2 + 2mg → Si + 2mgo
Здесь вы можете посмотреть видео с реакцией кремния (IV) с магнием.
Основатель образуется над восстановительным фактором.
SiO2 + 4mg → mg2Si + 2mgo
6. оксид кремния (IV) реагирует с неметаллами.
Например, оксид кремния (IV) реагирует с водородом в строгих условиях. Поэтому оксид кремния обладает окислительными свойствами.
Другой пример: оксид кремния реагирует с углеродом. В результате образуется угарный газ:.
SiO2 + 3C → SIC + 2CO
Оксид кремния вступает в реакцию с фосфатом кальция и углеродом.
Кремниевая кислота
Строение молекулы и физические свойства
Филаментные кислоты — это очень слабые, растворимые в воде соединения распространенного типа NSIO2-MH2O. Он образует коллоидные растворы в воде.

Метаклинонит h2SiO3 Он находится в растворе в виде полимера:.

Способы получения
Нитрокислоты образуются в результате воздействия сильных кислот на растворимые силикаты (силикаты щелочных металлов).
Например, когда соляная кислота действует на кремнефтористый натрий:.
Na2 сио.3 + 2 HCl → H2 сио.3 + 2 NaCl
Видеоролик, демонстрирующий опыт производства силиката натрия, можно посмотреть здесь.
Даже слабые карбоновые кислоты вытесняют кремниевую кислоту из соли:.
Химические свойства.
1. кремниевая кислота нерастворима. Его кислотные свойства настолько слабы, что кислота реагирует только с сильными основаниями и их оксидами.
Например, нитчатые кислоты реагируют с плотным гидроксидом калия.
2.При нагревании кремниевая кислота разлагается на оксиды и воду.
Силикаты
Силикаты являются солями соляной кислоты. Большинство силикатов нерастворимы в воде, за исключением силикатов натрия и калия, известных как «жидкие стекла».
Методы получения силикатов:.
1. растворение кремния, кремниевой кислоты или оксидов в щелочи:.
2. сплавление с основными оксидами:.
као + сио2 → касио.3
3. взаимодействие с растворимыми силикатами и солями:.
Оконное стекло (натриевое стекло) — натрий кремний и кальций: na2O-CaO-6SiO2 .
Стекло получают путем сплавления в специальной печи смеси соды NA2co3и известняковое како3 и белый песок.2:.
При производстве специальных стекол используются различные добавки. Стекло, содержащее ионы Pb 2+ — кристалл — CR 3+ — зеленый — Fe 3+ — коричневый стеклянная бутылка — Co2+ — синий — Mn 2+ — дает красновато-фиолетовый цвет.
Силикагель проглатывается путем высушивания силикагеля. Он менее чистый, чем силикагель, но может иметь очень хорошо развитую поверхность до 320 м²/г.
Монооксид
Тип оксида кремния (II) — SIO. Это вязкое вещество, похожее на смолу. Он остается аморфным и не окисляется в обычных условиях. Он не образует солей и не проводит электричество.

Рисунок 1.Монооксид кремния.
Произведенный оксид2. : В
-
нагреванием (температура выше 400°C) кремния при недостатке кислорода:
В твердом состоянии фрагменты монооксида представляют собой темно-коричневые порошки. Они сильно инертны в кислотных реакциях. Они растворимы в гидрофильных кислотах.
Химические свойства монооксида кремния:.
-
разлагается при нагревании:
Монооксид не встречается в природе на Земле. Однако монооксид газа является компонентом облаков межзвездной пыли.
Диоксид
Оксид кремния (IV) — SIO2. Это твердый кристаллический огнеупорный материал, нерастворимый в воде. Он не влияет на электричество.
Песок, кварц, каменные кристаллы, яшма, агат, аметист и другие горные породы имеют диоксидный тип. Диоксид составляет 87% литосферы.

Рисунок 2.Яшма.
Диоксид кремния имеет немолекулярную структуру. Кристаллическая решетка состоит из атомов кремния и кислорода, связанных ковалентными связями. Каждый кремний связан с четырьмя атомами кислорода, а каждый кислородный человек связан с двумя кремниями.
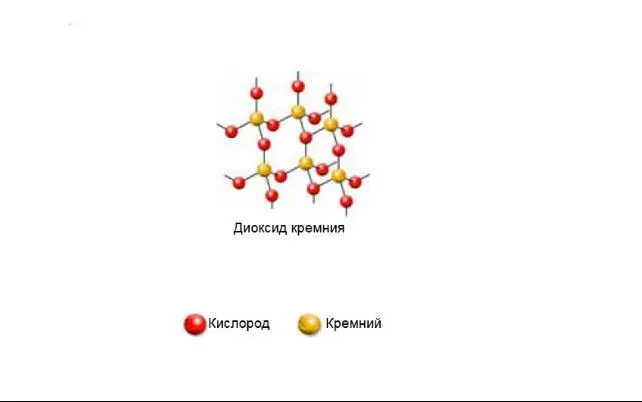
Рисунок 3.Схема кристаллической решетки диоксида кремния.
Диоксид может быть получен в лаборатории при нагревании кремния при температуре 400-500°C в присутствии кислорода.
Диоксид образуется под действием кислот в растворимых силикатах. Образующаяся нитчатая кислота разлагается на воду и диоксид:.
В нормальных условиях они реагируют только с гидрофильными кислотами. При нагревании реагирует со щелочами и основными оксидами. Не вступает в реакцию с водой. Основные свойства с химическими формулами приведены в таблице.
AC.
Реагирует с водородом и углеродом с образованием кремния и карболида, соответственно
Он реагирует на температуры выше 1000°C путем образования кремния. В избытке он реагирует с металлами, образуя огнестрельное оружие.
При нормальных условиях реагирует с газами и гидрофильными кислотами
Вступает в реакцию с образованием силикатов
Реагирует с высокими температурами
С карбонатом щелочных металлов
Реагирует при нагревании
Диоксид кремния используется для производства стекла, силикагеля и бетона.
В виде кислотных оксидов2 Реагирует при нагревании или сплавлении с рассолами, щелочами и некоторыми солями, образуя силикаты и некоторые соли. Например:.
Кремний

Процессоры; песок; какие ассоциации у вас вызывает это слово? Или в Кремниевой долине? В любом случае, мы сталкиваемся с кремнием каждый день, поэтому если вы хотите узнать, что такое Si и почему его используют, заходите в шапку.
Как студент одного из московских вузов, специализирующихся на наномилии, я хотел представить вам, дорогой читатель, самое важное химическое вещество на нашей планете. С чего я начал — с угля или кремния, и все же решил заглянуть в SI. Ведь сердце каждого современного гаджета, конечно же, основано на том, как его можно собрать. Написав этот материал, который в основном рассчитан на новичков, я стараюсь изложить свои идеи в очень простой и легкой форме, но даже более продвинутые люди могут почерпнуть из него что-то интересное. Итак, давайте начнем.
Silicium

Силиций, SI, химический элемент IV группы Менделеевского журнала, атомный номер 14, атомный вес 28,086; в природе элемент представлен тремя постоянными изотопами: 28SI (92,27%), 29SI (4,68%) и 30SI (3,05%). Плотность (A.S.V.) 2,33 г/см³ Температура плавления 1688 K
Соединения кремния широко распространены на Земле и известны человеку с каменного века. Использование каменных инструментов для работы и охоты заняло тысячи лет. Использование кремния для обработки — изготовление стекла — началось примерно в 3000 году до нашей эры. (в Древнем Египте). Первым известным соединением кремния был оксид SiO2 (диоксид кремния). В 18 веке диоксид кремния считался простым твердым веществом и назывался «землей» (это отражено в его названии). Сложность состава диоксида кремния была определена Дж. В 1825 году он первым получил элементарный кремний из фторида Sif4 и восстановил его металлическим калием. Новый элемент был назван «кремний» (от латинского silex — камин). Русское название было дано Г. И. Гессом в 1834 году.

Кремний, по сути, очень широко распространен в составе обычного песка.
С химической точки зрения, SiO2 кислотостойкий, но реагирует с газообразным фтористым водородом (газообразный) и плавиковой кислотой (жидкий).
Силикаты и их значение
Силикатные соли (NSIO2-MH2O) практически нерастворимы в H2O. Исключение составляют силикаты калия и натрия, которые обычно называют жидкими стеклами. В случае NSIO2-MH2O характерны все свойства средней соли. Кремний реагирует с кислотами, в результате чего образуется нерастворимая кремниевая кислота. Na2Sio3 + 2HCl = 2NACL + H2SIO3. Карбоновые кислоты действуют аналогичным образом. Химическую реакцию можно выразить так: Na2Sio3 + CO2 + H2O = Na2CO3 + H2SIO3↓.
Силиконы часто встречаются в природе. Их свойства могут сильно варьироваться в зависимости от принципов их состава и структуры. Силикаты часто имеют красивую окраску и поэтому пользуются большим спросом в индустрии драгоценных камней (изумруды, гранаты, топазы).
Стекло, как мы все знаем, также является силикатом. Его состав можно представить следующим образом: na2o*cao*6sio2. После сплавления смеси известняка, белого песка и соды в специальной печи получается прочное и долговечное стекло. Для получения более интересных сортов и цветов стекла можно использовать различные добавки: CO2+ (синее), PB2+ (кристаллическое), SK3+ (зеленое).
Сферы применения
Оксид кремния может иметь различные полиморфные состояния, что приводит к высокому спросу на него в разных регионах. Чаще всего он используется в следующих областях

- микроэлектроника и радиотехника;
- авиастроение;
- производство косметических средств;
- серийное изготовление строительных материалов;
- пищевая промышленность;
- медицинская отрасль;
- производство прочной резины;
- изготовление высококачественного сантехнического оборудования;
- текстильная промышленность;
- изготовление различных ювелирных изделий.
Кварцевый песок пользуется большим спросом в строительной отрасли, так как используется в производстве бетона, железобетона и цементных изделий. Производство огнеупоров и диэлектриков было бы невозможно без этого материала. Кварцевый песок используется для производства керамики и стекла.
В косметологии активно используются хроматографы и специальные аппараты для очистки кожи ультразвуковыми волнами.

SiO2 используется в производстве интегральных схем, различных электронных компонентов и волоконной оптики, что обеспечивает стабильную работу этих устройств.
Лабораторные исследования показали, что диоксид кремния совершенно безопасен для человеческого организма. SiO2 не проникает в кровь через слизистые оболочки пищеварительной системы и выводится самопроизвольно. Однако чрезмерное употребление продуктов, содержащих пищевую добавку Е551, чревато серьезными ухудшениями в работе желудочно-кишечного тракта.
Во Франции исследования показали, что умеренное использование продуктов SIO2 может помочь снизить вероятность развития болезни Альцгеймера на 10%. Если название оксида относится к составу препарата, его следует принимать только после предварительной консультации с врачом. Таким образом, риск неблагоприятного воздействия на организм может быть снижен.








