Вода экстрагируется из спирта в присутствии концентрированной серной кислоты. Процесс дегидратации протекает в двух возможных направлениях: внутримолекулярная дегидратация и внутримолекулярная дегидратация.
Этанол
Этанол (этиловый спирт, метилкарбинол, виниловый спирт или алкоголь, часто просто «спирт») — это одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), или: CH3-CH2-OH, второй член гомологического ряда одноатомных спиртов, обычно представляет собой летучую, легковоспламеняющуюся, бесцветную, прозрачную жидкость.
Этиловый спирт также используется в качестве топлива, растворителя и наполнителя в спиртовых термометрах.
Топливо
Этанол может использоваться в качестве топлива для ракетных двигателей (например, этанол использовался в качестве топлива в немецкой V-2, первой в мире баллистической ракете непрерывного действия) и чистых форм двигателей внутреннего сгорания. Он ограничен из-за своей гигроскопичности (хлопья) и используется в смесях с классическим жидким нефтяным топливом. Он используется для производства этилтрет-бутилового эфира, компонента высококачественного топлива и бензина. Этил трет-бутиловый эфир менее зависим от неорганических веществ, чем МТБЭ.
Химическая промышленность
- служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- является компонентом антифризов и стеклоомывателей;
- в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина


- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.; настоек и экстрактов (минимальная концентрация 18 %);
- пеногаситель при подаче кислорода, искусственной вентиляции легких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания) 5 ;
- компонент общей анестезии в ситуации дефицита медикаментозных средств;
- как пеногаситель при отеке легких в виде ингаляции 33 % раствора;
- этанол является противоядием при отравлении некоторыми токсичными спиртами, такими как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты) 6 .
Парфюмерия и косметика
Это универсальный растворитель для широкого спектра веществ, из которых он является основным ингредиентом в духах, одеколонах и аэрозолях. Он используется в зубной пасте, шампунях, средствах для душа и многих других продуктах.
Пищевая промышленность
Вместе с водой он является основным ингредиентом алкогольных напитков (например, бока, виски, джина и пива). Он также содержится в небольших количествах в некоторых напитках, полученных путем брожения, но не классифицируемых как алкогольные (например, кефир, квас, кумыс, безалкогольное пиво). Содержание свежего кефира в этаноле ничтожно мало (0,12%), но в долгосрочной перспективе может достигать 1%, особенно в жарких районах. Кумыс содержит от 1% до 3% этанола (крепкий кумыс — до 4,5%), а квас — от 0,5% до 1,2%.
Мировое производство этанола
Производство этанола по странам, млн. литров. Данные с сайта ethanolrfa.org.
| Страна | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010est |
|---|---|---|---|---|---|---|---|
| США | 13 362 | 16 117 | 19 946 | 24 565 | 34 776 | 40 068 | 45 360 10 |
| Бразилия | 15 078 | 15 978 | 16 977 | 18 972,58 | 24 464,9 | ||
| Евросоюз | — | — | — | 2 155,73 | 2 773 | ||
| Китай | 3 643 | 3 795 | 3 845 | 1 837,08 | 1 897,18 | ||
| Индия | 1 746 | 1 697 | 1 897 | 199,58 | 249,48 | ||
| Франция | 827 | 907 | 948 | — | — | ||
| Германия | 268 | 430 | 764 | — | — | ||
| Россия | 760 | 860 | 608 | 609 | 536 | 517 | 700 |
| ЮАР | 415 | 389 | 387 | — | — | ||
| Великобритания | 400 | 351 | 279 | — | — | ||
| Испания | 298 | 298 | 463 | — | — | ||
| Таиланд | 279 | 298 | 352 | 299,37 | 339,4 | ||
| Колумбия | — | — | 279 | 283,12 | 299,37 | ||
| Весь мир : | 40 710 | 45 927 | 50 989 | 49 524,42 11 | 65 527,05 |
Вода экстрагируется из спирта в присутствии концентрированной серной кислоты. Процесс дегидратации протекает в двух возможных направлениях: внутримолекулярная дегидратация и внутримолекулярная дегидратация.
Этанол
Этанол (этиловый спирт) — это бесцветная, легковоспламеняющаяся жидкость со спиртовым запахом (структура молекулы показана на рисунке 1).
Он смешивается с водой в любых пропорциях и образует с водой азеотропную смесь (смесь определенного состава, которая кипит при определенной температуре, называется азеотропной смесью). Безводный этанол называется абсолютным спиртом, его температура плавления составляет 78,37°C.
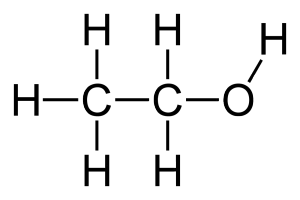
Рисунок 1.Структура молекулы этанола.
Таблица 1.Физические свойства этанола.
Температура плавления, o C
Химические свойства этанола
Химические реакции, характерные для этанола, включают в себя разрыв связей.
Основное применение этанол находит в промышленных органических композициях. Он также используется в медицине для приготовления красителей и экстрактов, а в медицинской практике — как наружное дезинфицирующее средство для дезинфекции рук и хирургических инструментов.
Примеры решения задач
| Задание | В пропанол-1 поместили металлический натрий. К реакционной смеси добавили бромэтан. Какое вещество при этом образуется. Составьте уравнения протекающих реакций. |
| Ответ | При действии металлического натрия на пропанол-1 образуется соединение подобное соли, называемое алкоголятом: |
При последующем добавлении бромэтана в реакционную смесь образовалась простая реакция Вильямсона (пропилэтиловый эфир).
Этилен → этанол → диэтиловый эфир → йодоэтан → бутан.
Укажите условия, при которых происходит реакция.
Спирты способны к межмолекулярной дегидратации и образуют сложные эфиры. Реакция протекает под воздействием реагента, удаляющего воду. Серная кислота:.
Когда гидрат йода действует на кислую среду, он распадается на йодоганы и этанол.
Этанол, полученный путём гидратации этилена или брожением, представляет собой водно-спиртовую смесь, содержащую примеси. Для его промышленного, пищевого и фармакопейного применения необходима очистка. Абсолютный спирт
Химические свойства этанола
Спирты — это органические вещества, молекулы которых содержат одну или несколько гидроксильных групп OH, отличных от углеводородных цепей.
1. кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Когда этанол реагирует с щелочным раствором, реакция протекает почти без изменений, так как образовавшийся спирт почти полностью гидролизуется водой.
Немедленной реакции не происходит, так как баланс этой реакции смещается в основном влево. Поэтому этанол не вступает в реакцию с щелочными растворами.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этанол взаимодействует с активными минералами (щелочными и щелочноземельными).
| Например, этанол взаимодействует с калием с образованием этилата калия и водорода . |

Под воздействием воды спирт полностью гидролизуется, выделяя спирты и гидроксиды металлов.
| Например, этилат калия разлагается водой: |
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
Когда спирт взаимодействует с галогенированными углеводородами, группы OH замещаются галогенами, образуя галогенированные АС.
| Например, этанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Спиртовая гидроксильная группа может быть заменена аминной группой при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии этанола с аммиаком образуется этиламин. |
2.3. Этерификация (образование сложных эфиров)
Простые полиспирты реагируют с карбоновыми кислотами с образованием сложных эфиров.
| Например, этанол реагирует с уксусной кислотой с образованием этилацетата (этилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты также реагируют с неорганическими кислотами. Нитрат или серная кислота.
| Например, при взаимодействии этанола с азотной кислотой образуется сложный эфир этилнитрат : |
Вода экстрагируется из спирта в присутствии концентрированной серной кислоты. Процесс дегидратации протекает в двух возможных направлениях: внутримолекулярная дегидратация и внутримолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высоких температурах (выше 140°C) происходит внутристеночная дегидратация и образуются соответствующие алкены.
| Например, из этанола под действием концентрированной серной кислоты при температуре выше 140 градусов образуется этилен: |
Он смешивается с водой в любых пропорциях и образует с водой азеотропную смесь (смесь определенного состава, которая кипит при определенной температуре, называется азеотропной смесью). Безводный этанол называется абсолютным спиртом, его температура плавления составляет 78,37°C.
Как делают

Сегодня промышленное производство этанола осуществляется в четыре этапа.
- подготовка и измельчение углеводного сырья (зерна или фруктов);
- ферментация, т.е. расщепление крахмала до сахаров;
- брожение — собственно накопление в браге спирта;
- брагоректификация — выделение этанола с помощью специальных аппаратов.
Чистый алкоголь предоставляется на всех уровнях здравоохранения. Однако его запрещено продавать в магазинах и аптеках без рецепта врача. По федеральному закону. 171 государство исключило его из категории «алкогольной продукции». Теперь препарат можно приобрести только по рецепту врача.
Две 2SP 3-правительственные орбитали участвуют в образовании химических связей с индивидами C и H, а еще две 2SP 3-правительственные орбитали заняты неразрывными парами электронов кислорода.
Физические свойства
ШОУ: При нормальных условиях представляет собой бесцветную летучую жидкость с характерным запахом. Распространенные ошибки, которых следует избегать: часто смешиваются выкупные спирты со свойствами 95,57% спирта. Их свойства практически идентичны, но цены начинают различаться с третьей по четвертую значащую цифру.
Свойства этанола.| Температура плавления | −114,15 °C |
| Температура кипения | 78,15 °C |
| Растворимость | смешивается с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
Смесь 95,57% этанола + 4,43% воды является вредителем. Это означает, что он не отделяется во время дистилляции.
Химические свойства
Он реагирует со щелочными металлами, образуя этил (или обычные спирты) и водород.
Наркотические свойства
Существует разница между химическим фармакологическим определением и юридическим определением наркотических свойств этанола. С химико-фармакологической точки зрения этанол обладает наркотическими свойствами, но с юридической точки зрения этанол не считается наркотиком, однако в некоторых технических юридических документах есть ссылки на наркотические свойства.
Ссылки на фармакологические свойства этанола можно найти во многих руководствах по фармакологии, специализированных медицинских и химических словарях2 и энциклопедиях. 3 Таким образом, химико-фармакологические определения, полученные из учебников по фармакологии, под ред. В. В. Аничкова, М. Л. Беленького, Ситуация.
Этиловый спирт, Spiritus Vini (C2H5OH), благодаря своим фармакологическим свойствам относится к жирным спиртам.
Наркотические свойства этанола проявляются также в характерном для алкоголя возбуждении и последующем торможении функций центральной нервной системы, включая тормозные центры.
Аддиктивный характер воздействия этанола подтверждается также тем, что алкоголизм, являющийся формой зависимости от этанола, рассматривается как форма наркомании.
Применение
Топливо
Этанол можно использовать в качестве топлива для ракетных двигателей, чистых форм двигателей внутреннего сгорания и т.д. Он ограничен из-за своей гигроскопичности (хлопья) и используется в смесях с классическим жидким нефтяным топливом. Он используется в производстве этил-трет-бутилового эфира, высококачественного топлива и компонента бензина. Этил трет-бутиловый эфир менее зависим от органических минералов, чем МТБЭ.
Химическая промышленность
- Служит сырьём для получения многих химических веществ, таких, как ацетальдегид, диэтиловый эфир, тетраэтилсвинец, уксусная кислота, хлороформ, этилацетат, этилен и др.;
- Широко применяется как растворитель (в лакокрасочной промышленности, в производстве товаров бытовой химии и многих других областях);
- Является компонентом антифризов и стеклоомывателей.
- В бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой. Является растворителем для репеллентов.
Медицина
- по своему действию этиловый спирт можно отнести к антисептикам;
- как обеззараживающее и подсушивающее средство, наружно;
- подсушивающие и дубящие свойства 96%-го этилового спирта используются для обработки операционного поля или в некоторых методиках обработки рук хирурга;
- растворитель для лекарственных средств, для приготовления настоек, экстрактов из растительного сырья и др.; настоек и экстрактов (минимальная концентрация 18 %); при подаче кислорода, искусственной вентиляции легких;
- в согревающих компрессах;
- для физического охлаждения при лихорадке (для растирания) 5 ;
- возможно применение как компонента парентерального питания (в виде 5 % раствора) у ослабленных больных с учётом высокой энергетической ценности вещества
- компонент общей анестезии в ситуации дефицита медикаментозных средств
- Как пеногаситель при отеке легких в виде ингаляции 33 % раствора.
- Этанол является противоядием при отравлении некоторыми токсичными спиртами, такими как метанол и этиленгликоль. Его действие обусловлено тем, что фермент алкогольдегидрогеназа, при наличии нескольких субстратов (например, метанол и этанол) осуществляет лишь конкурентное окисление, благодаря чему после своевременного (почти немедленного, вслед за метанолом/этиленгликолем) приёма этанола уменьшается текущая концентрация токсичных метаболитов (для метанола — формальдегида и муравьиной кислоты, для этиленгликоля — щавелевой кислоты).
Парфюмерия и косметика
Это универсальный растворитель для широкого спектра веществ, из которых он является основным ингредиентом в духах, одеколонах и аэрозолях. Он используется в зубной пасте, шампунях, средствах для душа и многих других продуктах.
Пищевая промышленность
Помимо воды, он является важным ингредиентом в алкогольных напитках (водка, виски, джин и т.д.). Он также содержится в небольших количествах в некоторых напитках, полученных путем брожения, но не классифицируемых как алкогольные (например, кефир, квас, кумыс, безалкогольное пиво). Содержание свежего кефира в этаноле ничтожно мало (0,12%), но в долгосрочной перспективе может достигать 1%, особенно в жарких районах. Кумыс содержит 1-3% этанола (до 4,5%), а квас — 0,6%-2,2%.

- Этанол — горючее вещество, смесь его паров с воздухом взрывоопасна.
- Спирт этиловый синтетический, технический и пищевой, непригодный для производства алкогольной продукции, входит в список ядовитых веществ для целей статьи 234 и других статей Уголовного кодекса Российской Федерации 7
- С 2005 года розничная продажа спирта в России запрещена (за исключением районов Крайнего Севера) 8
Токсикология этанола
В зависимости от дозы, концентрации, способа введения и продолжительности воздействия этанол может оказывать наркотическое, анестезирующее и токсическое действие. При определенных дозах и концентрациях он может привести к острому отравлению и смерти (смертельная разовая доза — 4-12 граммов этанола на килограмм массы тела). Однако этанол является естественным метаболитом человеческого организма и в некоторых дозах используется в медицине как самостоятельный препарат, а также как растворитель в лекарствах, экстрактах и настойках.
Длительное употребление этанола может вызвать такие заболевания, как гастрит, пептические язвы, рак желудка и пищевода.
Потребление этанола может вызвать окислительное повреждение нейронов головного мозга.









