Впоследствии были открыты тазовый (или садокуный) и другие методы. Современные методы добычи полезных ископаемых основаны на древних знаниях, но технология развивалась и механизировалась.
Как из соли получить соль
Химия — это область чудес, и в ней кроется благополучие человечества.
Величайшее завоевание разума происходит
В этой области. (М. Горький)
Образование не сводится к количеству знаний.
но в полном понимании и умелом применении того, что вы знаете».
А. Дистервег (учитель немецкого языка)
Мы живем в мире веществ и их изменений, поэтому нам необходимо знать не только их состав и применение, но и их влияние на организм человека и окружающий нас мир.
Вы уже знакомы с различными категориями веществ, и сегодня мы познакомимся с новой категорией соединений: солью.
I. Понятие соли.
Такие вещества, как мрамор, известняк, сода, поташ, соль, ад, квасцы и аммиак, известны человечеству уже много веков. Однако первые теоретические идеи о сходстве их состава появились только в 17 веке. В то время такие ученые, как Я. Ван Гельмонт (1580-1644), О. Тахениус (1620-16009) и Х. Рюль (1703-1770), развивали идею о возможности существования другого вида вещества, а именно соли. Он рассматривается как продукт кислотно-основных взаимодействий.
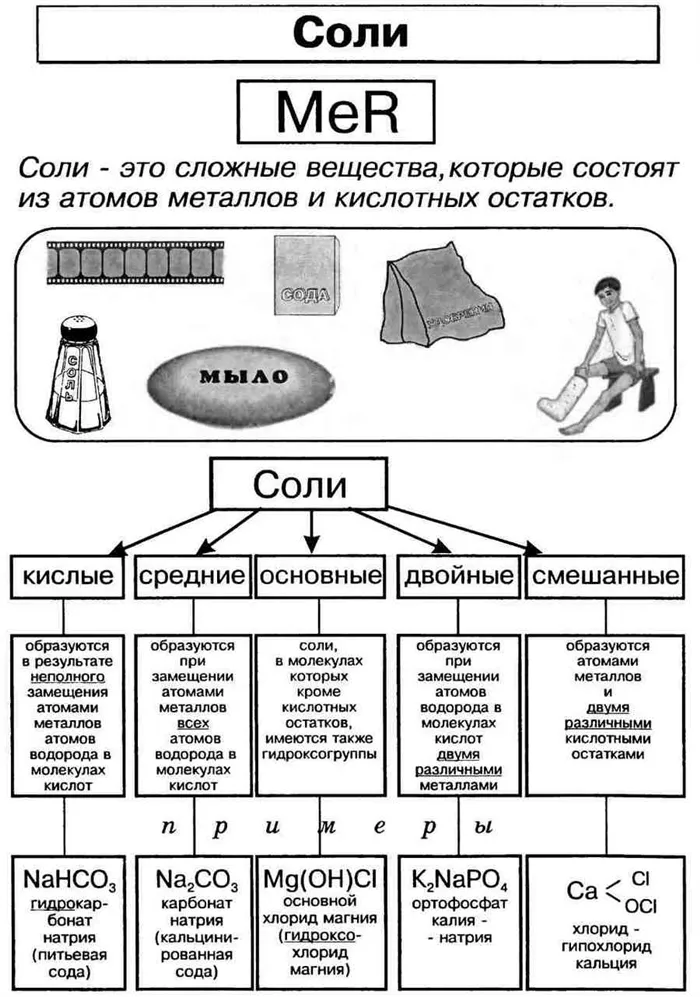
Соли — это сложные вещества, состоящие из атомов металлов (иногда содержащих водородные или гидроксильные группы) и кислотных остатков.
Виды производства соли:.
II.Классификация солей
Основой для разделения солей на отдельные группы послужили работы французского химика и фармацевта Г. Рюля (1703-1770). В 1754 году он предложил разделить известные соли на кислые, основные и умеренные (нейтральные). В настоящее время существуют и другие группы соединений этого очень важного класса.
Соли, состоящие из металлов и кислотных остатков.
Соли, состоящие из металла и кислотных остатков, в их составе присутствуют атомы водорода
Соли, состоящие из металла и кислотного остатка плюс композиция, содержащая гидроксигруппу OH
Продукты, в которых атомы водорода кислоты двух или более оснований полностью замещены двумя различными металлами
III. названия солей.
- Для средней соли — название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью. В состав солей аммония вместо металлического химического элемента входит одновалентная группа аммония NH4 (валентность I).
- Для кислой соли – «гидро» или «дигидро» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Кислые соли можно рассматривать как продукты неполной нейтрализации полибазовых кислот.
Обратите внимание!
Следует отметить, что при образовании кислотных солей активность кислотного остатка численно равна количеству атомов водорода, входящих в состав молекулы кислоты и замещенных металлом.
NaHSO4 -гидросульфат натрия, и
Кислотные остатки NaH2PO4 дигидроортофосфат натрия.
- Для основной соли – «гидроксо» + название кислотного остатка + название металла + указываем валентность для металла с переменной валентностью.
Основные соли можно рассматривать как продукты неполной нейтрализации поликислотных оснований.
Обрати внимание!
При составлении рецептур таких веществ следует учитывать, что валентность остатка основания численно равна количеству гидроксильных групп, выходящих из основания.
Mg(OH)Cl — гидрохлорид магния
Fe(OH)(NO3)2 -гидроксо-нитрат железа(III) — Fe(OH)2Нет.3 Дигидроксонитрат железа (III).
Известным примером основной соли является гидроксикарбонат зелени (II) (CuOH).2CO3возникает со временем в предметах из меди и медных сплавов, когда они вступают в контакт с жидким воздухом. Минерал малахит имеет такой же состав.
В дополнение к научно принятым названиям многих солей широко используются идиоматические названия. То есть названия, данные веществам до того, как ученые создали единую номенклатуру.
Идиоматические названия в основном связаны с конкретными свойствами веществ или их использованием. Многие из этих названий были даны соли алхимиками. В следующей таблице приведены наиболее распространенные названия тривиальных солей, встречающиеся в литературе.
IV. загрузка.
1. металлы:.
Металл + неметалл = соль
Металлы (металлы до H2) + кислота (раствор) = соль + H2
Примечание: (Металлы.2 в правой части панели активности).
2. оксиды:.
Кислотные оксиды + щелочь = соль + вода
Основные оксиды + кислота = соль + вода
Основные оксиды + кислотные оксиды = соль
3. реакции нейтрализации:.
Кислота + основание = соль + вода
4. из соли:.
Соль1 + щелочь = нерастворимое основание + соль2
Примечание: Если одно из образующихся веществ нерастворимо в воде (осадок), газе или воде, то все реакции обмена завершены.
Это интересно.

В Боливии есть необычная равнина под названием Салар-де-Уюни, которая покрыта толстым слоем соли. Площадь Салар-де-Уюни составляет 12 000 квадратных километров — иногда они покрываются тонким слоем влаги и превращаются в большое зеркало. Это свойство используется для адаптации оптического оборудования к спутникам Земли. Равнины также являются богатым источником лития (более половины мировых запасов).
В. Инструкторы.
VI. задание на интеграцию
Задание №2. Назовите химические формулы солей: хлорид железа (II), сероводород калия, сульфид калия, сульфит калия, сульфат калия, ортофосфат железа (III), нитрат магния, карбонат натрия.
Задача №3. для получения оксида кальция из оксида кальция существует два метода
M — металл, Ac — кислотный остаток, n и m — количество атомов в металле и кислотном остатке, соответственно.Соли делятся на шесть типов в зависимости от их состава и образования.
Характеристики и физические свойства солей
Соли — это сложные вещества, состоящие из атомов металлов, соединенных с кислотными остатками.
Соли — это твердые вещества разного цвета. Их растворимость различна. Некоторые соли хорошо растворимы в воде. Все нитраты — и другие, например, карбонат кальция, сульфат бария и т.д., почти не растворимы.
Получение солей
Соли могут быть получены при действии кислот на металлы, основные оксиды и основания.
Соли образуются в результате реакции кислотных оксидов со щелочами и кислотных оксидов с основными оксидами.
Соли могут образовываться в результате взаимодействия кислот, щелочей, металлов, нелетучих кислотных оксидов и других солей.
Соли образуются при взаимодействии металлов и неметаллов.
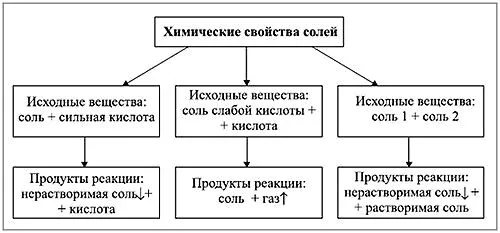
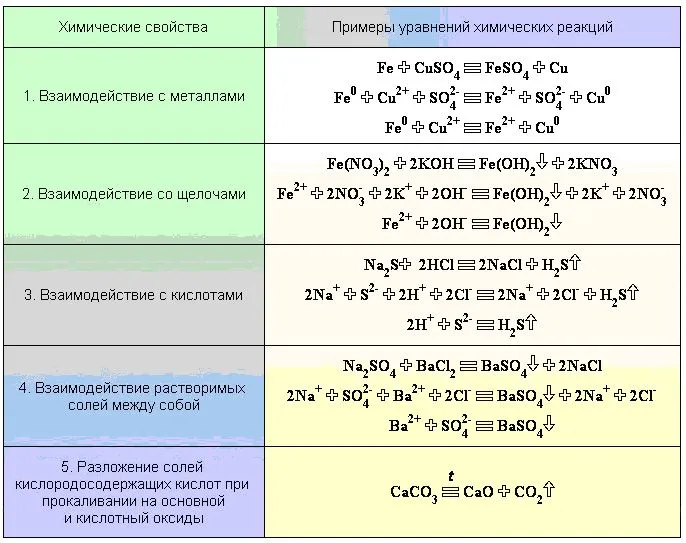
Химические свойства солей
Соли реагируют с металлами. При составлении уравнений для этих реакций Н.Н. Бекетов. Поскольку эти реакции происходят в водном растворе, литий, натрий, калий, кальций, барий и другие активные металлы, реагирующие с водой в обычных условиях, не могут быть использованы в практических экспериментах.
Соли реагируют с кислотами. Эти реакции обычно дают сухие соли, которые реагируют с концентрированными кислотами.
Соли реагируют со щелочами в водном растворе, образуя нерастворимые основания.
Соли реагируют с солями. Реакции протекают в растворе и используются для получения практически нерастворимых солей.
Некоторые соли разлагаются при нагревании. Типичным примером такой реакции является кальцинирование известняка, основным компонентом которого является карбонат кальция.
CaC O3 + CO2 + H2 O = Ca(HCO3)2
Химические свойства солей

Сложные неорганические соединения, образованные металлами и кислотными телами, называются солями. Химические свойства солей позволяют создавать различные соединения.
M — металл, Ac — кислотный остаток, n и m — количество атомов в металле и кислотном остатке, соответственно.Соли делятся на шесть типов в зависимости от их состава и образования.
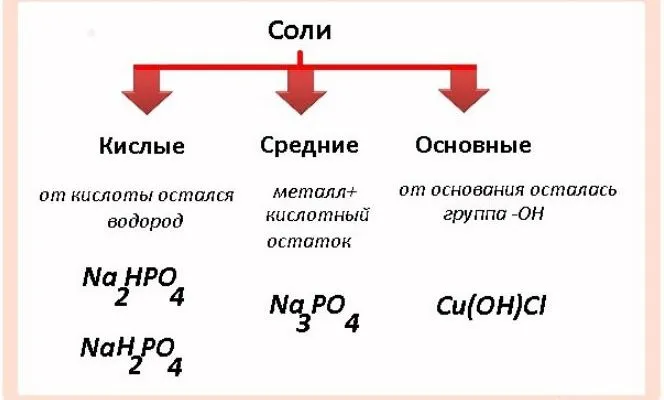
- средние (нормальные) – образуются путём полного замещения водорода в кислоте атомами металла или гидроксильной группы в основании кислотными остатками (Na3PO4 Образована h3PO4, cuso.4 -CU(OH)2Алкл, Алкл.3 – из HCl);
- кислые – образуются при неполном замещении водорода в кислотах атомами металла (NaHSO4 Образуется при добавлении na к h2Итак.4, на2HPO4 По -Н3PO4);
- основные – образуются при неполном замещении гидроксильных групп кислотными остатками (CaOHCl образован из Ca(OH)2feohcl2 — Fe (а)3);
- двойные – состоят из двух металлов и одного кислотного остатка (КNaSO4);
- смешанные – состоят из одного металла и нескольких кислотных остатков (CaClBr);
- комплексные – состоят из комплексного аниона или катиона (Cu(NH3)4Итак.4).
Наиболее активными солями являются кислые соли, содержащие водород. Химические свойства солей кислот аналогичны свойствам кислот. Они реагируют с металлами, оксидами, гидроксидами, другими солями и щелочами.
Физические свойства
Соли — это кристаллические вещества различных цветов.Основные физические свойства солей:.
- ионная кристаллическая решётка;
- высокие температуры плавления;
- в твёрдом состоянии плохо проводят электричество;
- по растворимости выделяют растворимые, малорастворимые и нерастворимые соли.
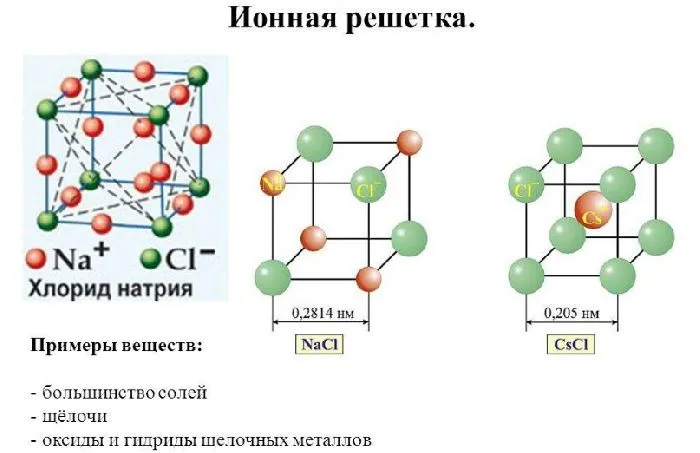
Рисунок 2. Решетка ионного кристалла.
Некоторые соли имеют промежуточные структуры, образованные ковалентными или ионными и ковалентными связями.
Получение
Соли образуются под действием кислот и оснований. Кислоты могут реагировать с широким спектром веществ: см. рис. 3.
Основания могут взаимодействовать с:.
Существуют и другие методы производства:.
-
взаимодействие двух солей –
Растворимые соли являются электролитами и подвержены реакциям разделения. При взаимодействии с водой они разрушаются. Это означает, что они делятся на катионы и анионы — катионы и анионы соответственно. Катионы — это ионы металлов, а анионы — кислотные остатки. Примеры ионных уравнений:.
Помимо катионов металлов, соли могут содержать катионы аммония (NH4+) и флуоресцентные кофакторы (PH4+).
Другие реакции перечислены в таблице химических свойств солей.
Специфические особенности.
Наиболее реактивный металл заменяет наименее реактивный
Характеристика солей, образуемых слабыми кислотами. Образуются новые соли
Соли, образованные нерастворимыми основаниями, взаимодействуют между собой
Растворимые соли взаимодействуют. Образуется преципитат

Рисунок 3.Отложения, образованные в результате взаимодействия с основаниями.
Некоторые соли разлагаются при нагревании с оксидами металлов и простыми веществами. Например, Како3 → CAO + CO2и 2AGCL → Ag + Cl2.
Кристаллогидраты обычно собирают путем кристаллизации солей из водных растворов, но известны также кристаллические растворимые соли, осаждаемые неводными растворителями (например, CABR2 3 C2H5OH).
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ
МГ (а).2 + H2SO.4 = мгс о4 + 2 h2 o
MGO + h.2SO.4 = мгс о4 + H2 o
MGO + S o3 = мгс о4
(b) по реакциям обмена (см. взаимодействие солей между собой):.
мг i2 + hgs o4 = мгс о4 + hg i2 ↓ ↓
ПОЛУЧЕНИЕ КИСЛЫХ СОЛЕЙ
2NOH + h.3P o4 = Na2HP o4 + 2 h2 o
(неполная нейтрализация приводит к образованию натрия в водоносном горизонте),.
NaOH + H.3P o4 = na h2P o4 + H2 o
(Неполная нейтрализация приводит к образованию дигидрофосфата натрия).
- Неполная нейтрализация кислотных оксидов, соответствующих двухосновным, трёхосновным, многоосновным кислотам, основаниями (так можно получить только соли кислородсодержащих кислот):
4нао + р2 o5 = 2 на2HP o4 + H2 o
(Неполная нейтрализация приводит к дигидрофосфату натрия),.
2nnoh + p2 o5 + H2 O = 2NA h2P o4
(Неполная нейтрализация приводит к образованию натрия в водоносном горизонте).
Na2Итак.4 + h2Итак.4 = 2nahso4 NaCl (СОЛИД.) + H2SO.4 (SOLID) = nahs o4 + HCl↑
- Взаимодействие средних солей с оксидами, соответствующими многоосновным кислотам, в водных растворах:
CaC O3 + CO2 + H2 O = Ca(HCO3)2
(Этот пример Како3 (постепенно исчезает — гидрохлорид кальция карбонат кальция).
Кислоты обычно более растворимы, чем соответствующие промежуточные соли. Так, например, кальций Ca (HCO3)2 Карбонат кальция практически нерастворим, но растворим в воде.

- Кислые соли вступают в такие же реакции, как и средние, например в обменные реакции солей друг с другом:

Образец выполнения задания ОГЭ
Задание. . Взаимодействие сульфата меди (II) и нитрата серебра
- 1) с хлоридом калия
- 2) с соляной кислотой
- 3) с оксидом магния
- 4) с железом
Решение. Хлорид калия, сульфат меди (II) и монооксид серебра являются солями. Если в результате реакции один из продуктов реакции садится (т.е. образуется нерастворимое вещество), то растворимые соли взаимодействуют друг с другом. Когда нитрат серебра взаимодействует с хлоридом калия, образуется осадок (белый, покрытый хлоридом серебра осадок).
Однако сульфат меди(II) не взаимодействует с хлоридом калия, поэтому в растворе нет ионного обязательства. Поэтому вариант 1 не подходит.
Соляная кислота является сильным электролитом. Сильные кислоты реагируют с солями слабых кислот, выводя их из солевого состояния. Однако сульфат меди (II) является сильной солью серной кислоты, а речное серебро — сильной солью азотной кислоты. Серная кислота может заменить нитратную и соляную кислоту из кристаллических солей (не в растворе), потому что HNO3 HCl является летучей кислотой, тогда как серная кислота — нет. Соляная кислота не может заменить серную или азотную кислоту. Поэтому вариант 2 не подходит.
Соли редко взаимодействуют с оксидами. Например, карбонаты взаимодействуют с оксидом кремния (IV). Промежуточные соли превращаются в кислые соли при взаимодействии в растворе с кислотным оксидом соответствующей кислоты (если он имеется в этих кислотах). В данном примере оксид магния не взаимодействует с сульфатом или нитратом меди(II). Ответ 3 не совместим.
Обе соли взаимодействуют с железом. Железо находится в электрохимическом ряду тенденций металлов перед медью и перед серебром:.
Правильный ответ — 4 (с железом).
Конспекты занятий по химии 8 класса: «Соли: сортировка, свойства, пятница». Выберите следующий шаг.
Последние две реакции являются основными причинами образования соли на поверхности водонагревательных элементов, таких как электрические бойлеры, стиральные машины и т.д.
Химические свойства солей
Затем приступайте к изучению химических свойств солей. Дело в том, что они определяются свойствами катионов и анионов, входящих в их состав.
Значение соли для человеческого организма
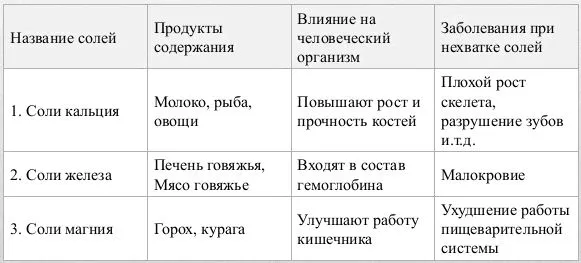
Общество давно обсуждает вред и пользу солей для человеческого организма. Но что бы мы ни видели, мы должны знать, что поваренная соль является естественным неорганическим веществом и необходима для нашего организма.
Мы также должны знать, что хронический дефицит хлорида натрия может привести к летальному исходу. В конце концов, если вы вспомните урок биологии, то увидите, что человеческое тело на 70% состоит из воды. Соль помогает регулировать и поддерживать водный баланс в организме. Поэтому не стоит исключать использование соли. Конечно, чрезмерное употребление соли не может привести ни к чему хорошему. Поэтому следует помнить, что соль не должна вырабатываться, так как ее недостаток или избыток может вызвать дисбаланс.
Применение солей
Соль используется как в промышленных целях, так и в нашей повседневной жизни. Далее рассмотрим подробнее и выясним, где он чаще всего используется.
Из этих видов соли наиболее часто используются хлорид натрия и хлорид калия. Поваренная соль, которую мы употребляем в пищу, поступает из морской и озерной воды и соляных шахт. Хлорид натрия применяется в пищевой промышленности, но используется для получения хлора и пищевой соды. Хлорид калия, с другой стороны, необходим для сельского хозяйства. Используется в качестве калийного удобрения.
Сульфаты широко используются в медицине и строительстве. Они используются для производства гипса.
Нитраты, или, как их еще называют, нитраты, используются в сельском хозяйстве в качестве удобрений. Наиболее важными из этих солей являются нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их также называют рассолами.
Одним из наиболее важных ортофосфатов является ортофосфат кальция. Эта соль является основой для получения фосфорной кислоты, апатита и других минералов, необходимых для приготовления фосфорных удобрений.
Карбонат или карбонат кальция встречается в природе в виде мела, известняка и мрамора. Он используется для производства извести. Карбонат калия используется для производства стекла и мыла.








