Ван-дер-Ваальсовский радиус намного больше, чем общий радиус. Зная значения ван-дер-ваальсовых, общих лучей и ионных лучей, можно создавать визуальные модели молекул, которые отражают форму и размер электронной оболочки.
Из чего состоят молекулы?

Силы и частицы
Известно, что вся материя состоит из молекул. Классическая теория химического строения материи рассматривает молекулы как мельчайшие стабильные частицы со всеми их свойствами. Но из чего состоит сама молекула? Давайте рассмотрим этот вопрос подробнее.
Что такое молекула?
Название «молекула» происходит от лицемерного слова mole (переводится как масса), латинского molecule. Впервые их существование было доказано в 1906 году, когда Ж. Перрен, французский естествоиспытатель, изучал коричневое движение.

Жан-Батист Перрен с «Большой модой» в Институте Кюри. 1927 G.
В химии так называют отдельные частицы вещества, состоящие из двух или более индивидов, снабженных ковалентными связями. Квантовая механика определяет их не как индивидуумов, а как систему, состоящую из их ядер и взаимодействующих с ними электронов.
Интересное событие: в физике молекулами называют не только многоатомные частицы, но и монотипические частицы, состоящие из лиц (чистая ртуть или инертные газы), которые химически не связаны друг с другом. В этом случае термины «молекула» и «человек» объединяются.
Молекулы обычно электрически нейтральны. Некоторые молекулы имеют одинаковое количество протонов и электронов, но несут электрическую нагрузку (называются ионами).
Частицы вещества с высокой молекулярной массой называются макромолекулами. Они состоят из определенных искусственных соединений, таких как белки, нуклеиновые кислоты, ферменты, полисахариды, аминокислоты, сложные липиды и полимеры. Они содержат сотни или тысячи из них. Как правило, органические вещества и биоаккумуляторы сложнее неорганических соединений, а также имеют большую массу — производные углеводородов.
Строение молекул
Сложные молекулы имеют неизменный состав, в них всегда одинаковое количество людей, а их химические свойства зависят от валентных связей, которые их соединяют. Классическая теория рассматривает молекулу как динамическую структуру, состоящую из отдельных ядер и их групп и множества электронов на внутреннем и внешнем уровнях.
Химические связи обычно образуются только за счет внешних электронов. Связи образуются одной, двумя или тремя парами электронов от двух соседних индивидов (образуя электронное облако). Энергия взаимодействия между людьми зависит от расстояния, на котором они находятся, и способствует стабильности молекулы в нормальных условиях.
Люди могут быть положительно и отрицательно заряжены, а их число всегда стабильно. На структуру и синтез молекулы конкретного вещества не влияет способ его производства. Другими словами, искусственно полученные вещества точно такие же, как и натуральные.
Молекулярный состав регистрируется с помощью хемотипов. Структура определяет физические свойства вещества.
Интересные события: органические вещества, вода и углекислый газ растворяются и кипятят при относительно низких температурах и сохраняют свою структуру даже в твердом состоянии. Многие неорганические вещества состоят не из молекул, а из индивидов (например, кристаллы, чистые металлы).
Структура молекулы условно представлена типом структуры. Базовые взаимодействия индивидов обозначены пунктиром этих типов. В этих типах связи образуют неразрывные цепи и характеризуют прочность элементов (атомов), которые их образовали.
Что такое молекула?

Для большинства из нас это был первый раз, когда мы услышали термин «молекула» на уроке естественных наук в школе. Это одна из фундаментальных концепций современной химии, которая позволила нам узнать больше о нашей окружающей среде. Так что же такое молекула, из чего она состоит и почему мы должны ее изучать?
Как и большинство химических терминов, слово «молекула» основано на латыни. Оно образовано из двух слов: «молекула», означающее массу, тяжесть и «-kiss». Буквальное значение имеет малая масса.
В современной химии молекулы — это мельчайшие частицы материи. Даже молекула любого вещества обладает всеми свойствами, которые характеризуют это вещество.
Если молекулу разделить на составляющие ее компоненты, то составляющее вещество разрушается и растворяется в более простых элементах, индивидах. Именно на этой основе формируется вся концепция, составляющая современную научную и химическую практику.
Из чего состоит молекула?
Молекулы состоят из простых «кирпичиков», химических веществ, потому что здания состоят из кирпичей, а все человеческие производственные машины состоят из компонентов. Некоторые молекулы состоят из одного человека, например, молекулы металлов. Однако подавляющее большинство окружающей нас материи имеет гораздо более сложную молекулярную структуру.
Структуру молекулы можно представить в виде химической формулы, где номер каждого элемента указывает на количество человек в молекуле. Молекула кислорода состоит из двух одинаковых атомов элемента кислорода.
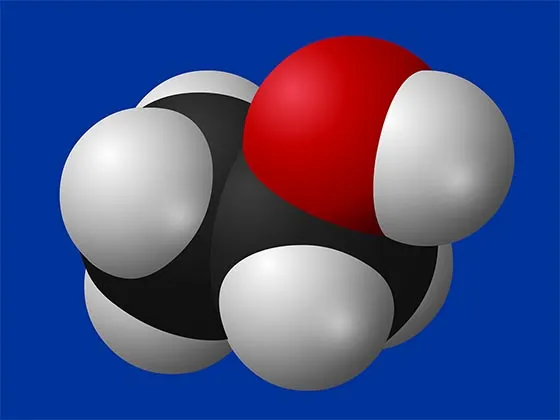
Всем известна формула воды: H2O. Это означает, что каждая молекула воды содержит атом кислорода и два атома водорода. Другой известный тип — C2H5ON, который является разновидностью этилового спирта и состоит из двух атомов углерода (C), шести атомов водорода (H) и одного атома кислорода (O).
Когда вещества взаимодействуют друг с другом, они обмениваются химическими веществами, вступая в реакцию. В результате образуется новое вещество с новыми свойствами, отличными от свойств исходного вещества.

Например, углерод (который почти полностью состоит из углерода), сгорая (взаимодействуя с кислородом воздуха), образует углекислый газ, вещество, которое не подходит для дыхания, в отличие от кислорода. Молекулы в нормальном состоянии не имеют электрического заряда и называются нейтральными. Молекулы, заряженные положительно или отрицательно, называются ионами, а сам процесс — ионизацией. Молекулы, в которых индивидуумы имеют неизмененные электроны, называются корнями.
Чему равна масса молекулы?
Конечно, в арсенале современной науки нет весов, достаточно чувствительных для взвешивания одной молекулы материи. Масса молекул и индивидуумов рассчитывается другими способами. Принято считать, что масса молекулы любого вещества равна сумме масс всех индивидуумов.
Но как можно узнать вес человека? Это можно найти в периодической таблице элементов Менделеева, где указана масса каждого элемента. Однако вместо известного килограмма он обозначает особую единицу атомной массы. Одна единица атомной массы (а.е.м.м.) равна 1/12 части массы атома углерода, что эквивалентно 1,660 *10-27 кг.
Другими словами, чтобы рассчитать вес молекулы вещества, нужно взять ее формулу, сложить атомные веса всех составляющих ее элементов и умножить на вес единицы атомного веса.
На основе имеющихся знаний о происходящих химических реакциях можно предсказать структуру молекул веществ, участвующих в них. Также применим и противоположный вывод. Основываясь на знании структуры молекул вещества, вполне реально предсказать их поведение во время химических реакций.
Представление структуры молекул
Молекулы состоят из электронов и ядер, причем расположение последних в молекуле представлено структурной формулой (для описания состава используется так называемая брутто-формула). Белковые молекулы и некоторые искусственно синтезированные соединения могут содержать сотни тысяч атомов. Макромолекулы полимеров рассматриваются отдельно.
Молекулы — это изучение молекулярных структур и теорий квантовой химии, приборы которой активно используют результаты квантовой физики, включая релятивистские части. Такие области химии, как молекулярный дизайн, также находятся в стадии разработки. Современная наука располагает широким набором инструментов для определения молекулярной структуры конкретных веществ. К ним относятся электронная спектроскопия, колебательная спектроскопия, ядерный магнитный резонанс и электронный парамагнитный резонанс, но единственными доступными в настоящее время прямыми методами являются рентгенодифракционный анализ и нейтронный анализ. Дифракция.
Взаимодействие атомов в молекуле
Природа химических связей в молекулах оставалась загадкой до тех пор, пока не была создана квантовая механика. Классическая физика не могла объяснить насыщенность и направленность валентных связей. Основы теории химической связи были заложены Хайтлером и Лондоном в 1927 году на примере простейшей молекулы H.2 Впоследствии теория и вычислительные методы были значительно усовершенствованы.
Химические связи в большинстве молекул органических соединений являются ковалентными. В неорганических соединениях существуют ионные и донорно-реципиентные связи, которые возникают в результате электронного спаривания атомов. Энергии образования молекул из атомов во многих сериях таких соединений практически аддитивны. Другими словами, энергию молекулы можно рассматривать как сумму энергий ее связей, которые имеют постоянные значения в этой последовательности.
Добавление энергии к молекуле не всегда выполняется. Примером нарушения аддитивности является так называемая сопряженная связь, т.е. плоская молекула в органическом соединении с чередованием кратных и одинарных связей. В таких случаях валентные электроны, так называемые p-электроны, которые определяют кратность связей, являются общими для всей системы перестроенных сопряжений связей. Такое рассеивание электронов приводит к стабилизации молекулы. Выравнивание электронной плотности вследствие накопления p-электронов в связи представлено укорочением двойных связей и удлинением одинарных связей. В обычном шестиугольнике углеродных связей бензола все связи равны и имеют среднюю длину длин одинарных и двойных связей. Соединения связей четко видны в молекулярном спектре.
Новейшие квантово-механические теории химической связи учитывают частичный распад s-электрона, а также p-электрона, наблюдаемый в каждой молекуле.
В большинстве случаев суммарный спин валентных электронов в молекуле равен нулю. Это означает, что спины электронов являются насыщенными парами. Молекулы, содержащие непонятные электроны — свободные радикалы (например, индивидуальный водород H, метил-CH3) нестабильны, так как обычно реагируют друг с другом, и их энергия значительно снижается за счет образования ковалентных связей.
Межмолекулярное взаимодействие
Металлические взаимодействия — взаимодействия между электрически нейтральными молекулами в пространстве. В зависимости от полярности молекул характер взаимодействия алмазов меняется. Природа последнего оставалась неизвестной до создания квантовой механики.
Восточный тип взаимодействия алмазов происходит между двумя полярными молекулами, то есть такими молекулами, которые обладают собственным дипольным моментом. Взаимодействие дипольных моментов определяет результирующую силу — притяжение или отталкивание. Если дипольные моменты молекул выровнены, то взаимодействия между ними сильнее.
Индуцированные взаимодействия в среде происходят между полярными и неполярными молекулами. В этом типе взаимодействия полярная молекула поляризует неполярную молекулу таким образом, что нагрузка неполярной молекулы смещается в сторону последней, а не действует на нее: как правило, положительная нагрузка смещается в направлении электрического поля, создаваемого полярной молекулой, а отрицательная нагрузка смещается против него. Поляризованная молекула, т.е. по сравнению с центром положительного заряда, вызывает явление смещения преданной электронной оболочки.
DIA — диаспора алмаза взаимодействие происходит между двумя неполярными молекулами. В общем случае дипольный момент неполярной молекулы равен нулю, но существует возможность неравномерного распределения электронов по всему объему молекулы в данный момент времени. В результате возникает мгновенный дипольный момент. В этом случае мгновенный диполь поляризует неполярную молекулу или взаимодействует с мгновенным диполем другой нейтральной молекулы.
Другими словами, чтобы рассчитать вес молекулы вещества, нужно взять ее формулу, сложить атомные веса всех составляющих ее элементов и умножить на вес единицы атомного веса.
История
Исторически молекулярная и индивидуальная теории тесно переплетены. Первые сообщения о том, что материя состоит из «отдельных единиц», появились в Древней Индии. Там поклонники джайнов придерживались идеи, что все состоит из маленьких неделимых элементов.
В Древней Греции философы Лефкиппос и Демократ ввели термин «человек», обозначающий «меньшую неделимую часть материи», от которого и произошел современный термин «человек».
Позже, в 1661 году, физик Роберт Бойль в химическом трактате под названием «Скептический химик» утверждал, что материя состоит из комбинации различных «тел» (устаревший термин для мельчайших частиц материи), а не из земли, ветра. вода и огонь. Однако эти наблюдения ограничивались сферой философии.
Только в конце 18-го и начале 19-го веков многочисленные законы пропорций Антуана Лавозье, касающиеся поддержания массы, и закон Дальтона ввели индивидов и молекулы в сферу точной науки. Первая считала, что элементы — это базовые вещества, которые нельзя перепутать, а вторая предполагала, что каждый элемент состоит из уникального типа человека и что они могут комбинироваться, образуя химические вещества.

Сканирование туннелей
Другое открытие было сделано в 1865 году, когда Иоганн Йозеф Рошмидт измерил размер атмосферных молекул, что дало представление о молекулярном масштабе. Изобретение туннельно-сканирующего микроскопа (СТМ) в 1981 году впервые позволило мгновенно наблюдать за отдельными особями и молекулами.
Сегодня наше представление о Мории еще более расширилось благодаря продолжающимся исследованиям в области квантовой физики, органической химии и биохимии. И когда речь идет о поиске жизни в других мирах, нам необходимо понять, что нужно органическим молекулам, чтобы вырваться из комбинации химических строительных блоков.
Электрические, визуальные, магнитные и другие свойства молекул связаны с волнами и действиями различных молекулярных ситуаций. Молекулярные спектры предоставляют информацию о состоянии молекул и возможных переходах между ними.
Масса (размер) молекулы
В зависимости от количества ядер молекулы различают на 2, 3 и т.д.

Если количество людей велико, молекула называется макромолекулой.
Молекулярный вес может быть определен путем сложения веса людей, составляющих частицу. В зависимости от цены все вещества можно разделить на высоко- и низкомолекулярные.
Свойства молекулы

Современная наука выделяет следующие свойства молекул
Электрические — эти свойства определяют, как вещество ведет себя в электрическом поле. Люди, составляющие молекулу, состоят из активно заряженного ядра и отрицательно заряженных электронов. Нагрузки внутри самой молекулы распределены неравномерно, поэтому — с помощью дипольного момента So -Calcaled — плотность электронов смещается к одному из индивидов.
Визуальная — описывает, как материя ведет себя в поле световых волн. Визуальные свойства включают поляризацию, преломление и световое мышление.
Магнитный — описывает распределение электронов по индивидууму.
Прямой магнитный — нет спаренных электронов
Парамагнитный — имеются несомненные электроны.
Знание свойств и структуры молекул имеет фундаментальное значение для развития теоретической и прикладной науки и играет важную роль в жизни человека.








