Азот имеет положительные степени окисления от \(+1\) до \(+5\) и образует соединения с кислородом: N 2 O — оксид азота(\(I\)), NO — оксид азот (\(II\)), N 2 O 3 — оксид N(III(\)), N O 2 O 2 — оксид Азот (\(IV\(IV\(IV\)), N 2 O 5 — оксид азота(\(V\)).
Урок 22 Бесплатно Оксиды азота. Азотная кислота
Азот образует оксиды, имеет степень окисления от +1 до +5:
НЕТ
Два из них являются кислотными:
N2O3 соответствует азотной кислоте и образует нитритные соли,
N2O5 два из них взаимодействуют с азотной кислотой и образуют соли нитратов.
Остальные оксиды Некислотный: не содержит кислот и солей.
Сравнительная характеристика оксидов азоте приведены в таблице.
Оксид
НЕТ
Качество оксида азота
Появляется в н.о.
Бесцветный газ со сладковатым запахом
Молекулярная масса
Плотность
Использование
Наркотик, топливная добавка
Производство азотной кислоты
Окислитель для ракетного топлива
У меня есть больше информации по этой части курса!

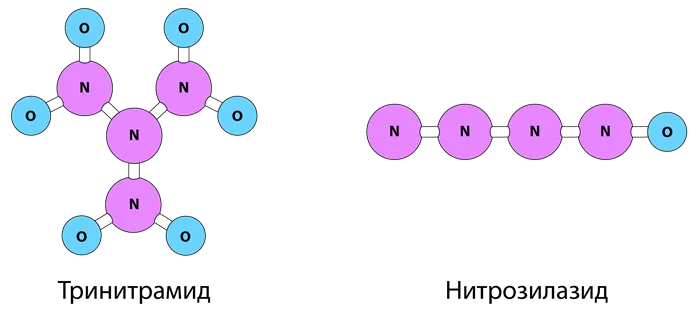
Также ученые получили Экзотические азотно-кислородные соединения, такие как тринитрамид N4O6 и нитрозил-азид N4O
Эти соединения практически не исследуются, поскольку они очень нестабильны и взрываются, выделяя азот N2 и оксид азота (IV) NO2
Из всех оксидов азоте мы будем иметь дело с оксиды N(II) и N(IV). Они являются промежуточными продуктами при получении азотной кислоты в промышленности.
Несолеобразующий оксид Азот (II) — это бесцветный газ, не имеющий запаха и очень токсичный. Это единственный оксид азота, который получаетсI при прямом взаимодействии азота и кислорода. В природе он образуется в воздухе во время разрядов молнии.

Другие оксиды получают Косвенно через использование оксид азот (II) или аммиак:

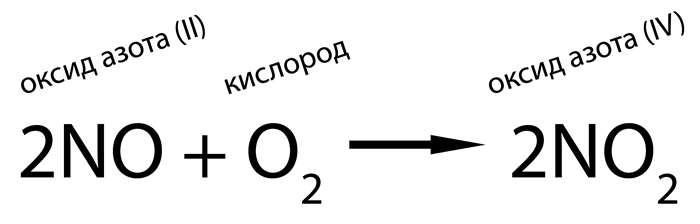
Первая реакция является каталитической, вторая происходит сама по себе при нормальных условиях.
Кислотный оксид азота (IV) NO2 — Коричневый газ с раздражающим запахом, реагирует с водой с образованием смеси нитрата и азотной кислоты.

Упомянутые выше оксиды Азотные кислоты образуются при сгорании топлива. Попадая в воздух, они загрязняют окружающую среду и вызывают кислотные дожди.
У меня есть больше информации по этой части курса!
Если вы видите красный или коричневый дым, поднимающийся из трубы химического завода это оксид Азот (IV): поскольку он тяжелее воздуха, он часто не поднимается вверх, а накапливается в горизонтальном положении. По этой причине и из-за цвета его называют «лисьим хвостом».
Азотная кислота
Чистая азотная кислота HNO3 — Бесцветная жидкость с сильным раздражающим запахом. Свойства азотной кислоты:
— Кипит при температуре 83 °C
— Можно смешивать с водой в любом соотношении
— Гигроскопичность: поглощает влагу из воздуха, в результате чего «дымит» в воздухе, т.е. образует туман азотной кислоты с влагой в воздухе.
При воздействии света азотная кислота медленно разлагается на NO2 что придает ему желтый цвет.

Азотная кислота обладает всеми обычными свойствами кислот:
- реагирует с основными оксидами
- реагирует с основаниями
В результате этих реакций образуются соли — нитраты.
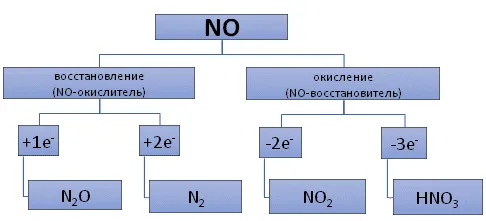
В то же время, однако, азот сильнее в состоянии окисления +5. окислителем, чем ионы водорода, поэтому при реакции азотной кислоты с металлами вместо водорода образуются различные соединения азота: от оксида азота (IV) NO2 в аммиаке NH3 .
Чем более реакционноспособен металл и чем ниже концентрация кислоты, тем сильнее происходит восстановление азота.
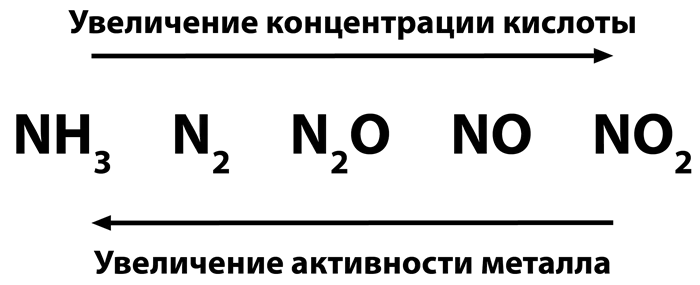
Например, вступая в реакцию с медью, NO2 или NO, но когда он реагирует с цинком, N2 или NH3 .
Однако в реальных условиях среди продуктов одновременно присутствует множество соединений азота.
Железо, алюминий и хром не реагируют с концентрированной азотной кислотой, поэтому ее можно легко перевозить в стальных цистернах.
Азотная кислота также способна окислять неметаллы до соответствующих кислот:
Сера в серную кислоту,
фосфора до фосфорной кислоты.
Многие органические вещества воспламеняются при контакте с азотной кислотой. Например, скипидар:

Азотная кислота широко используется в промышленности и лабораториях.
Интересна по своим свойствам смесь двух кислот — азотной и соляной.
Химики называют эту смесь «царской водкой», потому что она может растворять «царский» металл (угадайте, какой это металл). окислитель, растворяет металлы, которые не растворяются в чистой азотной кислоте.

Дело в том, что при смешивании этих кислот образуется нитроксилхлорид — очень сильный окислитель

У меня есть больше информации по этой части курса!
Нитрозилхлорид придает «царской водке» оранжевый цвет.
Соли азотной кислоты – нитраты
Соли азотной кислоты называются «нитратами». .
Нитраты натрия, калия, кальция и аммония также называют «соленой водой».
Например, NaNO3 — нитрат натрия, NH4NO3 — нитрат аммония.
Отсюда происходит и латинское название азота: nitrogenium, «рождающий нитрат».
Человек сначала узнал о нитратах, понял их свойства, а затем осознал, что они содержат азот.
Нитраты образуются в течение очень длительного периода разложения органических остатков. Когда белки разлагаются, содержащийся в них азот высвобождается в виде аммиака. и оксидов азот. Затем оксиды азота соединяются с различными минералами, образуя нитраты. Этот процесс занимает сотни лет и сопровождается разложением газообразных продуктов и полным разложением органического вещества.
Нитрат натрия NaNO3 также называют чилийской селитрой из-за ее богатого распространения в Чили.
Большое количество нитратов накапливается в пещерах из-за постоянного разложения и выветривания отходов жизнедеятельности летучих мышей.

Все нитраты — это твердые кристаллические вещества, хорошо растворимые в воде. Как и азотная кислота, они разлагаются при нагревании и поэтому являются сильными. окислителями.
Поэтому нитрат используется в качестве ингредиента в легковоспламеняющихся смесях, особенно в порохах и различных смесях для фейерверков.
Водные растворы нитратов практически неэффективны. окислительных свойств.
Из нитратных солей наиболее важными азотными удобрениями являются нитраты натрия, калия, аммония и кальция.
Нитрат калия используется для производства черного пороха.
Нитрат аммония является компонентом взрывчатых смесей, аммониты используются при взрывных работах. Нитраты часто используются в фейерверках. Нитраты также используются в производстве красителей, в том числе для цветного стекла, в качестве пищевых добавок и ингредиентов пороха.
Первые четыре являются газами при нормальных условиях, а N 2 O 5 — твердым веществом. Все оксиды азота ядовиты.
Химические свойства
NO2 Он реагирует с водой, основным оксидаи щелочных растворов. Но реакция не совсем обычная. оксидами — они всегда окислительно — восстановительные реакции. Причина в том, что не существует кислоты с C.O. (N) = +4, поэтому NO2 растворяется в воде, он растворяется в воде и образует 2 кислоты, азотную кислоту и нитрит:
Если он присутствует в присутствии O2присутствует, образуется только одна кислота — азотная:
Аналогично, взаимодействие NO.2 Взаимодействие азотной кислоты со щелочами:
NO2 — очень сильный окислитель
По окислительной способности NO2 Лучше использовать азотную кислоту. Его атмосфера сжигает C, S, P, металлы и некоторые органические вещества. В то же время, NO2 восстанавливается до свободного азота:
2NEIN2 + 8HI = N2 + 4I2 + 4Н2O (появляется фиолетовое пламя).
Присутствие Pt или Ni diоксид Под действием водорода азот восстанавливается до аммиака:
Как окислитель NO2 Используется в ракетном топливе. При взаимодействии с гидразином и его производными выделяется большое количество энергии:
N2O3 и N2O5 — неустойчивые вещества
Оба оксида являются сильнокислотными, так как представляют собой ангидриды азотной и азотистой кислот, соответственно.
N2O3 существует как единое вещество только в твердом состоянии ниже точки плавления (-10 0 C).
При повышении температуры он разлагается: N2O3 → NO + NO2
N2O5разлагается при комнатной температуре и особенно на свету до такой степени, что иногда самопроизвольно взрывается:
При нормальной температуре NO2 — представляет собой красновато-коричневый ядовитый газ с сильным запахом. Он представляет собой смесь NO2 и димер N2O4 в соотношении -1:4. Diоксид Азот растворим в воде.
Оксиды азота
Азот имеет положительные степени окисления от \(+1\) до \(+5\) и образует соединения с кислородом: N 2 O — оксид азота(\(I\)), NO — оксид азот (\(II\)), N 2 O 3 — оксид N(III(\)), N O 2 O 2 — оксид Азот (\(IV\(IV\(IV\)), N 2 O 5 — оксид азота(\(V\)).
Первые четыре являются газами при нормальных условиях, а N 2 O 5 — твердым веществом. Все оксиды азота ядовиты.
Монооксид азота (\(II\)) легко окисляется при комнатной температуре. Он образует коричневый газ с неприятным запахом. — оксид азота(\(IV\)):
Оксид азота(\(I\)) и оксид Азот (\(II\)) является нерастворителем. оксидам. Он не вступает в реакцию с водой, кислотами и основаниями.
Другие оксиды Они образуют соли (кислотные). Оксид азота (\(III\)) соответствует слабой азотной кислоте HN O 2, оксиду Азотная кислота (\(V\)) — сильная азотная кислота HN O 3 оксид азота (\(IV\)) при растворении в воде образует одновременно две кислоты — азотную и азотистую:
В присутствии кислорода реакция между оксидо(\(IV\)) и вода реагируют по-разному, и образуется только азотная кислота:








