Добрый вечер. Все элементы второго периода (кроме D-сентеров) имеют максимальное число электронов на внешнем энергетическом уровне 8.
Электронный состав человека.
Электронная конфигурация человека — это тип, который показывает расположение отдельных электронов на уровнях и подуровнях. После изучения этой статьи вы будете знать, где и как расположены электроны. Вы узнаете о квантовых числах и сможете построить электронную конфигурацию человека на основе этих чисел. В конце статьи приведена таблица элементов.
Индивидуумы подобны набору структур. Некоторое количество деталей отличаются друг от друга, но две детали одного типа абсолютно одинаковы. Однако этот набор конструкций гораздо интереснее пластика, и вот почему. Конфигурация меняется в зависимости от того, кто находится рядом с ним. Например, кислород рядом с водородом может быть преобразован в воду рядом с натрием в газе и железом в ржавчине. Чтобы ответить на вопрос, почему это происходит, чтобы предсказать поведение одного человека рядом с другим, необходимо знать электронные конфигурации, описанные ниже.
Сколько электронов в атоме?
Один человек состоит из ядер и электронов, гуляющих вокруг, а ядро и ядрышко состоят из протонов и нейтронов. В нейтральном состоянии число электронов в каждом индивидууме равно числу протонов в его ядре. Число протонов задается порядковым номером элемента. Сера имеет 16 протонов — 16-й элемент периодической системы. Золото имеет 79 протонов — это 79-й элемент в таблице Менделеева. Аналогично, сера имеет 16 электронов в нейтральном состоянии, а золото — 79 электронов.
Наблюдая за поведением электронов, можно сделать вывод о некоторых закономерностях, описываемых квантовыми числами, всего их четыре.
- Главное квантовое число
- Орбитальное квантовое число
- Магнитное квантовое число
- Спиновое квантовое число
Орбиталь
Кроме того, вместо слова орбитальный используется термин «орбитальный». Орбита — это форма волны электрона, область, через которую электрон проходит почти 90% времени.
Орбитальное квантовое число l
Исследования электронных облаков показали, что, в зависимости от уровня энергии, облакам необходимы четыре основные формы: один шар, одна гантель и две другие, более сложные; первая — шар, вторая — гантель, третья — гантель и четвертая — гантель. В порядке возрастания энергии эти формы называются s-, p-, d- и f-оболочками. Каждая из этих оболочек имеет 1 (s-), 3 (p-), 5 (d-) и 7 (f-) орбиталей. Квантовое число орбитали — это оболочка, в которой находится орбиталь. Квантовые числа орбиталей s, p, d и f равны 0,1,2 или 3.
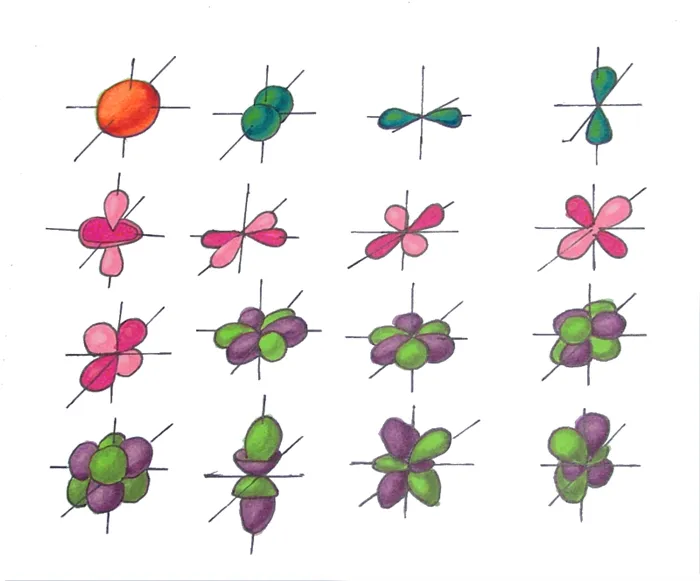
В s-глобуле одна орбиталь (l = 0) представляет два электрона в p-глобуле, три орбитали (l = 1) представляют шесть электронов в d-глобуле и пять орбиталей (l = 2) представляют десять электронов в f-глобуле. — аптека, семь орбиталей (l = 3) представляют 14 электронов
Магнитное квантовое число ml
p-глобус содержит три орбитали, обозначаемые от -l, до +l, т.е. p-патология (l = 1), с орбиталями ‘-1’, ‘0’ и ‘1’. Магнитное квантовое число обозначается буквой ml.
Внутри оболочки легче иметь электроны на разных орбиталях, поэтому первый электрон заполняет одну из орбиталей, и каждая электронная пара связана с ней.
Рассмотрим D-землю, которая соответствует L = 2, то есть пяти орбиталям (-2, -1, 0,1 и 2). Первые пять электронов заполняют кору, принимая значения Ml= -2, ml= -1, ml= 0, ml= 1, ml= 2.
Спиновое квантовое число ms
Спин — это направление вращения электрона вокруг своей оси, и поскольку существует два направления, квантовое число спина имеет два значения, +1/2 и -1/2. На одном энергетическом подуровне могут находиться только два электрона с противоположными спинами. Спин квантового числа обозначается ms
Главное квантовое число n
Основным квантовым числом является энергетический уровень, и сегодня известно семь энергетических уровней, каждый из которых представлен арабскими цифрами 1, 2 и 3. 7. количество снарядов на каждом уровне равно количеству уровней. Первый уровень имеет одну раковину, а следующий уровень — две раковины.
Номер электрона
Таким образом, каждый электрон может быть представлен четырьмя квантовыми числами, и комбинация этих чисел уникальна для каждой позиции электрона, начиная с первого электрона. Самый низкий энергетический уровень — N = 1, а первый уровень имеет оболочку. Первая оболочка на каждом уровне имеет форму сферы (s-оболочка). Это означает, что l = 0 и магнитное квантовое число может принимать только одно значение m.l= 0 и спин равен +1/2. Если взять пятый электрон (любого атома), то его главное квантовое число: N = 2, L = 1, M = -1, спин 1/2.
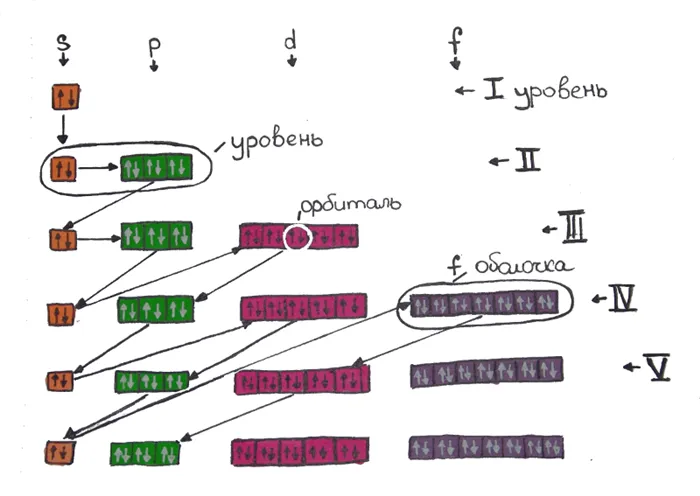
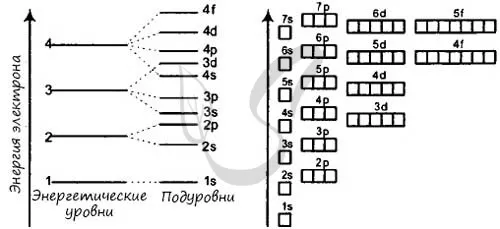
Ниже для наглядности показаны энергетические уровни подуровней, а также цвета, разделяющие уровни и подуровни сверху вниз.
Здесь энергетические уровни (1-7) показаны сверху вниз, а электронные подуровни (s, p, d, f) разбиты на группы слева направо, причем в каждой ячейке два электрона движутся в противоположных направлениях.. Общий принцип распределения электронов заключается в том, что энергетические подуровни заполняются в порядке суммы главных и орбитальных квантовых чисел. То есть, 1S, 2S, 2P, 3S, 3P, 4S, 3D и т.д. Если суммы одинаковы, то плоскость сначала заполняется меньшим главным квантовым числом N.
Некоторые элементы демонстрируют отклонения в формировании электронной конфигурации.24Cr,.29Cu,.41Nb,.42Мо,.44Ru,.45Aa.46Pd,.47Аг,.78Pt,.79Au.
Квантовое число — это тип кода для записи положения электронов в атоме. Если сравнивать человека с домом, то квантовое число — это адрес электрона: этаж, квартира, комната.
Периодическая система элементов
‘… Свойства элементов, а значит, простых и сложных объектов, образованных ими, периодически зависят от их атомной массы».
Такова формулировка периодического закона, написанная самим Д.И. Менделеевым.
Современная формулировка периодического закона звучит следующим образом
Свойства элементов и образованных из них соединений периодически зависят от величины ядерного заряда их атомов.
1. все элементы системы расположены в порядке возрастания ядерного заряда (= число протонов, следовательно, = число электронов)
2.Горизонтальные линии — это периоды. Их существует семь, в зависимости от количества энергетических уровней человека.
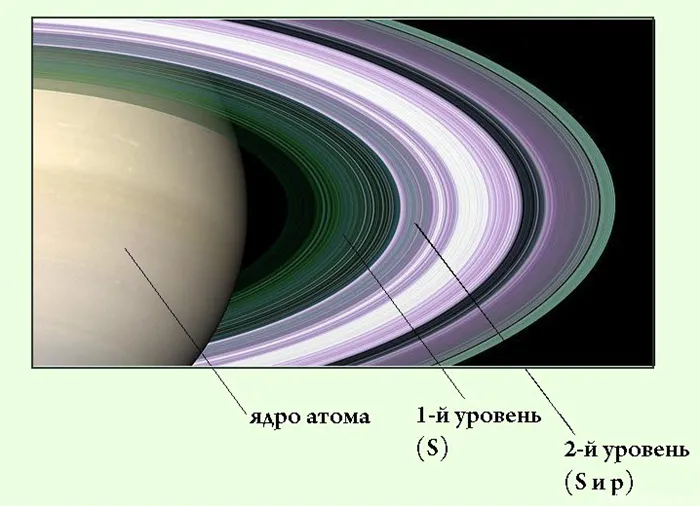
Первый период состоит из атомов, электронные оболочки которых состоят из плоскостей (элементы выделены красным цветом).
В периодической таблице каждый период начинается с атома щелочи, элемента с одним электроном на внешней поверхности, и заканчивается элементом с двумя (первый период) или восемью электронами (все последующие периоды) на внешней поверхности. Атомы редких газов.
Группы — вертикальные ряды — атомы располагаются по возрастанию заряда ядра, количества электронов, атомы одной группы имеют сходное электронное строение.
Номер группы соответствует количеству электронов на внешнем энергетическом уровне. В данном примере указана группа 6. Это означает, что все элементы этой группы имеют шесть электронов на внешнем энергетическом уровне.
Группа делится на подгруппы — главная (расположена слева), это подгруппы, содержащие элементы s- и p-, начиная с элементов первого и второго периода, а побочная группа (расположена справа) содержит элементы d.
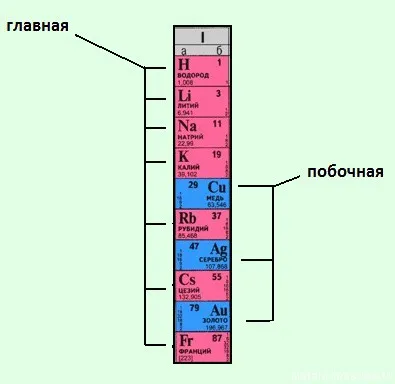
Максимальное число электронов на одном энергетическом уровне равно 8. Число переходных элементов (элементов в боковых подгруппах) определяется максимальным числом электронов на уровне d, которое составляет 10 в каждом из главных периодов.
Максимальное количество электронов на уровне:.
S — 2 электрона P — 6 D — 10
По аналогии с переходными элементами, число лантанинов и радиев, расположенных в виде независимых рядов в нижней части периодической системы, равно максимальному числу электронов в F, 14.
Теперь рассмотрим «содержимое» ячейки системы

- располагается в 5-ой группе, значит, на внешнем энергетическом уровне у него 5 электронов
Таким образом, содержимое периодической системы может быть использовано для анализа любого предмета.
Номер заказа товара
Количество внешних жизненно важных электронов
- в длиннопериодном варианте периодической таблицы элементы-металлы расположены в начале периодов, а также в побочных подгруппах.
- металлы оказываются левее и ниже этой прямой, неметаллы — правее и выше, а элементы, находящиеся вблизи прямой, имеют двойственную природу, иногда их называют металлоидами, или амфотерными элементами
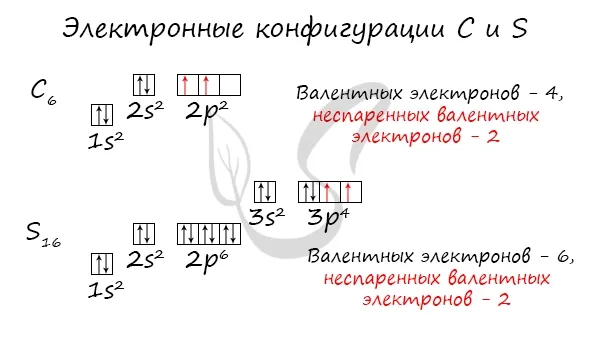
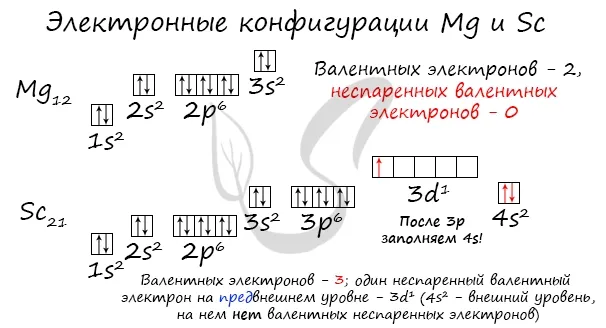
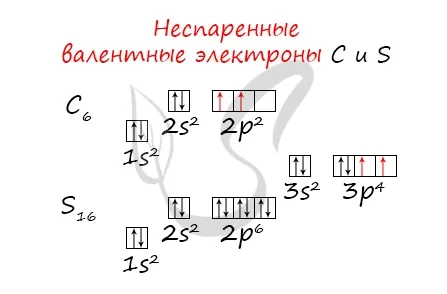
Отмечу особо: на уровне 2p углерод размещает два электрона в разных клетках, согласно одному из правил. На уровне 3p Бог доказал, что у него много электронов. Поэтому мы поместили первые три электрона в отдельные ячейки и использовали оставшиеся электроны для заполнения первой ячейки.
Атомы и электроны
Мы вступаем в химию — в молекулярный и персональный мир. В этой статье мы рассмотрим основные понятия и разберемся с элементами электронного типа.
Атом (греч. A-избегающая частица + volume — плоский, греч. — неделимый) — это электрически нейтральная микроскопическая и массивная частица, состоящая из положительно заряженного ядра (протона) и отрицательно заряженного электрона.
Описанная модель человека называется «планетарной моделью» и была предложена великими физиками Нильсом Бором и Эрнестом Резерфордом в 1913 году.
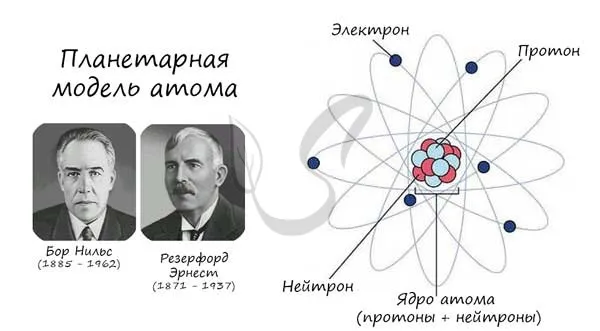
Протон (греч. proton — первый) — положительно заряженная (+1) элементарная частица, которая вместе с нейтроном образует ядро элементарного элемента. Нейтрон (нейтральный — ни тот, ни другой) — нейтральная (0) фундаментальная частица, присутствующая в ядре всех химических элементов, кроме водорода.
Электрон (греч. electron — mber) — неподвижная фундаментальная частица (-1) с отрицательным зарядом, заряд единицы — порядковый номер в таблице Mendeley — равен числу электронов (и, соответственно, протонов).
Помните, что в определенном состоянии человек содержит одинаковое количество электронов и протонов. Так, кальций (число 20) имеет 20 протонов в ядре и 20 электронов вокруг ядра на электронных орбиталях.

Еще раз подчеркнем эту важную деталь. В этот момент очень хорошо запомнить простое правило: количество элементов в одном = количеству электронов. Это очень важно для практического применения и изучения следующих предметов
Электронный состав человека.
Электроны человека находятся в постоянном движении вокруг ядра. Электроны занимают разные энергетические уровни, потому что энергия электронов между ними различна.
Подуровень S: состоит из ячейки ‘1S’, в которой находятся два электрона (заполнена электронами — 1S 2)
Подуровень S: состоит из ячейки «S» (2S 2), а подуровень P: состоит из трех ячеек «P» (2P 6).
Уровень s: состоит из клетки «s» (3s 2), плоскость p: 3 клетки «p» (3p 6) и уровень d: 5 клеток «d» (3d 10), которые вмещают 10 электронов.
Уровень s: состоит из клетки «s» (4s 2), уровень p: 3 клетки «p» (4p 6), уровень d: 5 клеток «d» (4d 10) и уровень F: 7. Элемент «F», содержащий 14 электронов (4f 14).
Зная теорию энергетических уровней и порядковый номер элементов в таблице Менделеева, необходимо разместить определенное количество электронов, начиная с самого низкого энергетического уровня и поднимаясь до самого высокого. Сразу же ниже вы увидите несколько примеров и узнаете об исключениях, подтверждающих эти правила.
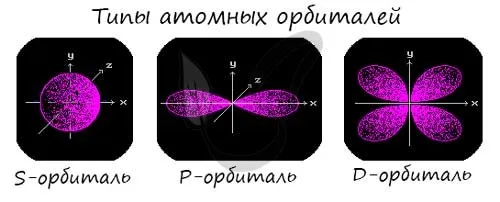
Подплоскости «S», «P» и «D», о которых мы только что говорили, имеют определенные конфигурации в пространстве. Электроны движутся по этим подплоскостям или отдельным орбитам, создавая определенные «узоры».
S-kygiko похож на шар, P-corg — на песочные часы, а D-breechtuler — на лист клевера.
Правила заполнения электронных орбит и примеры.
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной «ячейке») не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются еще одним электроном с противоположным направлением
- Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Второй уровень появляется во втором периоде. Он состоит из подуровней и p Второй уровень S-головы — это также S-троллейбус; P-троллейбус имеет три орбиты, находящиеся в разных положениях в пространстве. Каждая Р-тролль принимает один или два электрона, так что на Р-уровне находится до шести электронов.
Электрон и электронная оболочка атома
Нейтральные состоят из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронного облака), причем положительный и отрицательный заряды равны по абсолютной цене. При расчете относительных атомных масс массой электронов можно пренебречь. Это потому, что она в 1840 раз меньше массы протона или нейтрона.
Рисунок 1.Человек.
Электрон — это довольно уникальная частица с двойственными свойствами. Она обладает свойствами волны и частицы одновременно. Он постоянно перемещается вокруг ядра.
Пространство вокруг вероятного ядра электрона называется электронной орбитой или облаком. Это пространство имеет определенную форму, обозначаемую буквами s-, p-, d- и f-. S-электронные орбитали сферические, p-орбитали имеют форму гантели или объема, а d- и f-орбитали гораздо сложнее.
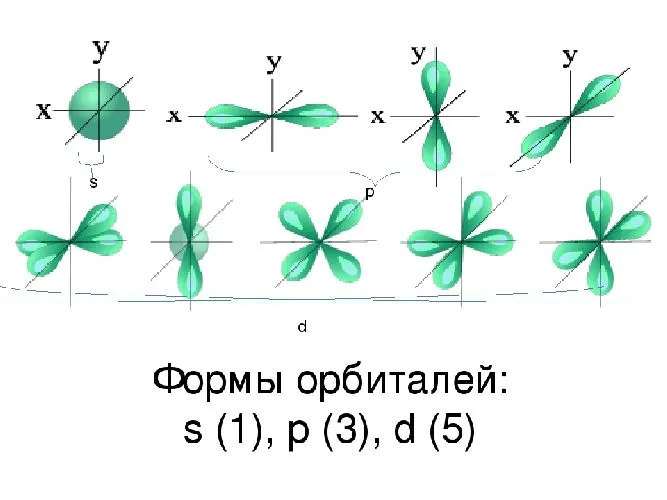
Рисунок 2. Возможные формы орбитальных электронов.
Вокруг ядра электроны прикреплены к слоям электронов. Каждый слой характеризуется расстоянием от ядра и энергией. Поэтому электронные слои часто называют энергетическими уровнями. Чем ближе уровень к ядру, тем ниже его электронная энергия. Один элемент отличается от другого по количеству протонов в индивидуальном ядре и, соответственно, по количеству электронов. Таким образом, количество электронов в электронной оболочке нейтрального человека равно количеству протонов в его ядре. Каждый последующий элемент имеет еще один протон в ядре и еще один электрон в электронной коре.
Новый входящий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне задается следующим видом
где n — максимальное число электронов, а n — энергетическое число.
Первый уровень имеет только два электрона, второй уровень — восемь электронов, третий уровень — 18 электронов и четвертый уровень — 32 электрона. Внешние уровни человека не могут вместить более восьми электронов. Как только число электронов достигает 8, они начинают заполнять следующий, расположенный дальше от ядра.
Строение электронных оболочек атомов
Каждый пункт — это определенный период. Период — это горизонтальный набор элементов в колонках по возрастанию ядерной нагрузки, начиная со щелочных металлов и заканчивая инертными газами. Первые три периода в таблице являются вторичными, последующие, начиная с четвертого периода, являются первичными и состоят из двух строк. Количество периодов, в которых находятся элементы, является естественным. Это означает, что в каждом человеке-элементе в определенный период присутствует определенный уровень энергии. Например, элемент хлора CL находится в периоде 3. Это означает, что в его электронной коре имеется три электронных слоя. Хлор относится к группе VII таблицы и находится в главной подгруппе. Главная подгруппа — это столбец внутри каждой группы, начинающийся с периода 1 или 2.
Таким образом, состояния электронных оболочек атома хлора выглядят следующим образом Число последовательностей хлора составляет 17. Это означает, что он имеет 17 протонов в ядре и 17 электронов в электронной коре. Поскольку хлор относится к главной подгруппе VII, на первом уровне может быть только два электрона, а на третьем — семь. Тогда на втором уровне находится 17-2-7 = 8 электронов.
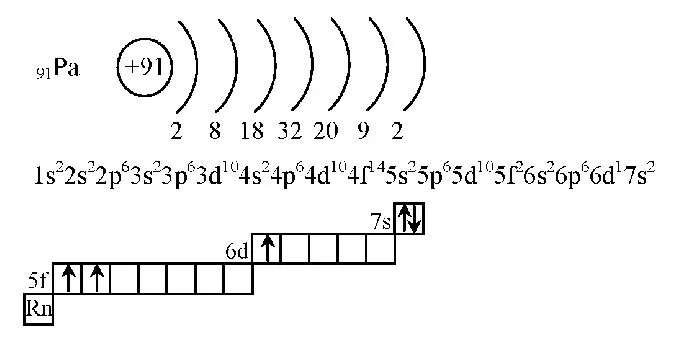
Рисунок 3.Диаграмма структуры электронной оболочки человека.








