Физиологический эффект аммиака обусловлен сильным запахом аммиака, который стимулирует специфические рецепторы в слизистой оболочке носа и стимулирует дыхательные и вазомоторные центры мозга, что приводит к увеличению дыхания и повышению кровяного давления.
Физиологический эффект аммиака обусловлен сильным запахом аммиака, который стимулирует специфические рецепторы в слизистой оболочке носа и стимулирует дыхательные и вазомоторные центры мозга, что приводит к увеличению дыхания и повышению кровяного давления.
Химические свойства аммиака
Сильный запах аммиака известен людям с доисторических времен, поскольку этот газ образуется в значительных количествах в процессе разложения, гниения и сухой перегонки азотистых органических соединений, таких как мочевина или белки.
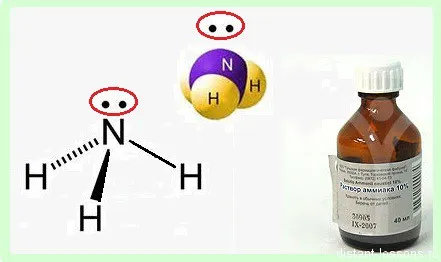
Аммиак — это NH3нитрид водорода, при нормальных условиях представляет собой бесцветный газ с сильным характерным запахом (запах аммиака).
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожу. Это то, что люди воспринимают как сильный запах. Пары аммиака вызывают сильное слезотечение из глаз, боль в глазах, ожоги конъюнктивы и роговицы, нарушения зрения, приступы кашля, покраснение и зуд кожи.
Токсичен для человека в больших количествах.
Химические свойства аммиака
Своими интересными химическими свойствами молекула аммиака обязана атому азота — p-элементу 2-го периода V группы периодической таблицы, который имеет 5 электронов на внешнем энергетическом уровне.
В 3 ковалентных связях с водородом расходуется 3 электрона. 2 остаются. Эти 2 неспаренных электрона образуют пару неспаренных электронов.
Эта свободная пара неспаренных электронов определяет многие химические свойства аммиака.
— Аммиак имеет неспаренную пару электронов, но ион водорода имеет полностью свободную орбиталь,
- молекула аммиака полярна — отрицательный заряд двух электронов и положительный — от трех водородов, поэтому вещество хорошо растворимо в воде, более того, водный раствор аммиака — широко известный « нашатырный спирт » — жидкость с очень характерным запахом
Формула для этого решения часто записывается в таком виде:
NH4OH — гидроксид аммония. Поскольку азот притягивает водород из воды, аммиак является химически слабым основанием, т.е. он очень слабо растворяется в NH4 + (ион аммония) и OH — гидроксид-ион.
- соответственно, водород «любит» все, что содержит водород, например, кислоты:
NH3 + HCL → NH4Cl — хлорид аммония
- к химическим свойствам аммиака относится и вытеснение металлов из водных растворов солей:
- к химическим свойствам аммиака относятся и реакции окисления :
(аммиак окисляется до азота).
Горит в чистом кислороде бледно-желтым пламенем:
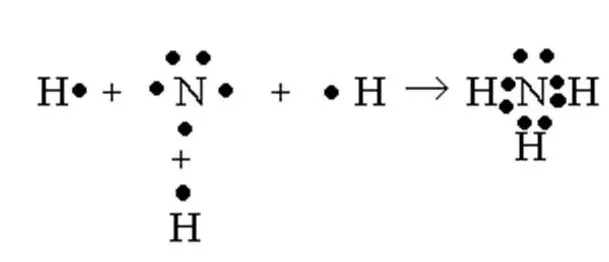
- аммиак не восстанавливается, т.к. атом азота находится в низшей (№ группы-8) степени окисления;
Качественные реакции для аммиака:
- изменение окраски индикатора в водном растворе аммиака (щелочная среда):
Литий становится синим, фенолфталеин — малиновым, метиловый оранжевый — желтым,
-
Если в пробирке с NH3 (NH3•H2O или NH4OH), подержите палочку, погруженную в концентрированную соляную кислоту HCl, и вы увидите видимый белый дым — хлорид аммония (NH4Cl),
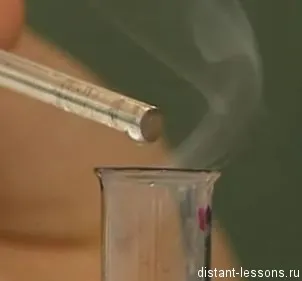
Свойства солей аммония:
-
кристаллическая решетка;
- в растворе диссоциируют:
- подвергаются гидролизу с образованием кислой среды: гидролиз по катиону:
Гидролиз катионов и анионов:
- свойства солей аммония соответствуют свойствам всех других солей — взаимодействие с основаниями, другими солями и кислотами. Главные условия протекания таких реакций до конца — образование газа, осадка или малодиссоциирующего вещества;
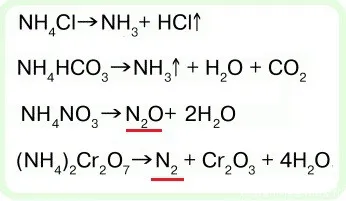
- важное химическое свойство солей аммония — разложение при нагревании:
2. будучи основанием, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Физические и химические свойства аммиака
Формула: NH3. Его молекулярная масса составляет 17 г/моль.
Аммиак (NH3) — бесцветный газ с сильным запахом (запах аммиака), легче воздуха, хорошо растворим в воде (один объем воды растворяет до 700 объемов аммиака). Концентрированный раствор аммиака содержит 25 % (по массе) аммиака и имеет плотность 0,91 г/см3 .
Связи между атомами молекулы аммиака являются ковалентными. Общий вид молекулы AB3. Все валентные орбитали атома азота вступают в гибридизацию, поэтому тип гибридизации молекулы аммиака — sp 3. Аммиак имеет геометрическую структуру типа AB3Треугольная пирамида типа Е (рис. 1).
Рисунок 1. Структура молекулы аммиака.
Химические свойства аммиака
Химически аммиак очень реактивен: он вступает в реакцию со многими веществами. Степень окисления азота в аммиаке «-3» минимальна, поэтому аммиак обладает только восстановительными свойствами.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
В присутствии катализатора аммиак может быть окислен до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O (катализатор: платина)
В отличие от водородных соединений неметаллических групп VI и VII, аммиак не проявляет кислотных свойств. Однако атомы водорода в его молекуле могут быть заменены атомами металла. Когда водород полностью замещается металлом, образуются соединения, известные как нитриды, которые также могут образовываться при прямом взаимодействии азота с металлом при высоких температурах.
Важнейшие свойства аммиака обусловлены наличием несоразмерной пары электронов у атома азота. Раствор аммиака в воде имеет щелочную среду:
Когда аммиак реагирует с кислотами, образуются соли аммония, которые разлагаются при нагревании:
NH4Cl = NH3 + HCl (при нагревании)
Производство аммиака является одним из важнейших технологических процессов в мире. Ежегодно в мире производится около 100 миллионов тонн аммиака. Аммиак производится в жидком виде или в форме 25%-ного водного раствора — аммиачной воды. Наиболее важными областями применения аммиака являются производство азотной кислоты (позднее — производство азотных минеральных удобрений), аммонийных солей, мочевины, уротропина и синтетических волокон (нейлон и капрон). Аммиак используется как хладагент в промышленном охлаждении, как отбеливающее вещество при очистке и окрашивании хлопка, шерсти и шелка.
| Назначение | Какая масса и объем аммиака требуется для производства 5 тонн аммиачной селитры? |
| Решение | Запишем уравнение реакции получения нитрата аммония из аммиака и азотной кислоты: |
Согласно уравнению реакции, количество нитрата аммония равно 1 моль — v(NH4NO3) = 1 моль. Затем масса нитрата аммония рассчитывается по уравнению реакции:
Согласно уравнению реакции, количество аммиачного вещества также равно 1 моль — v(NH3) = 1 моль. Затем масса аммиака рассчитывается по уравнению:
2. будучи основанием, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
(особенно для аммонийных солей)
1. сильные основания вытесняют NH3 из аммонийной соли:
Это качественная реакция, в которой NH4 + (NH3 можно определить по запаху или синему цвету жидкости красная литиевая бумага).
2. соли аммония разлагаются при нагревании:
(a) При разложении солей аммония, содержащих неокисляемый анион, NH.3:
(b) Если соль содержит окисляющий анион, происходит межмолекулярное окислительно-восстановительное разложение:
Аммиак окисляется кислородом до азота или оксида азота (\(II\)). Результат реакции зависит от условий, в которых она протекает.
Аммиак
Аммиак является одним из наиболее важных соединений азота. Азот, компонент белков и нуклеиновых кислот, является одним из строительных блоков жизни. Поэтому важно было научиться синтезировать химические соединения с азотом. Первоначально использовалось электричество, но этот метод оказался слишком дорогим. Более простым методом была химическая реакция, при которой азот в воздухе соединялся с водородом, образуя химическое соединение под названием аммиак!
Промышленное производство аммиака — это прямой синтез из простых веществ. Как упоминалось ранее, источником азота является воздух, а водород получают из воды.

Аммиак. Водный раствор
Реакция синтеза аммиака является обратимой, поэтому важно выбрать условия, при которых выход аммиака в химической реакции будет наибольшим. Для этого реакцию проводят при высоком давлении (от 15 до 100 МПа). Во время реакции объем газов (водорода и азота) уменьшается в два раза, поэтому высокое давление позволяет увеличить количество производимого аммиака. Катализатором этой реакции может быть губчатое железо. Интересно, что железная губка действует как катализатор только при температурах выше 500 0 °C. Однако повышение температуры способствует распаду молекулы аммиака на водород и азот. Чтобы предотвратить расщепление молекул, полученный аммиак охлаждается, как только газовая смесь проходит через губку. Кроме того, аммиак становится жидким при сильном охлаждении.
В лабораторных условиях аммиак может быть получен из смеси твердого хлорида аммония (NH4Cl и известь. При нагревании сильно выделяется аммиак.
Свойства аммиака
Аммиак — это газ, который при нормальных условиях имеет сильный и неприятный запах. Аммиак токсичен! При температуре 20 0 C 700 литров аммиака растворяются в воде. Растворенный раствор называется аммиачной водой. Из-за этой растворимости аммиак не следует собирать и хранить над водой.
Аммиак является активным восстановителем. Это свойство обусловлено атомами азота, которые имеют степень окисления -3. Восстановительные свойства азота наблюдаются при сжигании аммиака на воздухе. Поскольку наиболее стабильная степень окисления азота равна 0, в этой реакции высвобождается свободный азот.
Когда катализаторы (платина Pt и оксид хрома Cr2O3), образуется монооксид азота.
Аммиак может восстанавливать металлы из их оксидов. Например, реакция с оксидом меди используется для получения азота.

Реакция гидроксида меди с аммиаком
Аммиак обладает свойствами оснований и щелочей. При растворении в воде образуются ион аммония и гидроксид-ион. Соединение NH4OH — не существует! Поэтому лучше написать формулу аммиачной воды, чем формулу аммиака!
Основные свойства аммиака проявляются также в реакциях с кислотами.
Аммиак реагирует с органическими веществами. Например, искусственные аминокислоты получают путем реакции аммиака с А-хлорзамещенными карбоновыми кислотами. Выделяющийся в ходе реакции хлористый водород (газ HCl) соединяется с избытком аммиака с получением аммиака (или хлорида аммония NH4Cl).








