В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
3.1. Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь.
Очень редко, если вообще когда-либо, химическое вещество состоит из одного несвязанного атома химического элемента. Только небольшое количество газов, так называемых благородных газов, таких как гелий, неон, аргон, криптон, ксенон и радон, имеют такую структуру при нормальных условиях. Однако в большинстве случаев химические вещества состоят не из отдельных веществ, а объединяются и делятся на различные группы. Такие скопления особей могут состоять из нескольких единиц, сотен, тысяч или даже более особей. Сила, объединяющая атомы в такие группы, называется химической связью.
Другими словами, химические связи — это взаимодействия, которые объединяют индивидов вместе, образуя более сложные структуры (например, молекулы, ионы, радикалы, кристаллы).
Химические связи образуются потому, что энергия наиболее сложных структур меньше, чем суммарная энергия отдельных атомов, которые их образуют.
Поэтому, особенно когда молекула XY образуется при взаимодействии атомов X и Y, это означает, что внутренняя энергия молекулы этого вещества ниже, чем внутренняя энергия отдельных атомов, из которых она образована.
По этой причине энергия высвобождается при образовании химических связей между индивидами.
Проще говоря, химические связи можно рассматривать как основанные на электростатических силах, возникающих в результате взаимодействия между положительно заряженными ядрами и отрицательно заряженными электронами.
В образовании химических связей в основных подгруппах элементов участвуют электроны во внешней электронной оболочке, называемые валентными электронами, которые имеют наименьшую энергию связи с ядром. Например, в случае бора это электроны на двух энергетических уровнях: два электрона на двух s-орбиталях и один электрон на двух p-орбиталях.
Во время образования химических связей каждый атом стремится приобрести электронную конфигурацию атома благородного газа. Это означает, что во внешней электронной оболочке находится восемь электронов (два в элементах первого периода). Это явление известно как правило октета.
Атомы могут достигать конфигурации редкогазовых электронов, если сначала у них есть атом, который делится некоторыми своими валентными электронами с другими атомами. Таким образом, образуются общие электронные пары.
В зависимости от степени распределения электронов различают ковалентные, ионные и металлические связи.
Ковалентная связь
Ковалентные связи более распространены среди неметаллических индивидов. Если неметаллические атомы, образующие ковалентную связь, принадлежат к разным химическим элементам, такая связь называется ковалентной полярной связью. Причина такого названия в том, что атомы разных элементов обладают разной способностью притягивать общие электронные пары. Очевидно, что при этом общая электронная пара смещается в сторону одного из атомов, и на нем образуется отрицательный заряд. Затем на другом образуется частичный положительный заряд. Например, в молекуле хлористого водорода электронная пара смещается от атома водорода к атому хлора.
Примеры веществ с ковалентными связями:.
Ковалентные неполярные связи образуются между неметаллическими атомами одного и того же химического элемента. Поскольку атомы идентичны, они обладают одинаковой способностью притягивать общие электроны к атому. Поэтому смещения электронных пар не наблюдается.
Приведенный выше механизм образования ковалентной связи называется механизмом обмена, когда оба атома вносят электроны для образования общей электронной пары.
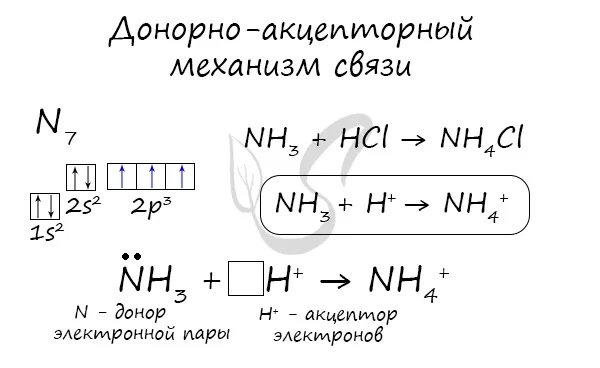
Существует также механизм донора и реципиента.
В механизме ковалентной связи донор-реципиент общая электронная пара образуется за счет полной орбитали (содержащей два электрона) в одном атоме и пустой орбитали в другом. Донор неделимой электронной пары называется донором, а человек с пустой орбиталью — реципиентом. Лица с электронными парами, такие как N, O, P и S, могут выступать в качестве доноров электронных пар.
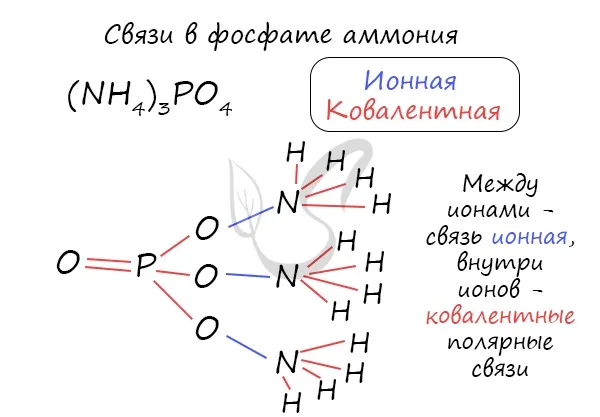
Например, четвертая ковалентная связь N-H с катионом аммония NH.4 +:.
Помимо полярности, ковалентные связи также характеризуются энергией. Энергия связи — это минимальная энергия, необходимая для разрыва связи между индивидами.
Энергия связи уменьшается по мере увеличения радиуса связывающего атома. Как мы знаем, атомные линии увеличиваются вниз внутри подгрупп, поэтому мы можем заключить, например, что прочность связи галоген-водород увеличивается в следующем порядке
Энергия связи также зависит от ее кратности. Чем больше кратность связи, тем больше ее энергия. Множественность связей относится к числу общих электронных пар между двумя атомами.
Ионная связь
Ионные связи можно рассматривать как пограничный случай ковалентных полярных связей. В ковалентной связи общая электронная пара частично передается одному из парных атомов, тогда как в ионной связи она почти полностью «передается» одному из атомов. Атом (a), отдающий электрон, становится положительно заряженным и превращается в катион, а атом, принимающий электрон, становится отрицательно заряженным и превращается в анион.
Ионные связи — это связи, образованные электростатическим притяжением катиона к аниону.
Образование этого типа связи характерно для типичных взаимодействий атомов металлов с типичными атомами неметаллов.
Например, фторид калия. Катионы калия образуются в результате отделения электронов от нейтральных атомов, а ионы фтора образуются в результате присоединения электронов к атомам фтора.
Электростатическое притяжение между образующимися ионами приводит к образованию ионной связи.
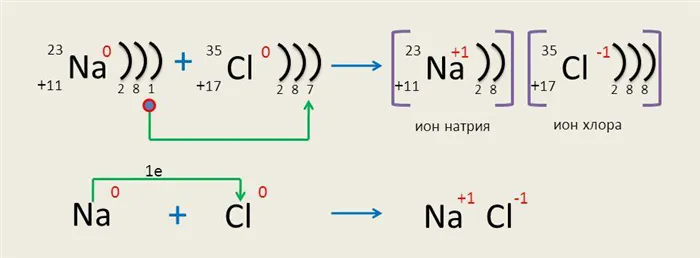
Во время образования химической связи электроны от атома натрия переходят к атому хлора, образуя противоположно заряженные ионы. Эти ионы имеют интегрированный внешний энергетический уровень.
Электроны с атома металла не удаляются полностью, а только смещаются к атому хлора, как в случае ковалентной связи.
Большинство бинарных соединений, содержащих атомы металлов, являются ионными. Примеры включают оксиды, галогениды, сульфиды и нитриды.
Ионная связь может возникать между одним катионом и одним анионом (F-, Cl-, S 2-), а также между одним катионом и комплексным анионом (NO3 -, поэтому4 2-, PO4 3-, OH-). Поэтому ионные соединения включают в себя как соли, так и основания (Na2Нет-, значит.4, Cu(NO3)2(NH4)2Нет-, значит.4(OH), Ca(OH)2(NaOH).
Например, фторид калия. Катионы калия образуются в результате отделения электронов от нейтральных атомов, а ионы фтора образуются в результате присоединения электронов к атомам фтора.
Химические связи
Химические связи — это связи между атомами в молекуле или молекулярном соединении, которые возникают в результате передачи электронов от одного атома к другому или накопления электронов в обоих атомах.
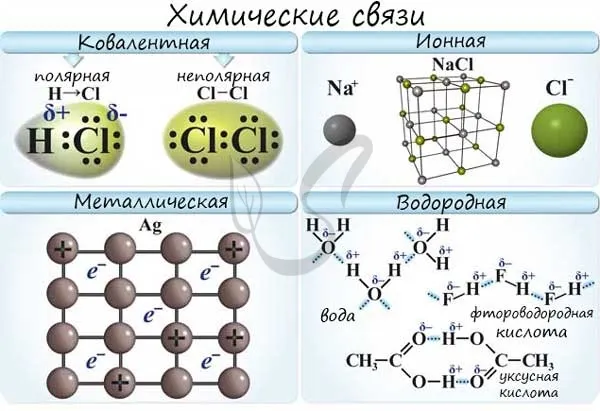
Существует несколько типов химических связей, включая ковалентные связи, ионные связи, металлические связи и водородные связи.
Ковалентные связи (лат. co — вместе + valens — имеющий силу)
Ковалентные связи возникают между двумя атомами по обменному механизму (обмен электронными парами) или донорно-реципиентному механизму (донорный электрон и реципиентная свободная орбиталь).
В простых веществах (Cl2, Br2, O2), органические вещества (C2H2) и, в целом, между одним неметаллическим атомом и другим (NH3H, H2O, HBr).
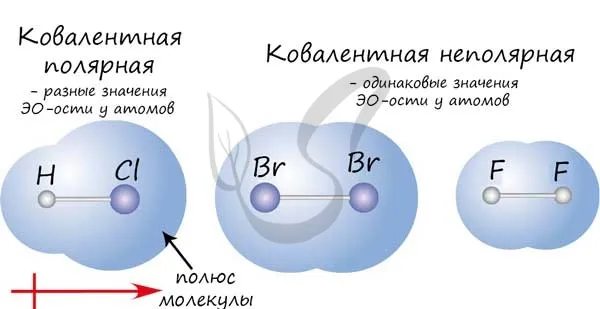
Если атомы, образующие ковалентную связь, имеют одинаковую электроотрицательность, связь между ними называется ковалентной неполярной связью. Такие молекулы не имеют «полюсов». Плотность электронов распределена равномерно. Например, Cl2, O2H, H2, N2, I.2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, связь между ними называется ковалентной полярностью. Такие молекулы имеют «полюса», и электронная плотность смещается в сторону элемента с наибольшей электроотрицательностью. Примеры: HCl, HBr, HI, NH3H, H2O.
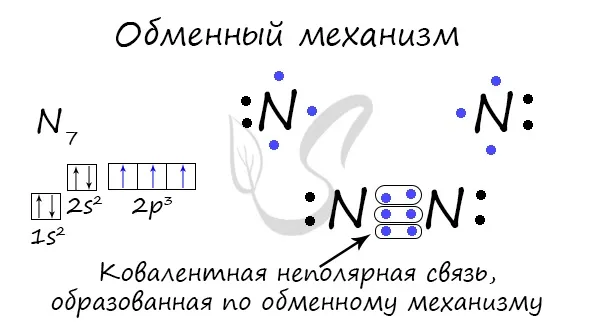
Ковалентные связи могут образовываться по механизму обмена (извещение об электронной паре). В этом случае каждый человек вносит «равный» вклад в облигацию. Например, два атома азота, образующие молекулу N2молекулы дают по три электрона с внешней размерной границы для связи.
Ковалентные связи имеют механизм донор-реципиент, в котором индивид выступает в качестве донора неделимой электронной пары. Другой атом не тратит свои электроны, а предоставляет только одну орбиталь (ячейку) для этой электронной пары.
- NH4 + — в ионе аммония
- NH4 + Cl, NH4 + Br — внутри иона аммония во всех его солях
- Нет.3 — — в нитрат ионе
- KNO3, LiNO3 — внутри нитрат иона во всех нитратах
- O3 — озон
- H3O + — ион гидроксония
- CO — угарный газ
- KAl(OH)4На.2Цинк (OH)4 — во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму
Ионная связь
Ионные связи — это тип химической связи, основанный на электростатическом взаимодействии между противоположно заряженными ионами.
В наиболее распространенных случаях ионные связи образуются между типичным металлом и типичным неметаллом. Пример.
Все соли имеют ионные связи, поэтому таблица растворимости содержит крупные элементы: CaSO4На.3PO4. Ионы аммония не являются исключением — между катионами аммония и различными анионами образуются ионные связи. NH-соединения4I, NH.4Нет.3(NH4)2Нет-, значит.4.
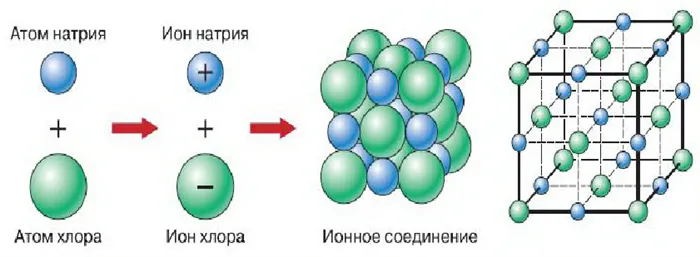
Кулоновское притяжение, направленное одинаково во все стороны, заставляет ионы с разными зарядами двигаться навстречу друг другу. В результате такого притяжения образуются ионные кристаллы, в которых заряды ионов чередуются. Каждый ион имеет определенное число ближайших соседей, называемое резонансным числом.
Типы химических связей, примеры с пояснениями
Ионные химические связи обусловлены притяжением ионов разной полярности.
Ионы — это заряженные частицы, образующиеся в результате доставки или приема электронов атомами.
Чтобы проиллюстрировать образование ионных связей, возьмем в качестве примера хлор и натрий.
Электрические поля ионов действуют во всех направлениях, и каждый положительный ион окружен отрицательными ионами, поэтому их соединения четко структурированы гигантскими группами. Благодаря прочности ионных связей эти вещества имеют высокие температуры плавления и кипения.
Ионно-связанные вещества: пищевая сода, поваренная соль, сульфат меди.
Водородная химическая связь
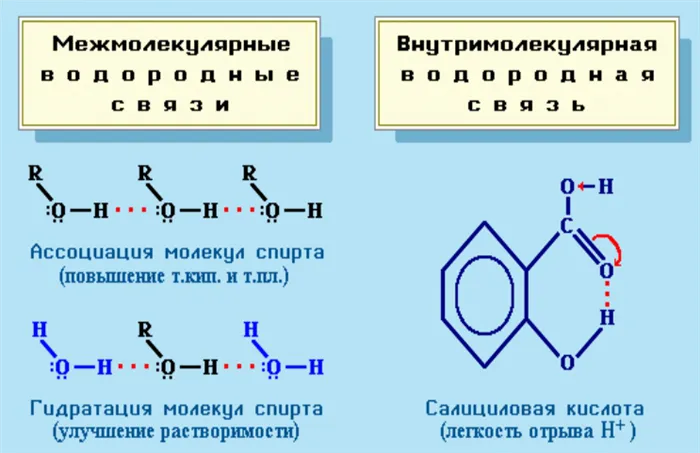
Химические водородные связи или H-связи возникают между положительно заряженным атомом водорода и отрицательно заряженным атомом другого вещества. Они могут быть как внутримолекулярными, так и внутримолекулярными.
Внутримолекулярные связи образуются между молекулами вещества, а внутримолекулярные — между его компонентами. Водородные связи наблюдаются в многоатомных спиртах, белках, углеводах и некоторых других органических соединениях.
Понятие и термин «водородная связь» были введены в науку в 1920 году для объяснения высоких температур кипения воды, спиртов и других соединений В. Латимером и Р. Родебушем. Латимер и Р. Родебуш.
Связи не только повышают температуру кипения, но и появляются в структуре кристаллической решетки веществ. В качестве примера рассмотрим структуру кристаллических решеток льда — она такова, что расстояние между отдельными особями, остающимися на поверхности воды, настолько велико, что рыбы и другие водные обитатели становятся очень крупными, что влияет на экологию водных ресурсов. Он существует благодаря такому замечательному свойству, как водородная связь.
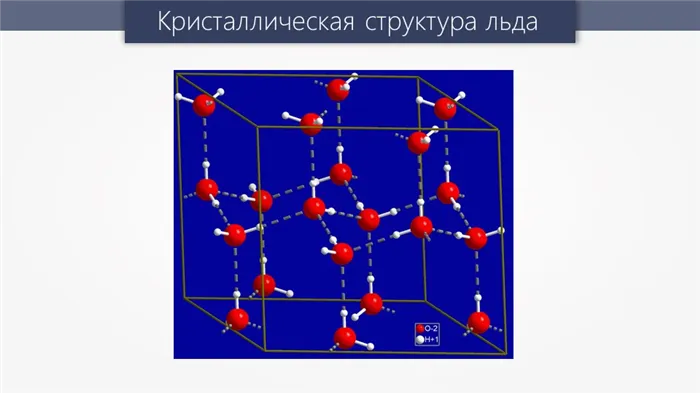
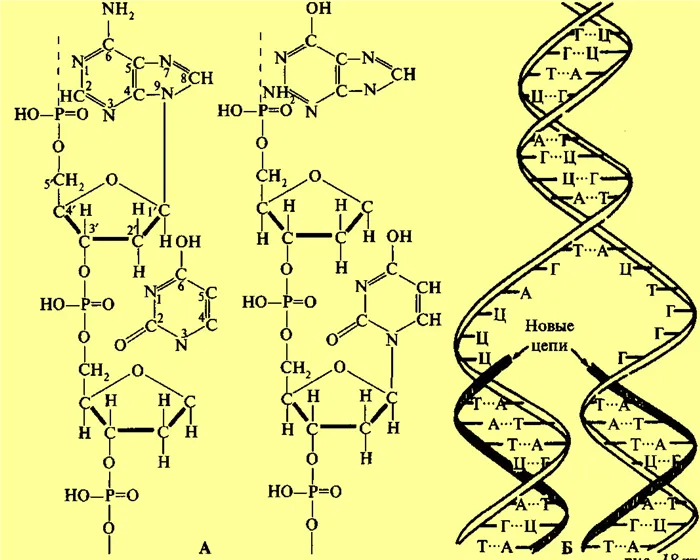
Водородные связи играют важную роль в биологии, потому что знаменитый двойной пропеллер ДНК имеет двойную связь или между нуклеотидами двух нитей ДНК, аденином — дождем и гуанином — цитозином. Это следует из приведенной ниже диаграммы.
Химическая связь металлов
Металлическая связь — это связь, образованная между положительным ионом и атомом металла посредством свободного электрона.
Такая связь возможна благодаря специфической структуре металла — между орбиталями имеются большие лучи, а снаружи находится относительно мало электронов. Электроны могут легко отскочить и превратить человека в активно заряженный ион. Свободные электроны легко переходят к другому иону, который присоединяется к нему и превращает его в человека. Затем цикл повторяется.
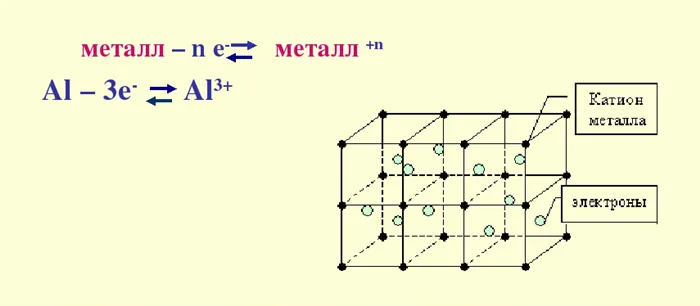
По этой причине все металлы обладают схожими свойствами, такими как твердость, высокая тепло- и электропроводность, характерный металлический блеск и пластичность. Этими свойствами обладают чистые металлы, такие как железо, медь, золото, алюминий и сплавы, такие как бронза, алюминий и дюралюминий.
В этой области пространства проявляются чрезмерные отрицательные нагрузки. А ядро индивида, как известно, несет положительную нагрузку. Поэтому ядра обоих притягиваются к общему отрицательному заряду, возникающему из-за пересечения электронных облаков. Поэтому.
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задание 1: Из предложенного вам списка выберите два соединения с ионно-химическими связями.
Решение: ионно-химические связи характерны для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли — это варианты 1 и 3.
Задание 2: Из предложенного вам списка выберите два соединения с ковалентными химическими связями.
Напишите в поле ответа количество выбранных соединений. Решение: ковалентные связи характерны для простых неметаллических веществ и неметаллических неметаллических соединений. Простыми веществами являются хлор и сероуглерод. Следовательно, ответы 1 и 2.
Вопрос 3: Из приведенного вам списка выберите два соединения с ковалентными полярными химическими связями.
Решение: между двумя различными неметаллами образуется ковалентная полярная связь. Ответ 34.
Задание 4. Выберите из предложенного вам списка два соединения с водородными химическими связями.
Решение: водородная химическая связь образуется между молекулой воды и одноатомным спиртом. Ответ 14.
Задание 5. Из приведенного списка выберите два соединения, для которых ковалентные связи образуются по механизму донор — приемник.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: механизм связи донор — приемник характерен для ионов аммония и монооксида углерода, так как в азоте и углероде имеются неразрывные электронные пары соответственно. Ответ: 25.
Задание 6. Выберите из приведенного списка два соединения, которые имеют ковалентную неполярную химическую связь.
Запишите номер выбранного соединения в поле ответа. Решение: между одинаковыми людьми образуются ковалентные неполярные связи. Это фтор и кислород.
Задание 7. Из предложенного вам списка выберите два вещества, каждое из которых образует ионную связь.
Напишите количество выбранных вами соединений в диапазоне ответов. Решение: ионные связи образуются между металлами и неметаллами. Сера не является металлом, поэтому вы должны выбрать металлы. Натрий и кальций.
Задание 8. Из предложенного вам списка выберите два вещества, молекулы которых имеют как полярные, так и неполярные связи.
Решение: молекула номер 1 имеет четыре связи C-CL, все из которых полярные, но при работе нужно найти молекулу, которая имеет как полярные, так и неполярные связи.
Молекула бензола (номер 2) имеет два типа связи: С-С неполярная и С-Н полярная.
Молекула HNO3 содержит три кислородные связи, но они не соединены друг с другом, и существует только два типа полярных связей H-N.
Молекула N2O4 содержит два типа связей: неполярную связь N-N и полярную связь N-O.
В молекулах углекислого газа кислород связан только с углеродом и образует только полярные связи. Ответ 24.
Задание 9. Выберите из приведенного списка два вещества, которые имеют металлические связи.
Решение: металлическая связь — это свойство металлов и сплавов. Металлы здесь — железо и цинк. Ответ 35.








