При контакте с кожей жжет и выглядит как соляная кислота. Вонь. Если вы видите в фильме, как кто-то бросает труп в емкость с перхлорной кислотой и он плавится, да, это возможно, но это может быть много или жарко. Он может взорваться при нагревании (см. выше). Столь критическое отношение к фильму (кажется, я видел его в «Кловерфилд 10»).
Амфотерные металлы: цинк и алюминий
Некоторые люди любят соленое, некоторые — сладкое, некоторые любят и то, и другое. То же самое относится и к амфотерным металлам.
Амфотерность означает способность соединения проявлять как кислотные, так и основные свойства в зависимости от условий и свойств реактантов, участвующих в реакции.
Список амфотерных металлов включает множество названий. Из них мы рассмотрим цинк и алюминий.
Характеристики элементов-металлов
Алюминий является элементом группы IIIA третьего периода. Его электронная конфигурация — Ne3s23p1.
В возбужденном состоянии пары электронов на орбитали 3s испаряются. В результате образуются три неспаренных электрона, которые могут образовывать химические связи. Поэтому алюминий имеет стабильную степень окисления +3.
Цинк — входит в группу IIB четвертого периода. Цинк относится к d-элементу, и атомы цинка полностью заполнили 3d и 4s электронные подуровни.
Электронная конфигурация в основном состоянии — Ar3d104s2. В соединениях цинк проявляет постоянную степень окисления +2.
Физические свойства

Алюминий — легкий, серебристо-белый металл, образующий на воздухе оксидную пленку в результате взаимодействия с кислородом (см. рисунок слева). Алюминий часто используется для изготовления тысяч вещей, которые окружают нас в повседневной жизни: от фольги в баночке из-под йогурта до изящного корпуса смартфона.
Цинк — это голубовато-белый металл (на фото справа).
Воздух является его основным газом и окружает нас повсюду. Жизнь растений ослаблена без него и без удобрений. Важный элемент живет в наших клетках … (азот).
Разложение
Кислородсодержащие кислоты разлагаются с образованием кислотных оксидов и воды. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот требуется тепло или излучение (HCl, HNO3, H3PO4), другие самопроизвольно разлагаются в процессе образования (H2CO3, H2SO3, HNO2).
Металл может замещать водород из кислоты, только если он находится слева от водорода в активной последовательности металла. Продуктами реакции являются соли и водород.

При взаимодействии с окислительными кислотами, такими как азотная кислота, образуются продукты кислотного восстановления, но процесс реакции также неоднозначен.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакцию с металлами. Продукты реакции зависят от активности металла и концентрации кислоты.
Таблица: химические свойства кислот-окислителей
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами с образованием солей и воды. Взаимодействие между кислотой и основанием называется реакцией нейтрализации.
Сильные кислоты вытесняют слабые кислоты из растворов солей, образуя новые соли и новые кислоты. Когда кислота реагирует с солью, одним из продуктов реакции должна быть нерастворимая соль или слабая кислота, вода или газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуются соли и вода.
Некислородные кислоты (кроме HF) могут реагировать с различными окислителями через химические элементы, входящие в состав анионов.
Например, диоксид марганца MnO2и перманганат калия KMnO4Дихромат калия2cr (дихромат калия), дихромат калия2o7Результатом этих реакций является образование свободных галогенов.
Из лошадиных наркотических кислот наибольшим восстановительным действием обладает гидрат йода. Он может быть окислен оксидом железа (III) и тривиальным железом.
Высокая восстановительная активность характерна для сероводорода, который может быть окислен диоксидом серы.
Кислоты являются электролитами, образующими при распаде катионы водорода и кислотные остатки. Кислоты постепенно разделяются. Кислоты делятся на две группы в зависимости от их способности к разделению.
Вещества этой категории характеризуются наличием функциональной группы химических свойств — группы OH. По отношению к растворителям различают щелочные (растворимые) и нерастворимые основания. Точно так же они различаются по своим химическим свойствам. Щелочная среда образуется при наличии свободного OH, образующегося при расщеплении щелочи.
Основания и их свойства
Для щелочей и полибазовых кислот характерно постепенное расщепление.
Однако щелочи реагируют не только с кислотами, но и с нерастворимыми основаниями. Причина этого заключается в том, что почти все кислоты растворимы, за исключением силикатной H
сио.2реагируют только со щелочами. Продукт зависит от соли (реагентной, средней, основной или кислой, в зависимости от соотношения) и воды.3Окисленные кислые соли в сочетании со щелочами образуют соль и воду.
Эта реакция не характерна для нерастворимых оснований, так как именно гидроксильные группы реагируют с оксидом.
Оба хвостовых основания также реагируют со щелочами. Результатом этого взаимодействия является соль, часто сложная, воды.
Взаимодействие соли и щелочи приводит к образованию солей или оснований. Также учитывайте условия, требующие наличия в продукте газа или осадка.
Нерастворимые основания и двухстороннее дно имеют особые характеристики. При нагревании они разлагаются на оксиды.
Эта категория веществ включает частицы кислоты, кислотные остатки, основания и катионы металлов (или ионы аммония NH
Соли и их свойства
+). Расщепление соли всегда происходит в один прием.4Рассматривая синтез солей, можно с уверенностью предположить, что их разрывы нейтральны. Поскольку в реакции среды не участвуют ионы. Однако это не так. Озеро водной соли может быть красным или синим и не меняет цвет. Объяснением этого явления является взаимодействие с водой, называемое гидролизом соли. Например, рассмотрим три пробирки, содержащие растворы NaCl, ZNCL
и на2co2CO3Запишите реакцию между солью и водой (молекула H
o), через ионно-медицинское уравнение.2Сокращенное уравнение хорошо видно, потому что происходит изменение цвета. Теперь давайте разберемся, какие соли подвергаются гидролизу.
Наличие ионов H + в растворе солей Zncl присутствует
а также OH-группа в растворе карбоната натрия объясняет изменение цвета.2Рассмотрите взаимодействие солей с металлами. Вспомните последовательность металлических действий, чтобы понять принципы их взаимодействия.
Вы можете заметить этот тип взаимодействия, проводя эксперименты дома (не забудьте спросить разрешения у родителей). Вам понадобится раствор сульфата меди и соединитель или гвоздь.
Поверхность ногтя выделила чистую медь. Это фоновая реакция.
Самый сильный металл вытесняет слабый металл из раствора соли. При моделировании противоположной реакции, т.е. при помещении медного провода в раствор солей железа, взаимодействия не происходит. Медь не обладает достаточной «силой», чтобы заменить железо.
Взаимодействие между солями возможно только в том случае, если реагент растворим, а в продукте выпадает осадок.
Свойства вышеперечисленных солей, кислот и оснований можно кратко описать.
Как и в случае с другими нерастворимыми гидроксидами, нерастворимый Al(OH)
и Zn(OH)3 могут разлагаться при нагревании в воде с образованием соответствующих оксидов.2 Менее 38% в воде с HCl. Одна из самых популярных кислот для растворения. Технически она очень чистая и поэтому более холодная, чем другие кислоты, и помимо того, что она действует как кислота, она также образует сложные хлориды, которые повышают ее растворимость. Кстати, именно поэтому нерастворимый хлорид серебра хорошо растворим в концентрированной соляной кислоте.
Соляная кислота
Когда вы наносите его на кожу, он субъективно жжет немного сильнее, он также пахнет: если вы много работаете с концентрированной соляной кислотой в лаборатории с плохими абсорбентами, ваш стоматолог скажет вам спасибо: вы сделаете свои пломбы золотыми. Кстати, жевательная резинка помогает. Но не сильно. Экспорт является превосходным.
Он не липкий, не нагревается от воды и коррозирует только на металле, а не вообще. Кстати, сталь в концентрированной соляной кислоте становится пассивной и говорит «нет». Используется для транспортировки.
HNO
Азотная кислота
Она тоже очень популярна, но по какой-то причине боится — и бесполезно. Конденсат (до 70%) — самый популярный, но при концентрации сверху он становится «выхлопом», делая его бесполезным в большинстве случаев. Существует также ангидрид, который не менее взрывоопасен.3Как окислитель, он пассивирует многие металлы, которые покрываются нерастворимой пленкой и говорят «прощай» хрому, железу, алюминию, кобальту, никелю и т.д.
Основанный на принципе ксантопротеиновой реакции, он вступает в непосредственную реакцию с кожей. Появляются желтые пятна. Это означает, что имя пользователя % в конечном итоге состоит из белка. Как и при ожоге, желтая кожа исчезает через некоторое время. Он жжет меньше, чем соляная кислота, но не хуже — и на этот раз более токсичен: летучие оксиды азота не так уж хороши для вашего организма.
В химии используют так называемые «нитрификационные смеси» — самая популярная состоит из серной и азотной кислот. Он используется в составах для производства пироксилина, особенно веселого вещества. Что касается коррозии, то она такая же, как и у хромированных резцов, но с красивой желтой кожей.
Существует также «царская водка» — это одна часть азотной кислоты и три части соляной кислоты. Он используется для растворения некоторых металлов, в основном драгоценных. О добавлении различных соотношений и воды на основе капельного метода для подтверждения анализа золотых элементов — кстати, специалистам по этому методу очень трудно обмануть подделки. Это та же самая «нитратная смесь», к тому же она прекрасно пахнет, ее запах не спутаешь ни с чем другим, а еще она очень токсична.
Если соотношение обратное, то существует также «обратная царская водка», которая является редким деликатесом.
Если говорить об этой «копченой» водке, то она красная, плохая и окисленная — цитирую хорошего друга, который мне ее только что прислал.
Он был перегнан с использованием 98% азота. Я не помню, была ли это дистилляция для очистки или дистилляция из смеси. Я взял два литра и забрал приемник. Я прошу своего лаборанта налить в две прозрачные бутылки. Они дали мне сухое и чистое, оно было из спирта и с закрытой пробкой. Поэтому пар находился там и накапливался. Я ставлю воронку и бросаю его туда. Я вставляю его и снова вынимаю. Я хорошенько побрызгала на руки, лицо и под шею. Я чувствовал себя орлом на своем лице. Кроме того, мои руки, горло, под носом, ну, вы понимаете, мелочи. Я напоминаю себе, что у меня в руках два литра того же самого. С закрытыми глазами, конечно. Я понимаю, что не могу выбросить бутылку, это было бы гораздо хуже. Осторожно поставьте бутылку на резиновый коврик, подойдите к раковине, поднесите кран к лицу и надавите на конец. Это занимает около пяти секунд. Он не достиг подкожной ткани. Если бы он этого не сделал, было бы еще хуже. Я видел это с другим типом, что происходит через 10 или 15 секунд. Трудно заживить пурпурную рану в середине руки. Тогда я понял, почему он был так зол. Это не только достаточно сильная кислота и окислитель, но и отличный растворитель. Вода не имеет ограничений, но она неограниченно смешивается, например, с дилоэтаном. Это своего рода двойная грязь.
h
Фосфорная кислота
по.3PO4Концентрированная ортофосфорная кислота (85%) является таким сиропом. Сама кислота умеренная и, кстати, часто используется в пищевой промышленности — поставить пломбу и обработать поверхность зуба перед обработкой фосфорной кислотой.
Он не очень едкий, но имеет неприятные побочные эффекты. Сироп очень хорошо впитывается. Поэтому, когда он капает на вещи, он впитывается и медленно разрушается. И если от азотной и соляной кислоты есть пятно или отверстие, то от фосфатной оно отрывается, особенно если ботинок разноцветный и раздавлен до тех пор, пока отверстие не пройдет насквозь.
В общем, трудно сказать, что такое едкость.
Не путайте серу с сульфидом. Не оставляйте места для атаки: сульфиды являются родителями водорода. И в них нет кислорода! Но сера. Смотрите быстрее: здесь три оксигенатора! Добавьте атом кислорода, и вы получите сульфаты!
Неметаллы отличаются от металлов тем, что у них больше электронов на внешнем энергетическом уровне. Поэтому их окислительные свойства более интенсивны, чем у металлов. Неметаллы характеризуются высоким электронным и высоким восстановительным потенциалами.
Неметаллы: общая характеристика
Неметаллы — это химические вещества, находящиеся в газообразном, жидком или твердом кумулятивном состоянии. Например, азот, кислород, фтор, хлор и водород являются газами- йод, сера и фосфор — твердые вещества- бром — жидкость (при комнатной температуре). Всего существует 22 неметалла.
Рисунок 1. Неметаллы — это газы, твердые тела и жидкости.

По мере увеличения ядерной нагрузки возрастает регулярность изменения свойств химических элементов от металлических к неметаллическим.
Водородные свойства не нейтральных элементов — это преимущественно летучие соединения и кислотность в водном растворе. Они имеют молекулярную структуру и ковалентные полярные связи. Некоторые из них, такие как вода, аммиак и фтористый водород, образуют водородные связи. Соединения образуются при непосредственном взаимодействии водорода с неметаллами. Пример.
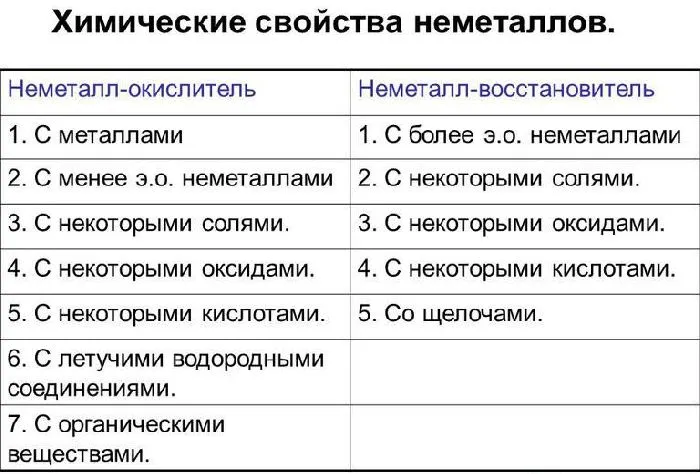
Химические свойства неметаллов
Все водородные соединения уменьшают свои свойства по мере увеличения восстановительной силы сверху вниз справа налево в пределах группы в течение определенного периода времени. Поэтому сероводород горит в большом количестве кислорода.
Окисление может протекать по-разному. Таким образом, уже на воздухе водный раствор мутнеет из-за образования серы: раствор не является хорошим раствором для серной кислоты.
Соединения неметаллов, содержащие кислород, как правило, являются кислотными оксидами, соответствующими кислородсодержащим кислотам (кислородное кислотное семейство). Типичные оксиды неметаллических элементов имеют молекулярную структуру.
Чем выше степень окисления неметалла, тем сильнее соответствующая кислота, содержащая кислород. Например, хлор не реагирует непосредственно с кислородом, но образует определенные кислородные кислоты, соответствующие оксидам этих кислот.
Наиболее известной солью этих кислот является кокосовая известь.
(смешанные гипохлорная и соляная кислоты), головокружение kclo соль2 (хлорид калия).3Ситуации окисления +1, +2, +3, +4 и +5 являются положительными для азота в оксидах. Первые два оксида n
o и no — это газы, а не солевые растворы. n2o2o3. Оксид азота IV — коричневый газ.2 — Газ, хорошо растворимый в воде с образованием двух кислот. Этот процесс может быть представлен уравнением22no.
+h2 o = hno2 (азотная кислота) + hno3 (нитрит) — реакция восстановления.2Рисунок 2. Азотная кислота.

Гидрохлорид азотной кислоты n
o2o5Нитраты называются солями соли и растворимы в воде. Соли калия, кальция и натрия используются для производства азотных удобрений.
Фосфор образует оксиды со степенями окисления +3 и +5. Наиболее стабильным оксидом является фосфатный ангидрит p
o2o5o4o10 h4по.2 (дигидрофосфат аммония).4Рисунок 3.Таблица химических свойств неметаллов.
Таблица расположения неметаллов
| Группа | I | III | IV | V | VI | VII | VIII |
| Первый период | H | He | |||||
| Второй период | B | C | N | o | F | Ne | |
| Третий период | Si | P | o | Cl | Ar | ||
| Четвертый период | As | Se | Br | Kr | |||
| Пятый период | Te | I | Xe | ||||
| Шестой период | At | Rn |
Кстати, оксиды серы, напр.
растворяется в серной кислоте, вы получите олеум — который иногда неправильно записывают как h3s2o2o7Фосфор в бутылке блестит, и все это видят — результат, вы должны знать, это ангидрит P2O5!
Алюминий, железо и хром — их жизненная сила равна трем. Натрий, калий, серебро — валентная обитель. Магний, кальций, цинк, барий — их жизненная сила составляет пару.
Умножив плотность на объем, можно легко найти массу.
Попадание газа, грязи или воды в организм — процесс навсегда необратим!
Как химики называют такой пластырь, если в жидкости есть частицы? (Подвеска).
Стихи загадки
Что такое сжигание древесины и газа, сжигание фосфора, водорода и алмаза? Чем дышит каждый из нас, каждый раз и каждый час? Что такое природа? Да, … (Кислород)
Он является основным газом в воздухе и окружает нас повсюду. Без него, без удобрений, жизнь растения умирает. В наших клетках живут ключевые элементы … (азот)
Воздух является его основным газом и окружает нас повсюду. Жизнь растений ослаблена без него и без удобрений. Важный элемент живет в наших клетках … (азот).
И, наконец, я могу сказать, что школьный учитель химии загрузил пьесу. Это также была поэма, и каждый элемент играл свою роль в соответствии со своей деятельностью. Например, золото было королем и ни на кого не реагировало. А двор селитры и соляной кислоты стал причиной интриг против царя. С момента проекта прошло почти 30 лет, но я помню все. Слава Богу за учителя!
Серия металлических мероприятий








