Медь особенно экологична и поэтому подходит для использования в жилищном строительстве. Бронзовые крыши, например, могут прослужить более 100 лет без специального ухода или покраски благодаря своим антикоррозийным свойствам.
Химические и физические свойства меди

Химические свойства меди определяются ее положением в периодической таблице Д. И. Менделеева. Название этого металла — Cu (Cuprum), который имеет 29-й порядковый номер и относится к первой группе (боковой подгруппе) в четвертом большом периоде.
Выделяют отдельный вид: черненую медь, которая является кислородом при преобразовании продукта. Его индивидуальная (молекулярная) масса составляет 63,5 г/моль, а молекулярная масса — 63,5 am.
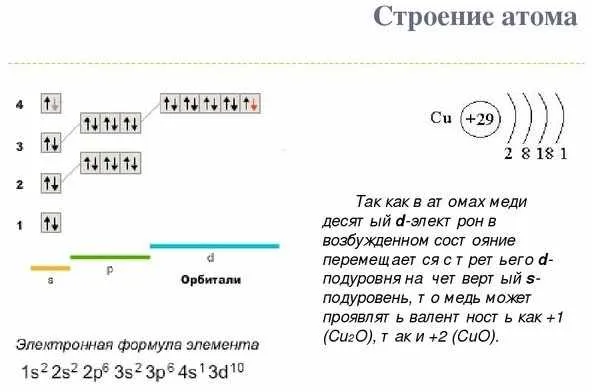
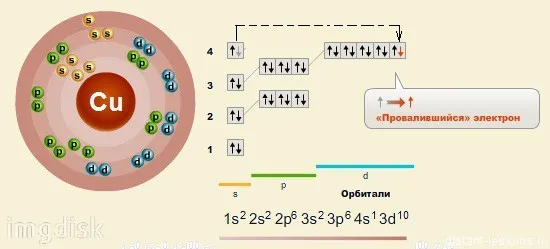
В зависимости от соединения, в котором находится металл, он может иметь жизнеспособность +1 и +2, но редко степень окисления +3 и +5. Это исключение. Структурные ТС и электронные типы людей показаны на диаграмме.
Кристаллическая медная решетка представляет собой каркас кубической формы, образованный прямыми линиями. Сетка очень сильно молекулярна, так как узлы содержат молекулы.
Физические свойства и характеристика
Медь в чистом виде представляет собой довольно податливый, холодный вязкий металл красновато-коричневого цвета.

Его жестокость достигается за счет добавления в состав различных примесей. Он обладает высокой электро- и теплопроводностью, но примеси, часто добавляемые в сплав, снижают эти показатели.
Преимуществом этого металла является его устойчивость к коррозии. Температура плавления составляет 1085 градусов Цельсия, а температура кипения — 2562 градуса Цельсия. Плотность составляет 8900 кг/м3. Специальный вес составляет 8930 кг/м3.
Чистая медь имеет диаметр. Это означает, что он не обладает магнитными свойствами. Магнитными являются только сплавы с концентрацией меди менее 50%.
С чем реагирует
Медь не реагирует с водородом, углеродом, азотом или кремнием.
Он реагирует с кислотами и солями, оксидами, лошадьми, кислородом и неметаллами, но не может реагировать со щелочами, так как в электрохимической последовательности стоит после водорода. Он также не вступает в реакцию с фтором, бромом или хлором.
Отношение к кислороду
Металл слабо реагирует с кислородом, но при длительном воздействии воздуха покрывается очень тонкой, почти неуловимой зеленоватой пленкой, которая является оксидом меди.

В зависимости от температуры, при которой происходит реакция, в чашке образуются два оксида: Cuo и Cu2O.
Взаимодействие с водой
Медь не вытесняет водород из воды, так как находится в ряду электрохимических напряжений после водорода. Однако в присутствии кислорода происходит окислительно-восстановительная реакция, поскольку водород может вытеснять молекулы металла.
Реакции с кислотами
Благодаря своему положению в электрохимической колонке они не вытесняют водород из кислоты, поэтому некоторые из них не влияют на нее. Однако, если присутствует достаточное количество кислорода, он образует соли, соответствующие кислотам, и растворяется в них.
Отношение к галогенам и неметаллам
Медь очень хорошо реагирует с галогенами. При нормальных условиях изменения не особенно заметны, но со временем на поверхности образуется очень тонкий слой галогена. А при высоких температурах реакция протекает очень быстро и бурно.

Cu реагирует с серой, и в зависимости от температуры образуются следующие сульфиды: Cu2s, Cus.
Может образовываться йод (с йодом).
Реакции с оксидами неметаллов
Медь может реагировать не со всеми неметаллическими оксидами, в зависимости от неметалла, температуры и других условий химической реакции.
Люди начали добывать медь тысячи лет назад. Самые древние предметы, найденные из этого металла, относятся к 7-6 векам до нашей эры. К ним относятся ювелирные изделия, инструменты, посуда и утварь.
Общая характеристика металла
Cu (от латинского copper, что означает «медь») относится к четвертому главному периоду и одиннадцатой группе периодической таблицы Менделеева. Его составной номер — 29, а атомный вес — 63,546. Медь имеет два стабильных природных изотопа с массовыми числами 63 и 65.

Викимедиа Выплавка меди
Медь очень пластична и является отличным проводником тепла и электричества. Температура плавления меди составляет 1084,62°C. Плотность металла составляет 8,96 г/см³. В природе этот элемент встречается как в минеральной, так и в естественной форме.
Химические свойства меди
Химически он достаточно инертен и имеет две степени окисления, которые встречаются в соединениях (+1 и +2).

Фотография месторождения.
Вещества, в которых эти значения заменены на +3, встречаются редко. Медь реагирует с кислородом, соляной кислотой и другими соединениями при высоких температурах. Нагрев также образует оксидную пленку на поверхности металла, препятствуя его дальнейшему окислению. Медь взаимодействует с такими простыми веществами, как селен, галогены и сера. Элемент может образовывать комплексные соединения или комплексные соли. Почти все соединения меди токсичны. Моновалентная медь легко окисляется до двухвалентной меди, которая может образовывать различные соединения.
Здесь вы найдете несколько интересных экспериментов по изучению свойств меди.
Медные сплавы и их свойства
Имеется множество медных сплавов. Медные сплавы, в которые добавлены определенные компоненты, обладают гораздо лучшими свойствами, чем чистая медь.
Типы медных сплавов

Латунная миска Flickr, TheLivingRoom Creative Commons лицензия CCBY2.0
Латунь образуется при соединении меди и цинка в различных пропорциях. Такие сплавы обладают высокой прочностью и устойчивостью к химическому воздействию.
Медь представляет собой сплав меди и олова (12%).
Мельхиор представляет собой сплав никеля (5-30%) и меди.
Константан представляет собой сплав никеля (45%) и меди (55%).
Сплав M2 имеет более низкое содержание меди (99,7%). Остальные 0,3% составляют никель, железо, сурьма, кислород, олово, свинец, сера и мышьяк. Это качество пластично, не ржавеет, может полностью обрабатываться под давлением и используется в производстве сплавов на основе меди и холодильных компонентов.
Оксид меди (I)
Оксид меди (I) Cu2O представляет собой коричневато-красное твердое кристаллическое вещество.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают путем восстановления только что выпавшего в осадок гидроксида меди (II), например, альдегидами или глюкозой.
Химические свойства оксида меди (I)
1.Оксид меди (I) обладает основными свойствами.
Когда оксид меди (I) реагирует с галогенированными кислотами, получаются галогенид меди (I) и вода.
Например, соляная кислота, содержащая оксид меди (I), образует хлорид меди (I).
Cu2O + 2HCl=2CuCl↓+H2O
2. растворение Cu2O в концентрированной серной и азотной кислоте образуются только соли меди (II): соли меди (II) не растворяются.
3. стабильные соединения меди (I) могут образовываться в виде нерастворимых соединений (CuCl, Cu2S) или соединения Cu (NH3).2 +. Последний получают путем растворения оксида меди (I) и хлорида меди (I) в концентрированных растворах аммиака.
Аммиачный раствор меди (I) взаимодействует с ацетиленом:.
CH≡CH+2Cu(NH3).2Cl → CuC≡CCu+2NH4Cl + 2NH3
4. В окислительно-восстановительных реакциях соединения меди(I) проявляют окислительно-восстановительную двойственность.
Например, оксид меди (II) является средством окисления при реакции с монооксидом углерода, более активными металлами или водородом.
Cu2O + CO = 2CU + CO2
Под воздействием окислительных факторов, например, кислорода, проявляет восстановительные свойства:.
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. гидроксид меди (II) можно проглотить под действием щелочного раствора меди (II).
Например, хлорид меди (II) реагирует с раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия.
КУКЛ.2 + 2NAOH → CU(OH)2 + 2NACL
Химические свойства
Гидроксид меди (II) Cu(OH).2 Это слабое выражение апостольских свойств (с основным преобладанием).
1. реагирует с кислотами.
Например, реагирует с бромной кислотой с образованием меди(II) бромида воды и воды.
2.Гидроксид меди (II) легко реагирует с растворами аммиака, образуя синий двухйоктовый комплекс.
3.Когда гидроксид меди (II) взаимодействует с высокой плотностью (>40%), щелочной раствор образует соединение.
Но эта реакция еще не используется в химии!
4.При нагревании гидроксид меди (II) разлагается.
Соли меди
Соли меди (I)
В окислительно-восстановительной реакции соединения меди (i) имеют бинары кожи. Как восстановители, они вступают в реакцию с окислителями.
Например, хлорид меди (I) окисляется плотной азотной кислотой.
Хлорид меди (I) также реагирует с хлором.
2cucl + cl2 = 2CUCL2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты.
4cucl + o2 + 4hcl = 4cucl2 + 2H2O
Другие галогениды меди (I) также легко окисляются другими сильными окислительными средствами.
Йодид меди (I) реагирует с густой серной кислотой.
Сульфид меди (I) реагирует с азотной кислотой. При охлаждении и нагревании образуются различные продукты окисления серы.
Для соединений меди (i) возможны реакции дисбаланса:.
2cucl = cu + cucl2
Cu (комплексные соединения, такие как NH3).2 Готовится путем растворения в + густом растворе аммиака:.
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) обладают окислительными свойствами.
Например, окисление солей меди (II) йодом и серой:.
2cucl2 + 4KI = 2CUI + i2 + 4KCL
Бут и йод меди (II) могут быть окислены перманганатом калия.
Соли меди (II) также окисляют серу:.
Наиболее активные металлы замещают медь из солей.
Например, сульфат меди (II) реагирует с железом.
кузо.4 + fe = feso4 + cu
Сульфид меди (II) может быть окислен азотной кислотой высокой плотности. При нагревании может образоваться сульфат меди (II).
Другая форма этой реакции:.
При горении сульфида меди (II) образуются оксид меди (II) и диоксид серы, а также:.
2кус + 3о2 2CUO + 2SO2↑
Соли меди (II), как и все соли, участвуют в реакциях обмена.
Например, соли меди (II) реагируют с сульфидами.
Кубр.2 + na2s = cus↓ + 2nabr
Когда соли меди (II) реагируют со щелочами, образуется синий осадок гидроксида (II).
Электролиз разложения азота нитратом меди:.
Некоторые соли меди разлагаются при нагревании. Нитрат меди (II).
Основной карбонат меди разлагается на оксид меди (II), углекислый газ и воду.
Когда соли меди (II) взаимодействуют с избытком аммиака, образуется аммиачный комплекс.
При смешивании соли меди (II) и раствора карбоната происходит гидролиз как основания, так и аниона пациента.
Он реагирует с кислотами и солями, оксидами, лошадьми, кислородом и неметаллами, но не может реагировать со щелочами, так как в электрохимической последовательности стоит после водорода. Он также не вступает в реакцию с фтором, бромом или хлором.
Что реагирует с медью
Медь входит в группу IB D.I. Менделеев. В четвертом периоде медь занимает предпоследнее d-поле и ее валентный электрон имеет конфигурацию 3 d 9 4 s 2, но из-за стабильности d 10 — это кажется более благоприятной энергией для перехода на 4 уровень d-электронов, поэтому электрон меди имеет следующую конфигурацию: 3D10 4 s 1. В соединениях, электроны меди окисление характеризуется +2, в то время как возможны степени окисления +1 и +3.
Физические свойства меди
Медь — податливый розово-красный металл с металлическим блеском. Он обладает высокой тепло- и электропроводностью, а по показателю электропроводности уступает только серебру. Его температура плавления 1083°C, температура кипения 2567°C и плотность 8,92 г/см3.

На воздухе медь покрывается темно-зелено-серого цвета пленкой основного карбоната, которая защищает ее от дальнейшего окисления.
Химические свойства меди
В кислороде, в зависимости от температуры взаимодействия, медь образует два оксида: 2Cu + O2 = 2cuo (черный).
При температуре около 150°C металл покрывается темно-красным оксидом оксида меди (I): 4cu + O2 = 2cu2o
При нагревании с фтором, хлором, бромом или галогеном меди (II): Cu + Br2 = Кубр2;
При нагревании с йодом образуется йодистая медь (I): 2CU + I2 = 2CUI.
Взаимодействие с кислотами.
В электрохимическом ряду Metal Voltage медь находится после водорода и поэтому не взаимодействует с разреженными растворами соляной и серной кислоты и щелочей.
Он растворяется в слабой азотной кислоте с образованием нитрата меди(II) и оксида азота(II).
Реагирует с плотными растворами сульфата и азотной кислоты с образованием солей меди (II) и продуктов кислотного восстановления.
В сопровождении высокоплотной, высокотемпературной соляной кислоты:.
Получение
Медь добывается из руд и медных минералов. Основными методами получения меди являются пирамотализм, перекатализ и электролиз.
Питесталлургические методы заключаются в получении меди из сернистых руд, таких как медные манжеты2. Исходный халькопирит содержит 0,5-2,0% Cu. После обогащения исходной руды концентрат подвергается окислительному обжигу при температуре 1400°.
Затем из конденсата готовят лет и переплавляют его в штейн. Для связывания оксида железа в расплав добавляется диоксид кремния.
Образовавшийся силикат в виде шлака всплывает и отделяется. Матирование, оставленное на дне — сплавы FES и CU.2S — режим без полуэлектрического плавления. Для этого расплавленный штейн заливается в конвертер и пропускает кислород. В этом процессе оставшийся сульфид железа окисляется, поэтому он окисляется и удаляется в виде силиката в кремнии. Сульфид меди частично окисляется оксидами и восстанавливается до металлической меди.
Полученная медь содержит 90,95% металла, и электролит подвергается дальнейшей очистке с использованием сульфата меди в качестве электролита. Электролитическая медь, производимая на спуске, имеет высокую чистоту до 99,99% и используется в производстве кабелей, электрооборудования и сплавов.
Медь — податливый розово-красный металл с металлическим блеском. Он обладает высокой тепло- и электропроводностью, а по показателю электропроводности уступает только серебру. Его температура плавления 1083°C, температура кипения 2567°C и плотность 8,92 г/см3.
Область применения
Медная фольга широко используется в строительстве, автомобилестроении, судостроении и железнодорожной промышленности.
Медная фольга используется при строительстве крыш, фасадов, заборов и перил. Изделия из меди также используются в больницах, например, в дверях, ручках, перилах, балюстрадах и даже посуде, поскольку поверхность металла обладает бактерицидными свойствами.
Медные трубы используются для транспортировки жидких и газообразных сред в системах водо- и газоснабжения, отопления и кондиционирования воздуха, а также в теплообменниках и системах охлаждения. Помимо бытовых коммуникаций, эти трубы также используются в судостроении и энергетической промышленности.
Медная проволока используется для изготовления кабельно-проводниковой продукции с низким сопротивлением и особыми магнитными свойствами.
Медные ленты используются в оборудовании, электрической и электронной технике и при производстве проводников, обмоток и силовых трансформаторов.
Медные прутки также широко используются в строительстве и промышленности. Медь может использоваться в строительстве и производстве внутренних подшипников, оконных подъемников, водонепроницаемых клапанов и декоративных конструкций.
Медь — важный элемент, в организме взрослого человека содержится около 100 граммов этого металла. Токсичность этого вещества была переоценена Всемирной организацией здравоохранения в 2003 году. Известно, что медь не вызывает желудочно-кишечных расстройств, а также не вызывает болезнь Вильсона-Коновалова (печеночную энцефалопатию, поражающую печень и мозг), как считалось ранее. Ученые пришли к выводу, что, несмотря на избыток меди, дефицит меди более вреден для здоровья человека.
Бактерицидные свойства меди известны давно, а недавние исследования меди подтвердили эффективность этого металла в профилактике свиного гриппа и золотистого стафилококка. Эксперименты показали, что 99% болезнетворных микроорганизмов погибают на медных поверхностях в течение двух часов. Поэтому медь и ее сплавы широко используются для обеззараживания воды. В Европе из этого металла изготавливают ручки, замки, петли и перила, которые находятся в больницах и общественных местах.
Пожалуйста, предоставьте следующую информацию. Менеджер свяжется с вами как можно скорее и проконсультирует вас, если у вас возникнут вопросы.








