Большинство веществ с индивидуальными кристаллическими решетками имеют очень высокие температуры плавления (например, алмазы превышают 3500°C) — они прочные, жесткие и практически нерастворимые.
ХИМИЧЕСКАЯ СВЯЗЬ
Базовой основой химической связи стала теория химического строения А. М. Бутлерова (1861). Согласно этому, свойства соединений зависят от природы и количества частиц, входящих в их состав. Эта теория была подтверждена как для органических, так и для неорганических веществ. Поэтому ее следует рассматривать как фундаментальную теорию химии.
Большинство простых веществ и все соединения (химические соединения) состоят из индивидуумов, которые взаимодействуют определенным образом. Другими словами, между людьми создаются химические связи.
— Электронное явление, состоящее в том, что по крайней мере один электрон в динамическом поле собственного ядра одновременно находится в динамическом поле другого ядра или нескольких ядер. При создании химической связи выделяется энергия. Это означает, что энергия результирующей частицы должна быть меньше, чем полная энергия исходной частицы.
Химические связи относятся к различным типам взаимодействий, которые обуславливают постоянное наличие молекул, ионов, кристаллов и других соединений двух и многих материй.
Основные характеристики химических связей следующие
- снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система образована;
- перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи.
В природе химические связи — это взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронами между ними.
Переход электронов от одного человека к другому приводит к образованию противоположно заряженных ионов в фиксированной электронной конфигурации, где создается стационарная индукция. Это простейшая модель ионной связи.
Параметры химической связи
Химические связи создаются s- и p-электронами во внешнем слое и d-электронами во внешнем слое. Это соединение характеризуется следующими параметрами.
- Длиной связи — межъядерным расстоянием между двумя химически связанными атомами.
- Валентным углом — углом между воображаемыми линиями, проходящими через центры химически связанных атомов.
- Энергией связи — количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии.
- Кратностью связи — числом электронных пар, посредством которых осуществляется химическая связь между атомами.
Сближение двух протонов создает отталкивающую силу, что не может говорить о неподвижной системе. Только один электрон должен быть помещен на свое место. Здесь возможны два случая.
В первом случае электрон находится между протонами (левая сторона), а во втором — за одним из них (правая сторона).
В обоих случаях возникает сила притяжения. В первом случае компоненты этих сил на оси, проходящей через протонный центр (проекция), направлены в противоположную сторону от сил отталкивания (левая сторона), что позволяет их нейтрализовать. В этом случае возникает система стабилизации энергии. В последнем случае компоненты силы тяги направлены в разные стороны (справа), что не позволяет говорить о равновесии сил между протонами. Это означает, что для образования химических связей в молекулах или ионах электроны должны находиться преимущественно в междоузельной области. Эта область называется областью приверженности, потому что когда электроны находятся там, образуются химические связи. Область за ядром называется областью релаксации, потому что когда электроны находятся там, химические связи отсутствуют.
Применив те же рассуждения к молекулярному водороду, можно сделать вывод, что появление второго электрона в области связи еще больше стабилизирует систему. Поэтому для образования фиксированной химической связи требуется по крайней мере один электрон. В этом случае спины электронов должны быть несовместимы. То есть, они ориентированы в разных направлениях. Образование химической связи должно сопровождаться уменьшением общей энергии системы.
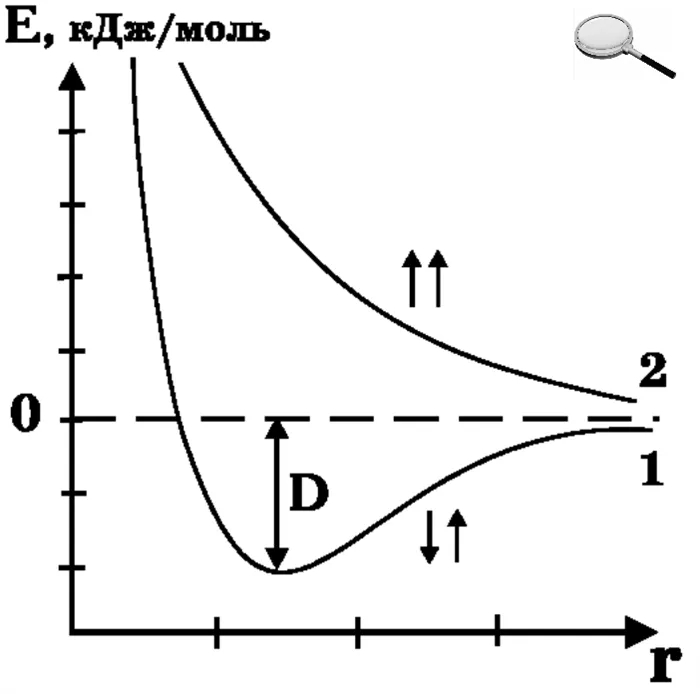
Рассмотрим изменение динамической энергии системы на примере двух атомов водорода, приближающихся друг к другу. Если особи находятся на очень большом расстоянии друг от друга, они не взаимодействуют, и энергия такой системы близка к нулю. Когда они сближаются друг с другом, между электронами одного человека и ядром другого возникают силы притяжения, и наоборот. Эти силы увеличиваются обратно пропорционально квадрату расстояния между людьми. Энергия системы уменьшается. По мере приближения друг к другу между ядром и его электронами возникают силы отталкивания. Увеличение отталкивающих сил обратно пропорционально шестой силе расстояния. Динамическая кривая энергии проходит через минимум, а затем внезапно возрастает.
Расстояние, соответствующее минимальному расположению на кривой, является расстоянием междисциплинарного равновесия и определяет длину химической связи. Поскольку молекулярные люди вовлечены в колебательное движение по отношению к положению равновесия, расстояние между ними постоянно меняется. Это означает, что люди не привязаны друг к другу. Расстояние баланса соответствует определенному среднему значению при определенной температуре. При повышении температуры диапазон колебаний увеличивается. При достаточно высоких температурах особи могут распространяться на бесконечное расстояние друг от друга, что соответствует разрыву химических связей. Минимальная глубина оси энергии определяет энергию химической связи, а значение этой энергии, полученное с противоположным знаком, равно энергии двух конкретных частиц. Когда атомы водорода с одновременно вращающимися электронами приближаются друг к другу, между ними возникает только сила отталкивания и потенциальная энергия такой системы.
Виды химической связи

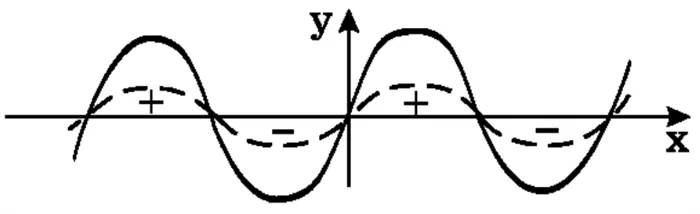
В образовании химических связей участвуют s-, p- и d-электроны. В нем представлены различные геометрические конфигурации электронного облака и различные знаки волновых форм в пространстве. Покрытие частей электронной оболочки одной и той же волновой сигнатурой необходимо для возникновения химических связей. В противном случае образуются химические связи. Это утверждение можно легко проиллюстрировать на примере двух дополнительных знаков, которые могут быть выявлены в волнорезах при первом подходе.
В случае двух знаков с разными подписями в одной области (слева), их суммарная составляющая равна нулю — связи нет. В противном случае добавляются вибрации и формируется новый знак — образуется химическая связь (справа).
В зависимости от симметрии электронного облака, обусловленной покрытием, в котором образуется химическая связь, общее электронное облако имеет различную симметрию.
Во внутреннем пространстве достигается максимальная плотность электронов с цилиндрической симметрией относительно линии, соединяющей центры индивидов, идущих в перекрывающихся облаках вдоль линии, соединяющей центры индивидов. Благодаря глобальной симметрии S -связи, S -электроны всегда вовлечены в процесс. В результате покрытия электронами других электронов образуется связь s: s-, pх -, dx 2 -y 2 -электрон. На других орбиталях есть электроны. pa или пвату. и химическая связь невозможна. Это объясняется тем, что покрытие находится в области, где имеются противоположные знаки электронной плотности. Способность к образованию s -s -электронов не ограничена; они могут образовываться при покрытии других электронных облаков, таких как два pх или пх и гx 2 -y 2 х.

Они возникают в результате перекрытия электронного облака выше и ниже линии, соединяющей центры индивидов. Полное электронное облако также симметрично расположено на этой оси, но не обладает цилиндрической симметрией, как в случае сцепления. Благодаря своему пространственному положению, P-связи формируются парами электронов на орбитах типа Py — керамикаy, рz — керамикаz, рy-dxy.
Они образуют только d-электроны для четырех листков покрытия и электронного облака, которые расположены на параллельных уровнях. Это возможно для dxy.-dxy. г, гxz-dxz г, гYZ-dYZ -электроны.
Существует и другой подход к классификации химических связей, основанный на характере распределения электронной плотности между отдельными молекулами. Другими словами, химические связи рассматриваются на основе пар электронов с каждой стороны. Возможны три случая.
Все десять связей (C-FE) молекулы парома эквивалентны, а значение внутриядерного расстояния FE-C составляет 2,04 Å. Все атомы углерода молекулы ферри являются структурными и химическими эквивалентами. Длина каждой связи С-С составляет 1,40-1,41 Å (для сравнения, длина связи С-С в бензоле составляет 1,39 Å). Вокруг атома железа возникает 36-электронная оболочка. 8
Способы образования ковалентной связи. Характеристики ковалентной связи: длина и энергия связи
Ковалентные химические связи — это связи, созданные между индивидуумами посредством образования общих электронов.
Механизм формирования этой связи может быть обменным и донором к реципиенту.
I. Механизм обмена работает, когда индивиды образуют общую электронную пару путем объединения несвязанных электронов.
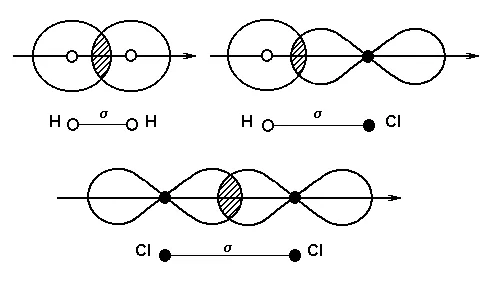
Связывание происходит за счет образования общей пары электронов $ s $ из электронов $ s $ (перекрывающихся орбиталей $ s) атома водорода.
Связывание происходит за счет образования общей пары электронов $ s $-$-$-$-$-$-электрон (перекрытие $ s-p $ -трой).
(3) $ cl_2 $: в молекулах хлора ковалентные связи образуются за счет непарного электрона $ p $ (дублированные орбитали $ p-p $).
(4) $ n_2 $: в молекулах азота три общие электронные пары между индивидами: i.
ii. на примере иона аммония $ nh_4^+$ рассмотрите механизм приема доноров при образовании ковалентных связей.
У донора есть электронная пара, а у приемника — свободная орбиталь, которая может понять эту пару. В ионе аммония все четыре связи являются ковалентными, включая атом водорода; три связи образованы путем создания общей пары электронов азота и атома водорода.
Бесчисленные связи можно классифицировать в зависимости от того, как перекрываются электроны, путем смещения одного из электронов к одному из связанных индивидов.
Химические связи, образованные перекрыванием электронных орбиталей вдоль линий связи, называются связями $σ$ (сигма-связями). Сигма-связи очень сильны.
$ p- $ Орбиды могут перекрываться в двух областях, образуя ковалентную связь за счет бокового перекрытия.
Химические связи, образованные электронными орбиталями, которые перекрываются «сбоку» за пределами линии связи, т.е. в двух областях, называются $ pi $ связями (пи-связями).
Ковалентные связи могут быть полярными или неполярными, в зависимости от степени смещения общей электронной пары в одном из связанных атомов.
Ковалентные химические связи, образованные между атомами с одинаковой электроотрицательностью, называются неполярными. Электронные пары не смещаются ни в одном атоме, потому что атомы имеют одинаковый ЭО (способность притягивать валентные электроны от других атомов). Например:.
Другими словами, молекулы простых неметаллических веществ образованы ковалентными неполярными связями. Ковалентные химические связи между атомами элементов с разной электроотрицательностью называются полярными связями.
Длина и энергия ковалентных связей.
Характерные свойства ковалентной связи — ее длина и энергия. Длина связи — это расстояние между ядрами атомов. Химическая связь тем прочнее, чем меньше ее длина. Однако мерой прочности связи является энергия связи, которая определяется количеством энергии, необходимой для разрыва связи. Обычно она измеряется в кДж/моль. Так, согласно опытным данным, длины связи молекул $H_2, Cl_2$ и $N_2$ соответственно составляют
Ионы. Ионная связь
Представьте, что два атома металла из группы I и два атома неметалла из группы VII «встретились». Атом металла имеет только один электрон на внешнем энергетическом уровне, в то время как атому неметалла не хватает только одного электрона для завершения его внешнего уровня.
Первый атом легко отдает второму атому электрон, слабо связанный с ядром, вдали от ядра, давая второму атому свободное пространство на внешнем электронном уровне.
Один отрицательно незаряженный атом становится положительно заряженной частицей, а второй атом становится отрицательно заряженной частицей благодаря полученным электронам. Эти частицы называются ионами.
Химические связи, возникающие между ионами, называются ионными связями.
Образование этих связей можно рассмотреть на примере хорошо известного соединения хлорида натрия (поваренной соли).
Процесс превращения атомов в ионы показан на схеме.

Такое превращение атомов в ионы всегда происходит при взаимодействии между типичным атомом металла и типичным атомом неметалла.
Рассмотрим алгоритм вывода (последовательность) при записи образования ионных связей. Между атомом кальция и атомом хлора:.
- Кальций — это элемент главной подгруппы II группы, металл. Его атому легче отдать два внешних электрона, чем принять недостающие шесть:$↙-2e↖→Ca^↙$.
- Хлор — это элемент главной подгруппы VII группы, неметалл. Его атому легче принять один электрон, которого ему не хватает до завершения внешнего уровня, чем отдать семь электронов с внешнего уровня:$↙+1e↖→Cl^↙$.
- Сначала найдем наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 3500 (2 · 1)$. Затем определим, сколько атомов кальция нужно взять, чтобы они отдали два электрона, т.е. надо взять один атом $Са$, и сколько атомов хлора надо взять, чтобы они могли принять два электрона, т.е. нужно взять два атома $Cl$.
- Схематично образование ионной связи между атомами кальция и хлора можно записать так:
Число атомов или молекул называется коэффициентом, а число атомов или ионов в молекуле — указателем.
.074, 0.198$ и
Металлическая связь
Давайте рассмотрим, как атомы металлических элементов взаимодействуют друг с другом. Металлы обычно существуют в виде кусков, кирпичей или металлических изделий, а не в виде отдельных людей. Что удерживает атомы металлов вместе?
Большинство атомов металлов содержат на своей внешней поверхности небольшое количество электронов — 400, 2, 3$. Эти электроны могут быть легко отсоединены, и атом превращается в катион. Отсоединенные электроны перемещаются от одного иона к другому, соединяя их между собой. Эти электроны соединяются с ионом, образуя временный атом, затем снова отделяются и соединяются с другим ионом. В результате в объеме металла атомы всегда превращаются в ионы и наоборот.
Соединение металлов между ионами посредством электронных связей известно как металлическая связь.
Эта диаграмма описывает структуру металлического фрагмента натрия.
Небольшое число общих электронов связывается с большим числом ионов и атомов.
Металлические связи в некоторой степени похожи на ковалентные связи, поскольку они основаны на совместном использовании внешних электронов. Однако в ковалентной связи соединяются только внешние неспаренные электроны двух соседних атомов, тогда как в металлической связи все атомы участвуют в соединении этих электронов. Именно поэтому кристаллы с ковалентной связью хрупкие, в то время как кристаллы с металлической связью обычно рассыпаются, обладают электропроводностью и металлическим блеском.
Металлическая связь — это свойство чистых металлов, а также смесей различных металлов и сплавов в твердом и жидком состоянии.
При .109 $ нм операции связи составляют $ 436, $ 242 $ и $ 946 кДж/моль соответственно.
Водородная связь
Химическая связь между положительно поляризованным атомом водорода одной молекулы (или ее части) и отрицательно поляризованным атомом сильно электрофильного элемента с неразличимыми электронными парами ($ F, O, N $, редко $ S$ и $ Cl$) другой молекулы называется водородной связью.
Механизм образования водородных связей частично электростатический, а частично донорно-приемный.
Примеры водородных межмолекулярных связей:.

Благодаря этой связи даже вещества с низким молекулярным весом могут превращаться в жидкости (спирты, вода) или легко сжижаемые газы (аммиак, фтористый водород) при нормальных условиях.
Вещества с водородными связями имеют молекулярную кристаллическую решетку.
Вещества молекулярного и немолекулярного строения. Тип кристаллической решетки. Зависимость свойств веществ от их состава и строения
Вещества химически взаимодействуют друг с другом, а не с отдельными атомами или молекулами. Вещество при определенных условиях может находиться в одном из трех когезионных состояний: твердом, жидком или газообразном. Свойства вещества также зависят от природы химических связей между частицами (молекулами, атомами или ионами), из которых оно состоит. В зависимости от типа связи различают молекулярные и немолекулярные вещества.
Вещества, состоящие из молекул, называются молекулярными веществами. Связи между молекулами таких веществ очень слабые, гораздо слабее, чем связи между атомами в молекуле, и разрываются уже при относительно низких температурах — вещество превращается в жидкость, а затем в газ (возгонка йода). Температуры плавления и кипения веществ, состоящих из молекул, повышаются с увеличением молекулярного веса.
Молекулярные вещества включают вещества с атомной структурой ($ C, Si, Li, Na, K, Cu, Fe, W $) и включают металлы и неметаллы.
Давайте рассмотрим физические свойства щелочных металлов. Прочность связи между атомами относительно слабая, что приводит к низкой механической прочности. Щелочные металлы мягкие и легко режутся ножом.
Из-за большего размера атомов щелочные металлы имеют меньшую плотность. Литий, натрий и калий еще легче воды. Температуры кипения и плавления щелочных металлов также уменьшаются по мере увеличения числа элементов, поскольку атомы становятся крупнее, а связи слабее.
К немолекулярным веществам относятся ионные соединения. Большинство соединений металлов и неметаллов имеют такую структуру: все соли ($ NaCl, K_2SO_4 $), некоторые гидриды ($ LiH $) и оксиды ($ CaO, MgO, FeO $), основания ($ NaOH, KOH $). Ионные (немолекулярные) вещества имеют более высокие температуры плавления и кипения.
Благодаря этой связи даже вещества с низким молекулярным весом могут превращаться в жидкости (спирты, вода) или легко сжижаемые газы (аммиак, фтористый водород) при нормальных условиях.
Содержание
Термин «химическая структура» был впервые введен А. М. Бутлеровым в 1861 году. Она также заложила основы классической теории химической структуры. Основные положения этой теории заключаются в следующем.
- Атомы в молекулах соединены друг с другом в определённой последовательности. Изменение этой последовательности приводит к образованию нового вещества с новыми свойствами.
- Соединение атомов происходит в соответствии с их валентностью.
- Свойства веществ зависят не только от их состава, но и от «химического строения», то есть от порядка соединения атомов в молекулах и характера их взаимного влияния. Наиболее сильно влияют друг на друга атомы, непосредственно связанные между собой.
Типы связи
Простейшая одноэлектронная ковалентная химическая связь

Простейшие химические связи электронов создаются одним валентным электроном. Видно, что один электрон может удерживать вместе два положительно заряженных иона. В связи электронов кулоновская сила отталкивания положительно заряженных частиц уравновешивается кулоновским притяжением этих частиц к отрицательно заряженным электронам. Валентные электроны будут общими для двух ядер молекулы.
Примерами таких соединений являются молекулярные ионы: H2 +, Li2 +, Na2 +, K2 +, Rb2 +, Cs2 + 1:.
Молекулярный ион xz +, Å
Присутствие молекулярных ионов водорода и щелочных металлов, где химические связи возникают благодаря одному валентному электрону, расширяет и дополняет концепцию химических связей. Перечисленные ионы не учитывают взаимодействие спиновых электронов и перекрывающихся электронных облаков. Односвязные электроны находятся в пространстве между ядрами и удерживают их вместе, образуя стабильные химические системы (рис. 1).
Одинарная ковалентная связь



Простые ковалентные химические связи создаются парами электронов. Во всех существующих теориях (теория валентных связей, теория молекулярных орбиталей, теория отталкивания валентных электронных пар, модель химической связи Бора), связывающие электронные пары находятся в пространстве между атомами молекулы. Различают полярные и неполярные ковалентные связи.
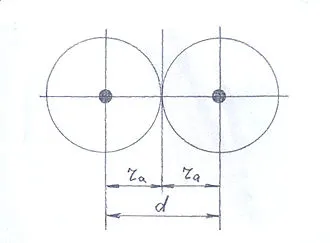
Неполярные ковалентные связи возникают в двухатомных изоядерных молекулах. В этом случае электронные пары связи равноудалены от двух ядер молекулярной системы (рис. 2). Расстояние d между ядрами можно представить как сумму радиусов ковалентных связей соответствующих атомов.
Расстояние между ядрами в простой ковалентной связи двух электронов меньше, чем соответствующее расстояние в простейшей химической связи электронов.
| Молекула | H2 | Li2 | Na2 | K2 | Rb2 | Cs2 |
|---|---|---|---|---|---|---|
| Межъядерное расстояние, Å 2 | 0,74 | 2,67 | 3,08 | 3,92 | 4,10 | 4,30 |
| Ковалентный радиус, Å | 0,37 | 1,335 | 1,54 | 1,96 | 2,05 | 2,15 |
| Орбитальный радиус, Å | 0,53 | 1,57 | 1,715 | 2,09 | 2,22 | 2,35 |
| Радиус связывающей электронной пары, Å | 0,379 | 0,826 | 0,755 | 0,726 | 0,852 | 0,949 |
| Энергия разрыва связи, кДж/моль 2 | 436 | 102 | 73 | 57 | 49 | 42 |
Динамика химической связи
Химические связи очень динамичны. Например, металлическая связь становится ковалентной во время фазового перехода, когда металл испаряется. Чтобы перевести металл из твердого состояния в парообразное, необходимо затратить большое количество энергии. 9
| Металл | Li | Na | K | Rb | Cs |
|---|---|---|---|---|---|
| Теплота возгонки (ккал/г-атом) | 36 | 26 | 22 | 21 | 19 |
В парообразном состоянии эти металлы фактически состоят из изоядерных молекул, состоящих из двух атомов и свободного атома. По мере конденсации паров металла ковалентные связи преобразуются в металлические.
Испарение солей с типичными ионными связями, например, фторидов щелочных металлов, приводит к разрушению ионных связей и образованию гетероядерных бимолекул с полярными ковалентными связями. Происходит образование двусторонних молекул со сшитыми связями.
Свойства химической связи фторированных молекул щелочных металлов и их димеров. 2 10
| EF | dEF, Å | μ, D | Э2F2 | dEF, Å | |
|---|---|---|---|---|---|
| LiF | 1,56 | 6,60 | Li2F2 | 1,75 | 105° |
| NaF | 1,93 | — | Na2F2 | 2,08 | 95° |
| KF | 2,17 | 7,37 | K2F2 | 2,35 | 88° |
| RbF | 2,27 | — | Rb2F2 | 2,45 | 84° |
| CsF | 2,35 | 7,88 | Cs2F2 | 2,56 | 79° |
При конденсации паров фторидов щелочных металлов полярные ковалентные связи преобразуются в ионные, и образуется соответствующая кристаллическая решетка соли.
Механизм перехода ковалентной в металлическую связь


Рисунок 11.Связь между радиусами орбит пар электронов re и длина ковалентной химической связи d


Рис. 12.Ориентация диполей двухатомных молекул и образование искаженных октаэдрических фрагментов кластеров при конденсации паров щелочных металлов.


Рис. 13.Объемное кубическое расположение ядер в кристаллах щелочных металлов и связей.
Притяжение рассеяния (сила Лондона) вызывает диатомовые взаимодействия и образование диатомовых изоядерных молекул атомами щелочи.
При образовании ковалентных связей металл-металл происходит деформация электронных оболочек взаимодействующих атомов — валентные электроны образуют связующие электронные пары. Плотность электронов сосредоточена в пространстве между образующимися ядрами. Гомоядерные диатомовые молекулы щелочных металлов характеризуются большой длиной ковалентной связи (в 3,6-5,8 раз больше длины связи молекулярного водорода) и низкой энергией разрыва связи.








