Соли, входящие в состав основных щелочных сред, содержатся в фотовеществах. Это карбонат натрия, карбонат калия, бура и другие анионно гидролизованные соли.
Гидролиз солей — какие соли подвергаются и почему, как решать уравнения
Гидролиз солей является одним из важнейших элементов биохимических реакций жизни. В принципе, этому подвергаются все соли, но условия процесса радикально отличаются.
Что же представляет собой этот элемент биохимической реакции и какие соли могут быть в нем задействованы? Мы рассмотрим основные особенности этого процесса и его основные виды в солевых растворах.
Рассмотрим на примере: каковы необратимые типы таких реакций и каковы условия гидролиза двух или более солей в растворе? Давайте рассмотрим фундаментальное значение этого уникального химического явления для жизни и деятельности организмов на Земле.
Что такое гидролиз солей
Все соли в химии известны как электролиты. Это означает, что их растворы обладают достаточной электропроводностью. Для них характерно явление распада — поэтому в растворе больше частиц: положительных катионов и отрицательных анионов.

Процесс в данном случае — это взаимодействие (особенно обмен!) между этими частицами и водой. ) заключается в разложении соли.
Поэтому процесс состоит из двух этапов: разложение соли и обмен ее частей с ионами воды.
Какие соли подвергаются данной реакции
Возможность проведения этой процедуры зависит от двух факторов

Внешние факторы, которые играют важную роль, так как гниение является основной стадией, и условия, при которых оно происходит.
- увеличение температуры;
- изменение кислотности;
- добавление растворов сильных электролитов;
- увеличение концентрации искомой соли;
- снижение давления.
Что подразумевается под природой ионов электролита? Их ионная сила.
К сильным катионам относятся щелочные металлы, а к слабым — элементы из второй и третьей основных групп (металлов) таблицы Менделеева.
Сильные анионы могут содержать остатки серной кислоты, азотной кислоты и галогенидов. Слабые анионы включают все органические соли и производные серной и азотной кислот.
Самое важное, что нужно знать, это то, что гидролиз происходит в слабом компоненте!
Соли, содержащие катионы и анионы сильных электролитов, не подвергаются этому процессу. Кроме того, труднорастворимые соединения не подвергаются этому процессу, так как первые стадии процесса очень трудны для этих веществ.
Например, такие соединения, как сульфат натрия, хлорид бария и карбонат кальция, не поддаются гидролизу.
Реакции такого типа, как изученные в солевых растворах, происходят во всех областях многоклеточных организмов. Они также находят применение в технике, промышленности, медицине, фармакологии и косметологии.
Что такое гидролиз солей
Все соли в химии известны как электролиты. Это означает, что их растворы обладают достаточной электропроводностью. Для них характерно явление распада — поэтому в растворе больше частиц: положительных катионов и отрицательных анионов.

Процесс в данном случае — это взаимодействие (особенно обмен!) между этими частицами и водой. ) заключается в разложении соли.
Поэтому процесс состоит из двух этапов: разложение соли и обмен ее частей с ионами воды.
Какие соли подвергаются данной реакции
Возможность проведения этой процедуры зависит от двух факторов

Внешние факторы, которые играют важную роль, так как гниение является основной стадией, и условия, при которых оно происходит.
- увеличение температуры,
- изменение кислотности,
- добавление растворов сильных электролитов,
- увеличение концентрации искомой соли,
- снижение давления.
Что подразумевается под природой ионов электролита? Их ионная сила.
К сильным катионам относятся щелочные металлы, а к слабым — элементы из второй и третьей основных групп (металлов) таблицы Менделеева.
Сильные анионы могут содержать остатки серной кислоты, азотной кислоты и галогенидов. Слабые анионы включают все органические соли и производные серной и азотной кислот.
Важно знать: гидролиз — это слабый компонент!
Соли, содержащие катионы и анионы сильных электролитов, не подвергаются этому процессу. Кроме того, труднорастворимые соединения не подвергаются этому процессу, так как первые стадии процесса очень трудны для этих веществ.
Например, такие соединения, как сульфат натрия, хлорид бария и карбонат кальция, не поддаются гидролизу.
Степень гидролиза
Количественной характеристикой процесса водообмена для любого вещества является степень его

Этот термин означает соотношение между количеством соли, подвергшейся этому процессу, и общим количеством образовавшихся частиц в растворе.
Это зависит от характера союза. Если соль образована ионами слабой кислоты или основания, степень процесса выше.
Было обнаружено, что в соли могут присутствовать слабые ионы, которые вызывают гидролиз. основание, кислотный остаток или оба компонента, и от этого зависит тип гидролиза.
Условия гидролиза
Не все соединения разлагаются в результате реакции с молекулами воды. Теперь мы рассмотрим пример солей, чтобы понять, какие вещества обладают гидролизом, какие нет и от чего он зависит.
Во-первых, каждая соль содержит часть гидроксида и часть кислоты. Катион металла отвечает за гидроксильную часть, а кислотная часть — за кислотный остаток.
Сульфат меди кузо4 состоит из основания Cu(OH)2 и кислота h2SO.4;
Хлорид натрия NaCl состоит из основания NaOH и кислоты Hcl
Карбонат натрия Na2co.3 основание NaOH и состоит из кислоты H2co.3.
В жизни слабый разлагается первым, и химический гидролиз работает по тому же принципу. В ходе этой реакции более слабые соединения (остатки оснований или кислот) разлагаются. Слабые катионы или слабые анионы реагируют с ионами воды и связываются с одним или обоими из них. В растворе имеется группа избыточных ионов H+ или OH-гидроксильный гидроксил.
В зависимости от того, гидролизуется ли соль слабым основанием или слабой кислотой, эффект может быть кислым, щелочным или нейтральным водным раствором.

А что произойдет, если соль состоит из сильного основания и остатка сильной кислоты? В этом случае его сильные катионы и анионы не взаимодействуют с ионами воды. Такие соли не разлагаются. Другими словами, они не подвержены гидролизу.
Геометрия химической реакции гидролиза выглядит следующим образом
xy + hoh = xoh + hy
Индикаторы среды раствора
Специальные индексы используются для определения среднего значения раствора в течение нескольких секунд. Наиболее распространенной является лаковая бумага, но также популярны фенол-фарфоровый метил и оранжевый метил. В нейтральной среде цвет остается неизменным, но в кислой или щелочной среде можно получить различные цвета.
Изменение цвета индекса дает понять, что произошел гидролиз. Однако, если цвет остается неизменным, это не всегда означает, что гидролиз не произошел. Если при гидролизе образуется соль со слабым основанием и слабой кислотой, среда также будет почти нейтральной. Об этом мы еще поговорим, а пока давайте посмотрим на таблицу.
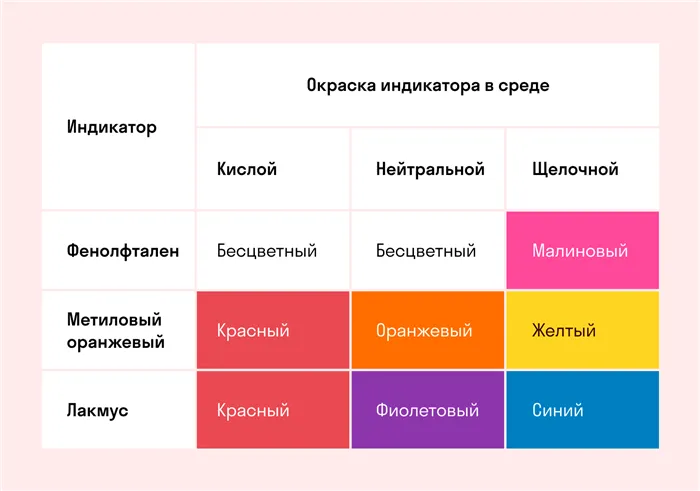
В руководстве и в задаче вместо фразы «средства решения» вы можете увидеть «pH». По сути, это одно и то же. В нейтральной среде pH = 7, в чрезмерно кислой среде с положительно заряженными ионами водорода H+, pH ниже 7, в щелочной среде с чрезмерно заряженным OH, pH выше 7.
Химические вещества могут подвергаться гидролизу как в перевернутом, так и в развернутом виде. В первом случае деградирует только определенное количество частиц, тогда как во втором случае деградирует почти все. Если соль полностью разлагается водой, то это необратимый процесс и называется полным гидролизом.
Соли, содержащие слабые нерастворимые основания и терпеливые и/или летучие кислоты, подвергаются гидролизу. Такие соединения присутствуют только в сухом состоянии. Их нельзя получить путем смешивания водных растворов других солей.
Например, сульфид алюминия подвергается полному гидролизу.
Как вы видите, при гидролизе образуются гидроксид алюминия и сероводород.
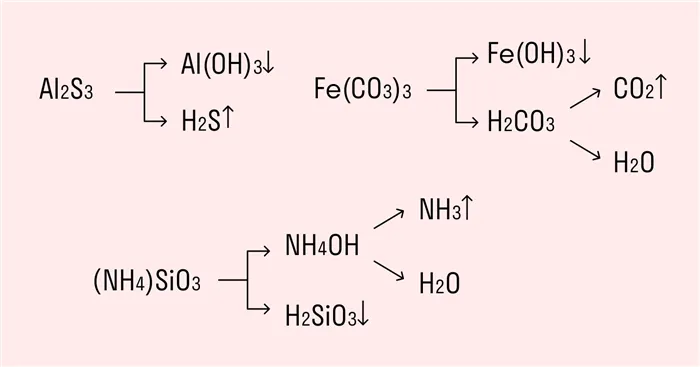
Необратимый гидролиз также имеет место в органической химии. В качестве примера рассмотрим полный гидролиз карбида кальция, органического вещества, который приводит к образованию ацетилена.
Степень гидролиза
Взаимодействие воды с солью или другим соединением может быть увеличено или уменьшено в зависимости от различных факторов. Если получено количественное выражение гидролиза, указывается степень гидролиза, выраженная в процентах.
nТяжело. — Количество гидролизованного материала, количество
nВсего. — Общее количество вещества, растворенного в воде.
На степень гидролиза могут влиять
Температура, при которой происходит процесс, n
концентрация водного раствора, и
синтез веществ, участвующих в гидролизе.
Гидролиз можно усилить, используя воду (простое разбавление полученного раствора) или стимулируя процесс путем повышения температуры. Более сложный метод заключается в добавлении в раствор веществ, которые могут связываться с одним из продуктов гидролиза. К пациенту следует добавить соли слабых и сильных оснований, а также слабое основание и сильную кислоту.
Чтобы ослабить гидролиз, раствор охлаждают и/или сгущают. Его состав также может быть изменен. Если гидролиз катионный, добавляется кислота, если анионный — щелочь.

Итак, теперь вы понимаете, что такое гидролиз соли и чем он не является. Теперь пришло время проверить свои знания и ответить на несколько вопросов по материалу.
Вопросы для самопроверки:
Каковы требования к гидролизу?
Какие типы гидролиза вы знаете?
В каких случаях гидролиз может привести к слабощелочной или слабокислой среде?
Каков тип гидролиза сильных солей и слабых кислотных остатков?
Если происходит гидролиз сильного основания с сильным основанием и слабой кислотой, следует ли добавить в раствор кислоту или щелочь, чтобы ослабить процесс?
Как гидролиз влияет на разбавление раствора водой?
Как определяется количество этапов гидролиза?
Какая среда раствора образуется при гидролизе NAF, KCL, FEBR2, на2по.4; может быть более одного ответа.
Какие соли гидролизуются катионами: csl, FESO4, рбно3, кузо4, Mn (no.3)2; может быть более одного ответа.
Какие соли не подвергаются гидролизу: k2HPO4, KNO3, KCN, NI (нет.3)2;
Гидролиз соли — это обмен соли с водой с образованием слабого электролита. Возможность и характер гидролиза определяется природой основания и кислоты, из которых образуется соль.
Роль гидролиза в биологических процессах
- Полимеры (белки, жиры и полисахариды) во время переваривания пищи благодаря гидролизу превращаются в мономеры (аминокислоты, глюкозу и т.д.). То есть без гидролиза пища почти не может усваиваться.
- Многие лекарства, попадая в наш организм, подвергаются гидролизу. Значит, без гидролиза лекарства бы усваивались хуже.
- Гидролиз – это взаимодействие молекул воды с ионами растворённого вещества. Нерастворимые соли гидролизу не подвергаются!
- Выделяют три среды: кислую, нейтральную и щелочную. Если ионов водорода больше, чем гидроксид-ионов, то среда кислая. Если ионов водорода и гидроксид-ионов примерно одинаковое число, то среда нейтральная. Если ионов водорода меньше, чем гидроксид-ионов, то среда щелочная.
- Концентрацию ионов водорода отражает pH. Эта величина пропорциональна концентрации водорода. То есть, чем больше ионов водорода, тем меньше значение pH.
- Гидролиз ищет слабую часть, а среда – сильную!
(c) перевести один из продуктов гидролиза в активное соединение или удалить один из продуктов в газовую фазу. Например, гидролиз цианида аммония значительно усиливается при разложении аммиачного аммония с образованием аммиачного аммония и воды.
Типы гидролиза и примеры уравнений
Поскольку процесс протекает с более слабыми компонентами, возможны три типа этого процесса Они соединяются, используя катионы или анионы.
Давайте рассмотрим каждый из этих типов по отдельности.
По катиону
В этом случае слабосвязанные пациенты реагируют с водой. Высвобождается большое количество протонов водорода, и раствор становится кислым. Это означает, что значение pH приближается к низкому значению.

Рассмотрим гидролиз сульфата меди.
По мере увеличения катионной нагрузки степень процесса возрастает.
Гидролиз хлорида цинка, нитрата аммония, хлорида аммония, сульфата алюминия и других соединений относится к тому же типу.
По аниону
Здесь анионы пациента реагируют с водой. Среда становится щелочной. Это означает, что pH раствора стремится к 14.

Карбонат натрия:.
Степень этой реакции увеличивается по мере уменьшения электризуемости аниона.
Гидролиз фосфата натрия, сульфата калия и других подобных соединений также относится к ним.
Совместный
Это происходит, когда и катионы, и анионы являются ионами электролита пациента. В данном случае имеет место нейтральная среда (pH = 7), когда степень протекания процесса одинакова для каждого компонента.
Это может включать гидролиз ацетата аммония, сульфата алюминия и других подобных соединений.

Давайте рассмотрим пример AL2S3.
2AL3 + + 6HOH + 3S2- + 6HOH = 2AL(OH)3 + 6H + + 3H2S + 6OH
2AL3 ++ 3S2- + 6HOH = 2AL(OH)3 + 3H2S
Реакции такого типа, как изученные в солевых растворах, происходят во всех областях многоклеточных организмов. Они также находят применение в технике, промышленности, медицине, фармакологии и косметологии.
Сущность гидролиза солей
Гидролиз соли — это обмен соли с водой с образованием слабого электролита. Возможность и характер гидролиза определяется природой основания и кислоты, из которых образуется соль.
Слово «гидролиз» происходит от двух греческих слов «вода» и «разложение».
Что касается разложения электролитов, то суть гидролиза заключается в соединении ионов соли с водородом или гидроксильными ионами воды (и то, и другое одновременно).
Если образуется слабый электролит, то баланс реакций ионного обмена в растворе смещается в сторону процесса гидролиза. Нарушается баланс реакций электролиза воды и изменяется средняя природа раствора (в зависимости от ионного произведения избыточных ионов H+ или OH- воды).
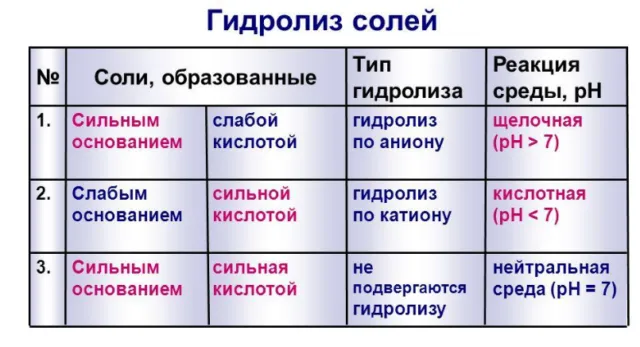
Рисунок 1.Таблица гидролиза солей.
Реакции гидролиза солей
Если в результате взаимодействия с водой образуется слабый электролит, реакция гидролиза просто не протекает. Это происходит, когда соли образуются сильными основаниями и анионами сильных кислот (например, NaCl, K2SO.4Нано.3). Их водный раствор нейтрален (ph = 7):.
Во всех остальных случаях реакции гидролиза протекают следующим образом
-
соль образована катионом слабого основания и анионом сильной кислоты: например, соли хлорид аммония NH4CL, нитрат цинка3)2.
Примеры гидролиза хлорида аммония:.
- соль образована катионом сильного основания и анионом слабой кислоты: например, соли ацетат натрия CH3Куна, карбонат натрия (сода) Na2co.3. Их водные растворы имеют щелочную реакцию (pH больше 7), и на первой стадии происходит гидролиз по аниону соли. Например, карбонат натрия Na2co.3 диссоциирует в водном растворе на ионы натрия и карбонат-ионы, далее карбонат-ионы реагируют с водой.
- наиболее полному гидролизу подвергаются хорошо растворимые соли, образованные катионом слабого основания и анионом слабой кислоты: например, ацетат аммония CH3кун.4. В этом случае гидролиз идет до конца и по аниону, и по катиону, а характер среды практически нейтральный. Гидролиз ацетата аммония протекает согласно уравнению:
раствор ацетата аммония почти нейтрален (pH 7). Это объясняется тем, что стабильный дом уксусной кислоты и гидроксида аммония по сути один и тот же.
Ионная теория Аррениуса описывает механизм гидролиза следующим образом. Вода расщепляется на ионы H+ и OH, хотя и в небольшой степени. Если в результате гидролиза образуется низкомолекулярное основание, часть ионов OH связывается, а равное количество H+ освобождается, вызывая кислую реакцию раствора. Напротив, если часть ионов H+ связана в результате гидролиза, такая же доля ионных ионов остается свободной, что определяет щелочную среду раствора.

Рисунок 3. Теория Аррениуса.








