Гидроксид кальция также может образовывать соединения с углекислым газом. Как и другие сильные основания, гидроксид кальция реагирует с углекислым газом, растворенным в воде, поэтому растворы этого вещества мутнеют на воздухе.
Гидроксид кальция — Calcium hydroxide
Если не указано иное, данные приведены для материалов при нормальных условиях (25°C 77°F, 100 кПа).
Гидроксид кальция (традиционно известный как гашеная известь) — это неорганическое соединение с химической формулой Ca(OH).2. Это бесцветные кристаллы или белые порошки, образующиеся при смешивании или гашении извести (оксида кальция) с водой. Они имеют множество названий, включая известковую известь, гашеную известь, строительную известь, гашеную известь, известь и травильную известь. Гидроксид кальция используется во многих областях, включая кулинарию, номер E526. Известковая вода — это общее название насыщенного раствора гидроксида кальция.
СОДЕРЖАНИЕ
Гидроксид кальция несколько нерастворим в воде, его ретроградная растворимость увеличивается с 0,66 г/л при 100°C до 1,89 г/л при 0°C. Используя произведение растворимости Ksp, равный. 5,5×10-6в T =; его растворение в воде достаточно велико, чтобы раствор стал основным в соответствии со следующей реакцией растворения.
При температуре окружающей среды гидроксид кальция (портландит) растворяется в чистой воде с образованием щелочного раствора с pH приблизительно 12,5. Растворы гидроксида кальция могут вызвать химические ожоги. При более высоких значениях pH его растворимость значительно снижается из-за общих ионных эффектов, вызванных OH-гидроксид-анионами. Такое поведение типично для цементных паст. Водные растворы гидроксида кальция, называемые известковыми водами и основаниями средней силы, реагируют с кислотами, воздействуя на некоторые металлы, такие как алюминий (растворенный гидроксид амфотерен при высоком pH), и одновременно защищая другие металлы, такие как железо и сталь. Поверхность. Из-за образования карбоната кальция кальциевая вода в присутствии углекислого газа становится молочно-белой. Этот процесс известен как карбонизация.
При нагревании до 512°C парциальное давление воды в равновесии с гидроксидом кальция достигает 101 кПа (нормальное атмосферное давление), в результате чего гидроксид кальция распадается на оксид кальция и воду.
Состав, подготовка, возникновение

СЭМ-изображение (масштаб микрометра) затвердевшей, растрескавшейся цементной ткани, на котором видны пластинки гидроксида кальция и иглы эттрингита.
Гидроксид кальция, как и все гидроксиды металлов, имеет полимерную структуру. Его структура идентична структуре Mg(OH)2 (структура блюзита), т.е. рисунок йодида кадмия. Между слоями существуют прочные водородные связи.
Гидроксид кальция получают в промышленных масштабах путем обработки извести водой.
В лаборатории его можно приготовить, смешав раствор хлорида кальция и гидроксида натрия. Минеральная форма портландита относительно редка, но встречается в некоторых вулканических, плутонических и метаморфических породах. Известно также, что он возникает в результате сжигания угольных отвалов.
Положительно заряженный ионизированный компонент CaOH+ содержится в атмосферах звезд S-типа.
Еще одно важное применение — бумажная промышленность, где он используется в производстве гидроксида натрия. Это преобразование является компонентом хорошо известного процесса крафт, используемого для получения целлюлозы.
Применение гидроксида кальция
Гидроксид кальция широко используется в производстве строительных материалов, таких как известь, гипс и штукатурка. Его используют как дешевую альтернативу щелочи в виде суспензии (известковое молоко), применяемой для дубления кожи, а также извести при производстве сахара и стволов деревьев для удаления волос с кожи.
Известняк представляет собой насыщенный водный раствор белого гидроксида кальция. Антацидные свойства гидроксида кальция используются в медицине для лечения кислотных ожогов. Полезным свойством гидроксида кальция является его способность действовать как аллигатор для очистки сточных вод от взвешенных и коллоидных частиц. Он также используется для повышения pH воды, так как вода в своем первоначальном виде содержит кислоты, которые могут разъедать трубы гидравлических установок.
Гидроксид кальция также широко используется в таких отраслях, как
- Дорожное строительство – для улучшения качества земляной почвы;
- Производство металлов – гидроксид кальция вводят в поток отработанного газа, чтобы нейтрализовать кислоты, такие как фториды и хлориды до выпуска в атмосферу;
- В нефтеперерабатывающей промышленности – для производства добавок к маслам;
- В химической промышленности – для производства стеарата кальция;
- В нефтехимической промышленности – для производства твердых масел различных типов;
- Производство антигрибковых и антимикробных консервантов – для хранения овощей в ангарах.
Гидроксид кальция используется в качестве добавки в морскую воду и для снижения атмосферного ко2 ослабляет парниковый эффект.
Гидроксид кальция также используется в качестве естественной альтернативы пестицидам, будучи эффективным в борьбе с клещами, блохами, постельными клопами и их личинками.
В строительстве гидроксид кальция используется в накладках из кальция и бруса на деревянные заборы для защиты материала от истирания и огня, а также при приготовлении силикатного бетона и извести.
Гидроксид кальция также участвует в процессах производства эбонита, белильной извести, резервуаров, воскового крема и тормозных колодок.
Свойство гидроксида кальция снижать определенное сопротивление почвы используется при изготовлении точек электрического заземления.
В стоматологии гидроксид кальция используется в качестве дезинфицирующего средства для корневых каналов.
В пищевой промышленности гидроксид кальция широко используется в качестве пищевой добавки E526 и добавляется в процессе производства.
- Сахарного тростника;
- Алкогольных и безалкогольных напитков;
- Энергетиков;
- Фруктовых соков;
- Детского питания;
- Маринованных огурцов;
- Пищевой соли;
- Кондитерских изделий и сладостей;
- Какао-продуктов;
- Кукурузных лепешек;
- Мучных изделий и выпечки.
В Испании для приготовления мамалыги используют гидроксид кальция, так как считается, что он помогает улучшить переваривание пластин.
Племена коренных американских индейцев используют гидроксид кальция в качестве ингредиента психоделического дыма яп, который получают из семян бобов под названием анаденантера.
Свойства гидроксида кальция
Гидроксид кальция представляет собой бесцветные кристаллы или белый порошок без запаха, который при нагревании до 580°C распадается на оксид кальция и воду.
Гидроксид кальция имеет молекулярную массу 74,093 г/моль, плотность 2,211 г/см3, растворимость в воде 0,189 г/100 мл, кислотность (PCA) 12,4 и показатель преломления 1,574.
Гидроксид кальция нерастворим в спирте.
Вред гидроксида кальция
При контакте гидроксида кальция с кожей он вызывает сильное раздражение кожи, зуд, химический ожог и некроз.
Случайный прием гидроксида кальция внутрь вызывает боль в горле, жжение во рту, боль в животе, рвоту, кровавый стул и повышение артериального давления. pH крови также повышается, что приводит к чрезмерной щелочности, которая может вызвать повреждение внутренних органов.
При вдыхании порошка гидроксида кальция через нос или рот может опухнуть горло и затрудниться дыхание. При попадании частиц гидроксида кальция в легкие требуется немедленная медицинская помощь.
Если гидроксид кальция попадает в глаза, он вызывает тяжелую и болезненную потерю зрения.
Первая помощь при отравлении гидроксидом кальция
При проглатывании гидроксида кальция следует выпить стакан воды или молока.
При попадании гидроксида кальция на кожу или в глаза хорошо промойте пораженные участки кожи и глаза большим количеством воды в течение не менее 15 минут.
При вдыхании гидроксида кальция немедленно выйдите на свежий воздух и вызовите скорую помощь.
Гидроксид кальция также участвует в процессах производства эбонита, белильной извести, резервуаров, воскового крема и тормозных колодок.
Формула гидроксида кальция, свойства, реакционная способность и применение
Гидроксид кальция, также известный как стертая известь или стертая известь, является неорганическим соединением типа Ca(OH).2Ca(OH).
Гидроксид кальция, как и все гидроксиды металлов, имеет многостороннюю структуру и идентичен гидроксиду магния (Mg(OH)).2), также известный как брусит.
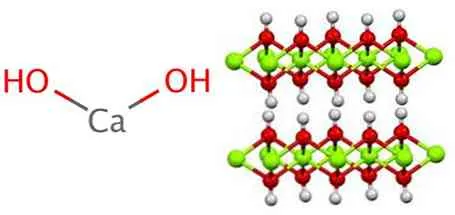
В этой структуре можно наблюдать образование водородных мостиков. Гидроксид кальция синтезируется в промышленности с использованием воды по следующей реакции, вместе с реакцией оксида кальция, также известного как известь или известь.
Его также получают в лаборатории путем реакции между хлоридом кальция и гидроксидом натрия.
Гидроксид кальция встречается в природе, но редко в минеральной форме, как карманы, встречающиеся в некоторых вулканических и преобразованных породах. (Виды гидроксида кальция — Использование, свойства, структура и виды гидроксида кальция, 2005-2017).
Это соединение также широко распространено в цементе, растворителях, промышленных очистителях (например, строительных материалов), дизайнерских напольных покрытиях, очистителях кирпича и цементных конденсаторах.
Водный раствор обычно называют известняком. Известняк получают путем размешивания гидроксида кальция в чистой воде и отфильтровывания избытка Ca(OH).2 Он не растворяется.
При добавлении избытка гидроксида кальция к кальцию получаются частицы гидроксида кальция, которые имеют молочно-белый вид и обычно называются кальцием Известь или насыщенный известковый раствор (известь) имеет pH 12,3 благодаря своим основным свойствам …
Физико-химические свойства гидроксида кальция
Гидроксид кальция представляет собой белую или бесцветную пыль без запаха. В водных растворах (насыщенных растворах) наблюдается молочно-белый вид из-за нерастворимого гидроксида кальция сверху.
Неизвестные растворы обычно представляют собой прозрачные, бесцветные растворы с легким ржавым запахом и горьким щелочным вкусом гидроксида кальция. Внешний вид ассоциации показан на рисунке 3 (Royal Society of Chemistry, 2015).

Гидроксид кальция имеет молекулярную массу 74 093 г/моль и плотность 2 211 г/см3 в твердом состоянии. Его температура плавления составляет 580°C. Он слабо растворим в воде и может раствориться в 1,89 г/л при 0°C, 1,73 г/л при 20°C и 0,66 г/л при 100°C.
Растворим в глицерине и растворах кислот. Нерастворим в спирте (Национальный центр биотехнологической информации, С.Ф.).
Гидроксид кальция частично растворим в воде, образуя раствор, называемый известняком, который является посредственным основанием. Известняк или ка (а)2 (вода) Он реагирует с кислотами, образуя соли, которые могут воздействовать на некоторые металлы, такие как алюминий. Известковая вода легко вступает в реакцию с углекислым газом, образуя двуокись углерода. Карбонат кальция — это полезный процесс, называемый углеродом
Нитропарафин, нитрометан, нитропропан и т.д. и т.д. Они образуют соли с неорганическими основаниями, такими как гидроксид кальция. Эти сухие соли взрывоопасны. Это соединение можно использовать в качестве основания для гидроксида натрия (NaOH) или оксида натрия (Na2O). Они экзотермически нейтрализуют кислоты с образованием солей и воды.
При смешивании этих материалов с водой может выделяться опасное количество тепла, когда основа растворяется или плавится. Основания реагируют с некоторыми металлами (например, алюминием и цинком), образуя оксиды или гидроксиды металлов с образованием газообразного водорода.
Основания могут инициировать реакции полимеризации с полимеризуемыми органическими соединениями, особенно с эпоксидами. Воспламеняющиеся и/или токсичные газы могут образовываться из солей аммония, нитридов, галогенированных органических веществ, различных металлов, пероксидов и гидропероксидов. Соединения такого типа часто выступают в качестве катализаторов (HYDROXIDE CALCIUM, S.F.).
Реактивность и опасности

Гидроксид кальция является стабильным соединением, хотя он несовместим с сильными кислотами. Он классифицируется как раздражитель, и его опасность заключается в следующем
Вызывает коррозию глаз (повреждение роговицы или слепота) и кожи (раздражение и волдыри).
Вдыхание пыли может вызвать раздражение желудочно-кишечного тракта или дыхательных путей, характеризующееся чувством жжения, чиханием и кашлем. Сильное переоблучение может вызвать повреждение легких, удушье, потерю сознания или смерть. Раздражение глаз характеризуется покраснением, раздражением и зудом (Material Safety Data Sheet Calcium hydroxide, 2013).
Повторное воздействие низких уровней пыли на глаза может вызвать раздражение, локальное повреждение кожи или кожный дерматит. Повторное вдыхание пыли может вызвать различной степени раздражение дыхательных путей и повреждение легких.
При попадании этого химического вещества в глаза немедленно промойте их большим количеством воды, можно приподнять нижние и верхние веки. Немедленно обратитесь к врачу. Не используйте контактные линзы при работе с этим химическим веществом.
Если произошел контакт кожи с этим химическим веществом, зараженную кожу следует немедленно промыть водой с мылом. Если это химическое вещество проникло на одежду, немедленно снимите одежду и промойте кожу водой. Если раздражение не проходит после промывания, обратитесь за медицинской помощью.
При вдыхании большого количества этого химического вещества человека, подвергшегося воздействию, следует немедленно переместить на свежий воздух. Если дыхание прекратилось, проведите реанимацию методом «рот в рот», согрейте и успокойте пострадавшего. Как можно скорее обратитесь за медицинской помощью.
При проглатывании немедленно обратитесь за медицинской помощью и по возможности покажите контейнер или этикетку (Отравление гидроксидом кальция, 2017).
Гидроокись кальция — неорганическое соединение, щелочь кальция. Ее формула Ca(OH)2 Это вещество известно человечеству очень давно, отсюда и традиционные названия — лайм, лаймовая вода, лаймовое молоко, лаймовое молоко и пшёнка.
Характеристика гидроксида кальция
Кристаллический гидроксид кальция представляет собой белый порошок, который разлагается при нагревании, но практически не растворяется в воде. Типом гидроксида кальция является Ca(OH)2 Ca(OH). В ионной форме формула образования гидроксида кальция такова
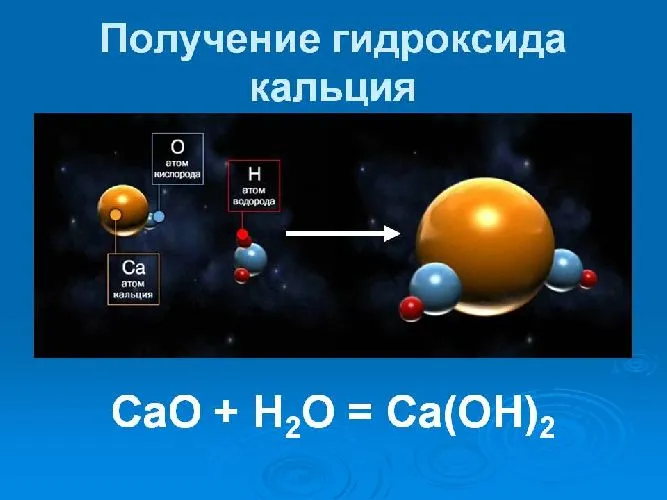
Рисунок 1.Уравнение образования гидроксида кальция.
Молекулярная масса гидроксида кальция составляет 74,09 г/моль. Это означает, что 74,09 г/моль гидроксида кальция содержит 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для приготовления извести при строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дубления кожи и белой извести. При строительстве используется смесь из стертой извести, цемента и песочного теста.

Рисунок 2.Гидроксид кальция.
Химические свойства гидроксида кальция
Гидроксид кальция реагирует с кислотами, как и все основания.
Гидроксид кальция также может образовывать соединения с углекислым газом. Как и другие сильные основания, гидроксид кальция реагирует с углекислым газом, растворенным в воде, поэтому растворы этого вещества мутнеют на воздухе.
При нагревании до 400°C гидроксид кальция вступает в реакцию с монооксидом углерода.
Гидроксид кальция может взаимодействовать с солями, что приводит к выпадению осадка.
Ca (а)2 (гидроксид кальция) + Na2 так что.3 (сульфат натрия) = caso3 (сульфид кальция) + 2NaOH (гидроксид натрия).
При температуре 520-580° C происходит реакция разложения гидроксида кальция. Производит оксид кальция и воду:.

Рисунок 3.Lime.
Гидроксид кальция образуется в результате химической реакции оксида кальция (кальция). Этот процесс известен как «элиминационная известь». Уравнение реакции для обесценивания извести выглядит следующим образом








