— Используется в качестве сбалансированного кормового оксинта для животных и домашних питомцев. Фармацевтическая промышленность использует его для производства противоэмиссионных препаратов. Он также используется в смесях для приготовления битума для покрытия грунта и ремонта трещин.
Р2 3 — очень сильный восстановитель
1. окисление кислородом воздуха:.4 10 ��. 3� 2. Растворяется в сиропообразной жидкости при контакте с воздухом (NPO2 5 � �.
Способ получения
— Это самый эффективный фактор для сушки и освобождения от воды. Используется для сушки нелетучих веществ и газов.
Фосфат � Фосфат образуется при сжигании фосфора в избытке воздуха.2 5 �
Диалог.
(a) с водой, образуя различные кислоты.2 5 ��. 3 + zbao = ba4(PO2
)
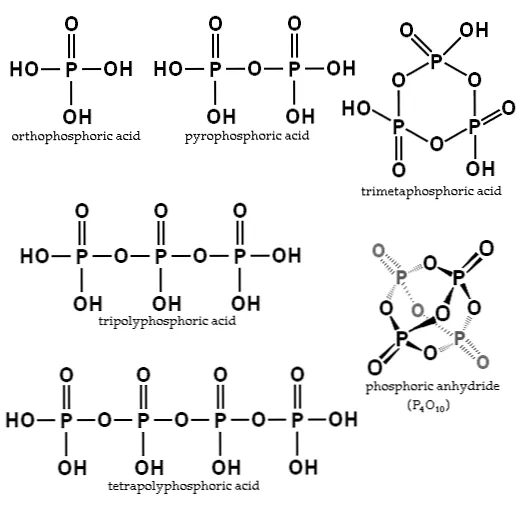
Фосфорные кислоты
(c) щелочные, образующие промежуточные и кислые соли.

Фосфор образует только два постоянных оксида, но образует многочисленные кислоты, находящиеся в состояниях окисления +5, +4, +3 и +1. Структуры наиболее известных кислот представлены следующими типами
Как видно из этих типов, фосфор во всех случаях образует пять ковалентных связей. Это означает, что его жизненная сила равна V. В то же время, состояние окисления фосфора и базальная природа кислоты различаются.
Практичными являются ортофосфорный фосфор и фосфорная кислота.2Эти соединения могут быть представлены типом HO (pooOH)х2H, где HO — левый конец, который может быть обезвожен. по.
Профиль фосфорной кислоты
OH представляет собой фосфофрейм со связями р = о и о- и х, где х представляет собой связь или молекулу фосфата, необходимую для создания вышеуказанной цепи.
Молекулярная масса: 97,994 г/моль Внешний вид: вязкая бесцветная жидкость.
Температура кипения: 212°C Температура плавления: 42,35°C (кристаллическое твердое вещество).
Структура
Динамическая вязкость: 2,4-9,4 сантипуаз (85% водный раствор) Плотность: 1,83 г/см3 (твердый) — 1,68 г/см3 (85% водный раствор при 25°C)3Соединение h4по.
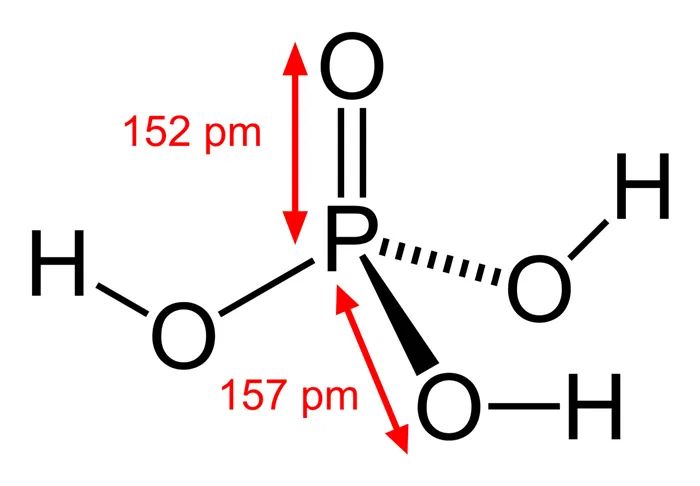
Всего существует 32 валентных электрона. Фосфор обладает наименьшим количеством электричества и поэтому помещен в центр. Атомы водорода присоединяются к внешним атомам кислорода, образуя он-группы.
В этой структуре каждый человек имеет полную внешнюю оболочку. Фосфор и атом кислорода имеют восемь валентных электронов, а атом водорода имеет два окружающих атомных электрона.
Фосфор, который может иметь обширную октаву (восемь валентных электронов), получает стандартную нагрузку +1, в то время как кислород (который не связан с атомом водорода) получает стандартную нагрузку -1. Вследствие образования двойной связи фосфор и кислород теряют свою нагрузку.3Соединение h4по
.
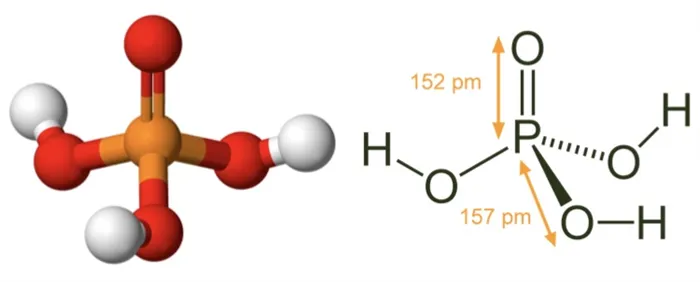
Соединение содержит три простые связи OH, три простые связи PO и одну двойную связь P = O. Каждая простая связь является сигма-связью, а двойная связь состоит из сигма-связи и связи p
Фосфорная кислота: сферическая модель и структурные размеры3Молекулярная геометрия PO (OH).
Он имеет тетраэдрическую и монокристаллическую структуру. Распределение центральной индивидуальной нагрузки асимметрично, поэтому молекула считается полярной.
Как она производится?
Последние достижения в области нанотехнологий, включая методы оптического рентгеновского поглощения, позволили ученым определить структуру фосфорной кислоты. Расстояние связи p = структура близко к 152 пикометрам, расстояние p = o-O улучшается до 309 пикометров, а угол связи находится вблизи тетраэдра.
Фосфорная кислота может быть получена жидким или термическим способом.
Последний использует в качестве сырья воздух, воду и элементарный фосфор. Он включает в себя три основных этапа: горение, гудение и туманообразование. Послушайте, как это делается:.
Во-первых, жидкие школьники сгорают в камере сгорания при высоких температурах в диапазоне 1650-2760°C. Эта реакция окисления происходит в воздухе окружающей среды и приводит к образованию пентоксида фосфора.
Затем продукты регидратируются водой с образованием сильной фосфорной кислоты (жидкое состояние).
На заключительном этапе используется фосфатный туман из тока выхлопных газов с помощью тумана высокого давления.
Концентрация фосфорной кислоты, синтезированной в ходе этого процесса, обычно варьируется в пределах 75-85%. Такие уровни концентрации необходимы для производства высококачественных химических веществ. Некоторые эффективные установки используют тот же термический процесс для получения высококонцентрированной фосфорной кислоты (до 99,9%).
Однако почти 80% фосфорной кислоты производится жидким способом. В этом методе серная кислота обрабатывается природными минералами, содержащими фосфорную кислоту, такими как гидроксиапатит.
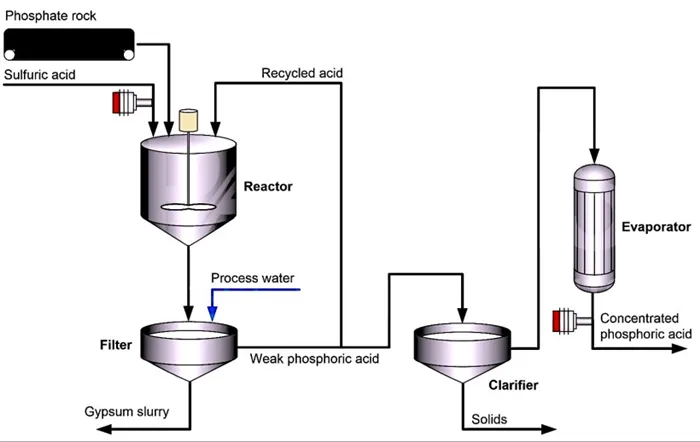
Минералы высушиваются, измельчаются, а затем вместе с серной кислотой поступают в реактор. В результате этой реакции сульфат соединяется с кальцием (из минерала), образуя сульфат кальция (гипс).
Затем добавляется вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная в результате этого жидкого процесса, содержит 25-30% пентоксида фосфора.
Кислота обычно дополнительно концентрируется для удовлетворения потребностей производства удобрений. В большинстве случаев фосфат концентрируется до 40-55% пентоксида фосфора с помощью вакуумного испарителя 2/3.
Пентоксид фосфата удаляет не только гигроскопическую влагу, но и химически связанную воду из других веществ. Он может даже обезвоживать обезвоженный кислород:.
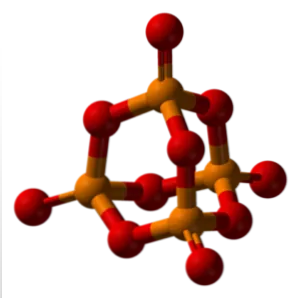
Номенклатура.
Номенклатура фосфорной кислоты определяется ИЮПАК и тем, как называются трехсторонние кислоты.3В ч4по.
Орто
человек P имеет интенсивность +5, самое высокое значение, его кислота получает окончание-Co с приставкой фосфор.
Однако фосфорную кислоту обычно также называют ортофосфорной кислотой. Почему; потому что греческое слово «правильный» означает «истинный», что приводит к «истинной» или «более влажной» форме.4 10 3В ч4, фосфорная «шапочка» на рисунке выше) h производится2и2 5o -p
Пиро
��. 2и2 5o -p.
цель
� -p
(греч. �p).
Пост-тег, который также является греческим, означает «после». В этом случае его добавляют к веществу, пресс которого разрушил молекулу.2и2 5o -p3 � -p 3В ч4 (2). Метапрефикс прекрасно совместим с круговым РА. Потому что если трифосфатный дегидрат присутствует, но никакие другие Н-единицы не добавляются к
PO
4 учебной кислоты, необходимо образовать кольцо.
Молекулярная формула
Молекулярный вес
Внешний вид
Это справедливо и для других многофосфорных кислот, но ИЮПАК рекомендует называть их круглыми соединениями соответствующих ПА…
Свойства.
Точки кипения и плавления
В твердом виде он представляет собой ромбический, гигроскопичный, прозрачный кристалл. В жидком виде он имеет внекристаллический вид вязкого сиропа.
Растворимость в воде
Он продается в водном растворе в концентрации 85% WT/MAS. Все эти презентации не имеют запаха.2158ºC (316ºF — 760 мм рт. ст.).
плотность
548 г / 100 г ч
Плотность пара
или при 20ºC-369,4 г/100 мл при 0,5ºC-446 г/100 м при 14,95ºC
Автоматическое зажигание
вязкость
1,892 г/см 3 (твердое вещество), 1,841 г/см 3 (100% раствор), 1,685 г/см 3 (85% раствор), 1,334 г/см 3 50% раствор) при 25ºC.
кислотность
По отношению к Air 3.4 (Air = 1).
3,86 мпуаз (40% раствор при 20ºC).
разложение
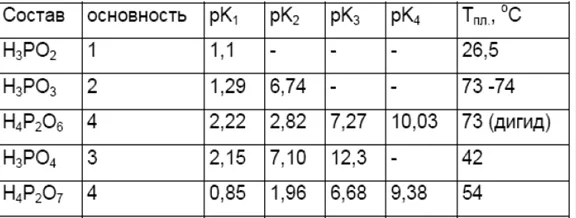
PH: 1,5 (0,1 N раствор в воде).4PKA: PKA1 = 2,148, PKA2 = 7,198 и PKA3 = 12,319. в результате чего сначала образуется водород и его кислота.2 7o -p.
коррозионная активность
� p
полимеризация
).
Коррозионная активность черных металлов и алюминия. В результате реакции с этими металлами образуется газообразный водород.
Фосфатные соли и общее использование
Сильно полимеризуется с азотом, эпоксидными и полимерными соединениями.
Применение.
Фосфорная кислота является основой фосфата и используется в качестве фосфата. Это связано с тем, что фосфор является одним из основных питательных веществ для растений.
— Он используется при лечении отравления свинцом и других состояний, требующих значительного количества фосфатов, а также для создания легкого ацидоза.2 — Норка используется для контроля рН мочи и стоек, чтобы избежать образования камней в почках.4 — Фосфорная кислота образует соли Na2В ч4 и нет.
PO
промышленные
6,8 и образует систему регуляции рН. Эта рН-регулирующая система присутствует и у людей. Он важен для регуляции внутриклеточного pH и контроля концентрации водорода в прочных трубках и почечных коллекторах.
— Он используется для удаления заплесневелых слоев оксида железа, которые накапливаются на этом металле. Фосфорная кислота образует фосфат железа, который легко удаляется с поверхности металла. Он также используется при полировке электроалюминия и является связующим фактором в ударопрочных продуктах, таких как глинозем и магнезия.
— Фосфорная кислота предназначена для использования в качестве катализатора при производстве нейлона и бензина. Он используется как средство обезвоживания при гравировке резьбы, для получения пигментов для использования в текстиле, для коагуляции латекса в резиновой промышленности и в качестве промывки перекисью водорода.
— Используется в качестве сбалансированного кормового оксинта для животных и домашних питомцев. Фармацевтическая промышленность использует его для производства противоэмиссионных препаратов. Он также используется в смесях для приготовления битума для покрытия грунта и ремонта трещин.
-Участвует в разработке моющих средств и в кислотном катализе производства ацетилена.
стоматологический
-Используется в качестве подкисляющего агента в сбалансированных кормах для животных и домашних питомцев. Фармацевтическая промышленность использует его для производства противорвотных средств. Он также используется в смесях для приготовления битума для покрытия грунта и ремонта трещин.
косметика
Фосфорная кислота действует как катализатор в реакции гидратации алкенов с получением спиртов, в основном этанола. Он также используется для определения органического углерода в почве.
Стоматологи используют его для очистки и подготовки поверхности зубов перед установкой брекетов. Его также можно применять для отбеливания зубов и удаления зубного налета. Он также используется в производстве клея для зубных протезов.2 5Что касается его открытия, то оно было составлено Робертом Бойлем в 1694 году, который растворил p
Фосфорная кислота как получить
О

(пентоксид фосфора) в воде. Это одна из самых полезных минеральных кислот, и ее функция в качестве удобрения является наиболее важной. Фосфор, наряду с калием и азотом, является тремя основными питательными веществами для растений.
Знакомство с химическим продуктом логично начинать с его формулы. Она выглядит так:
Производство ортофосфорной кислоты (фосфорной кислоты)3Соединение h4 Фосфорная кислота — это неорганическая кислота средней силы с формулой H
Презентация по химии на тему: Производство фосфорной кислоты
PO


При нормальных условиях это бесцветные, гигроскопичные кристаллы.
Обращается внимание на то, что в соответствии с Федеральным законом N273-ФЗ «Об образовании в Российской Федерации» об организации образовательной деятельности обучение и воспитание обучающихся по ОВЗ организуется совместно с другими обучающимися или отдельно. Классы или группы.
Курсы повышения квалификации

Рабочие листы и материалы для учителей и воспитателей

Более 2 500 учебных материалов для школ и семей

Тема: ‘Производство фосфорной кислоты’
Название: фосфорная кислота (определение)Физические свойства фосфорной кислотыЦенность фосфорной кислотыПрименение фосфорной кислоты в производствеИстория открытия и производства фосфорной кислотыФосфорная кислота с фосфорной кислотойЭлектрохимические методы производства
Фосфорная кислота представляет собой прозрачную, бесцветную, вязкую жидкость без запаха. Фосфорная кислота, также известная как ортофосфорная кислота или фосфорная кислота (V), является неорганической кислотой. Это соединение фосфора со степенью окисления +5 с общей формулой P2O5-nH2O. Когда верхний оксид фосфора реагирует с водой в условиях низкой температуры, образуется прозрачная стеклообразная масса — метафосфорная кислота HPO3. При разбавлении водой образуется ортофосфорная кислота H3PO4.
При нагревании до 200-250°C ортофосфорная кислота дегидратируется с образованием пирофосфорной кислоты H4P2O7, которая далее дегидратируется при 400-500°C с образованием метафосфорной кислоты.

Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота 1 (часто называемая просто фосфорной кислотой 2). Его получают путем обмена фосфата на сильную кислоту или путем окисления белого фосфора азотной кислотой.
Название: фосфорная кислота (определение)Физические свойства фосфорной кислотыЦенность фосфорной кислотыПрименение фосфорной кислоты в производствеИстория открытия и производства фосфорной кислотыФосфорная кислота с фосфорной кислотойЭлектрохимические методы производства
Фосфорные кислоты.
Физические свойства фосфорной кислотыФосфорная кислота в чистом виде представляет собой бесцветный кристалл ромбовидной формы, который плавится при температуре 42,3oC. Однако химики редко сталкиваются с такими кислотами. Чаще всего они связаны с гемигидратом H3PO4 * 0,5 H2O, который выпадает в виде бесцветных гексагональных столбиков при охлаждении концентрированного водного раствора фосфорной кислоты. Температура плавления гемигидрата составляет 29,3oC. После плавления чистая H3PO4 образует маслянистую, вязкую жидкость с низкой проводимостью и значительно сниженной диффузионной способностью. Детальное изучение этих свойств и спектров показывает, что молекула H3PO4 в этом случае фактически не разрушается, а удерживается вместе сильными водородными связями в единой полимерной структуре. Обычно молекулы удерживаются вместе одной, редко двумя и очень редко тремя водородными связями. Когда кислота разбавляется водой, ее молекулы с большей вероятностью образуют водородные связи с водой, чем друг с другом. Из-за такого «предпочтения» воды кислоты смешиваются с водой самыми разными способами. Поскольку энергия гидратации не так высока, как у серной кислоты, нагревание H3PO4 при разбавлении не такое сильное, а разложение менее интенсивное. Согласно первой стадии разложения, ортофосфорная кислота считается электролитом средней силы (25-30%), вторая стадия считается слабой, а третья — очень слабой.
При нагревании до 200-250°C ортофосфорная кислота дегидратируется с образованием пирофосфорной кислоты H4P2O7, которая при дальнейшем обезвоживании до 400-500°C снова образует метафосфорную кислоту.
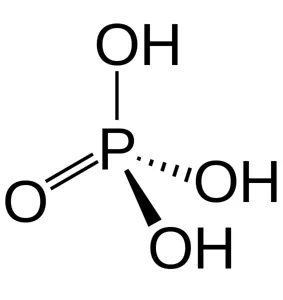
Категория фосфорной кислоты включает кислоты с атомами фосфора со степенями окисления + 3 и + 5.3Фосфорные кислоты — это кислоты с атомами фосфора со степенями окисления + 3 и +5.4Наиболее важной кислотой является ортофосфорная (фосфорная) кислота H
PO
.
Координационное число фосфора в этой кислоте равно 4. Связывание:.
(1) Связь P-O-H-сигма, ковалентная связь.
2) P = O-Сигма связь и пи, ковалентная полярная.
3) P-H — сигма-связь, неполярная ковалентная связь.
4) R-O-R — сигма-связь, ковалентная.
Строение фосфорной кислоты .

(5) P-P — сигма-связь, неполярная ковалентная связь.3Кислоты — это твердые вещества, которые очень хорошо растворяются в воде и постепенно разделяются.4 H2Кислоты — это твердые вещества, которые очень хорошо растворяются в воде и постепенно разделяются.4 является трибазовой кислотой, которая может образовывать три соли: дигидрохлорид (K2 PO4 ), гидрофосфат (K3Кислоты — это твердые вещества, которые очень хорошо растворяются в воде и постепенно разделяются.4 ), фосфат (K
PO
Физические свойства кислот фосфора.
). Все дигидрофосфаты растворимы в воде. Из фосфатов и гидрофосфатов растворимы только щелочные и аммонийные соединения.3Фосфат — хорошее удобрение: это хорошее удобрение.3Другой кислотой является фосфат H
PO