Начальная константа разложения карбоновой кислоты составляет 4,5-10-7. Все кислоты сильнее угольной кислоты замещают ее в реакции с карбонатом натрия. Карбоновая кислота очень нестабильна и поэтому быстро разлагается на воду и углекислый газ.
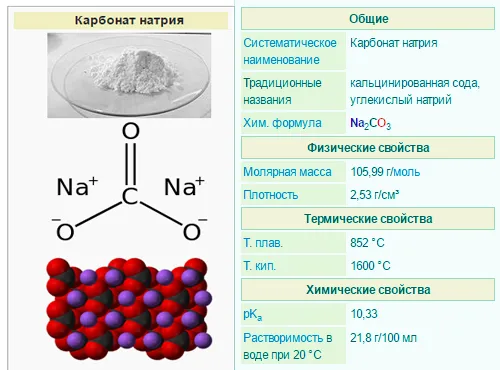
Карбонат натрия
Сода — это общее название промышленной натриевой соли углекислого газа.
- Na2CO3 (карбонат натрия) — кальцинированная сода
- Na2CO3-10H2O (дигидрат карбоната натрия, содержащий 62,5% кристаллической воды) — это пищевая сода.2CO3-10H2O или Na2CO3-7H2o
- NaHCO3 (гидрокарбонат натрия) — питьевая сода, натрий двууглекислый, бикарбонат натрия
Название «сода» происходит от названия растения, из которого ее добывают, — Salsola soda. Пищевая сода называется пищевой содой, потому что ее нужно прокалить (т.е. нагреть до высокой температуры) для образования кристаллического гидрата.
Каустическая сода называется гидроксидом натрия (NaOH).
Оксиды и гидроксиды
В природе каустическая сода встречается в золе некоторых морских водорослей, а также в следующих минеральных формах
Современные содовые озера известны в Забайкалье и Западной Сибири, очень известны озера Натрон в Танзании и Сарр в Калифорнии. Промышленно важный трона был обнаружен в эоцене Грин-Ривер (Вайоминг, США) в 1938 году. Помимо короны, эта осадочная последовательность содержала множество минералов, ранее считавшихся редкими, включая даусонит, который считается сырьем для производства соды и глинозема. В США на соду приходится более 40% потребности страны в этом минерале.
Получение
До начала 19 века карбонат натрия производился в основном из пепла некоторых водорослей и прибрежных растений.
Способ Леблана
В 1791 году французский химик Николя Леблан запатентовал «метод преобразования глауберовой соли в соду». В этом процессе смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля сжигается при температуре около 1000°C. Углерод уменьшает сульфат натрия до сульфида:…
Сульфат натрия вступает в реакцию с карбонатом кальция:.
Полученный расплав обрабатывают водой для перевода карбоната натрия в раствор, сульфид кальция отфильтровывают, а раствор карбоната натрия затем выпаривают. Сырая сода очищается путем перекристаллизации. Процесс Леблана производит соду в виде кристаллических гидридов (см. выше), а полученная сода обезвоживается путем кальцинирования.
Сульфат натрия получают путем обработки каменной соли (хлорида натрия) серной кислотой.
Выделяющийся в ходе реакции хлористый водород восстанавливается водой для получения соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После применения более экономичных (не оставалось большого количества побочных продуктов сульфида кальция) и технологически продвинутых методов Solvay, заводы по методу Леблана начали закрываться. К 1900 году 90% заводов производили соду по методу Solvay, а последний завод Leblanc закрылся в начале 1920-х годов.
Промышленный аммиачный способ (способ Сольве)
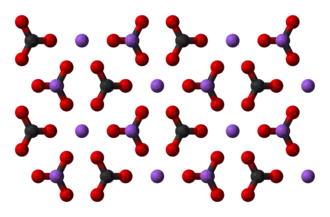
В 1861 году бельгийский инженер-химик Эрнест Сольвей запатентовал метод производства соды, который используется до сих пор.
К насыщенному раствору хлорида натрия добавляют равные количества газообразного аммиака и диоксида углерода. Другими словами, это похоже на ввод бикарбоната аммония NH.4HCO3:.
Выпавший нерастворимый остаток (9,6 г на 100 г воды при 20°C) фильтруют, нагревая до 140-160°C, прокаливают (обезвоживают), в процессе чего он превращается в карбонат натрия.
Полученный CO2 возвращается в производственный цикл. Хлорид аммония NH4Cl обрабатывается гидроксидом кальция Ca(OH)2:.
и образовавшийся NH3 также возвращается в производственный цикл.
Поэтому единственным продуктом отходов является хлорид кальция, который не имеет широкого промышленного применения, кроме как в качестве антифриза для уличного опрыскивания.
Содовые заводы такого типа были открыты в Бельгии в 1863 году. Первый завод такого типа в России был основан в 1883 году компанией «Любимов, Сольве и Ко» недалеко от города Березники на Урале. 20 000 тонн соды в год. В 2010 году ФАС России отказала Solvay в разрешении на покупку завода и позволила приобрести его Башкирской химической группе (которая также владеет содовым заводом). Источник не указан 293 дня.
По сей день это основной способ изготовления соды во всех странах.
Способ Хоу
Он был разработан китайским химиком ХоуДебангом в 1930-х годах. Он отличается от метода Solvay тем, что в нем не используется гидроксид кальция.
В процессе Хоу к раствору хлорида натрия при температуре 40°C добавляют углекислый газ и аммиак. Бикарбонат натрия, обладающий наименьшей растворимостью, выпадает в осадок во время реакции (как в методе Сольвея). Затем раствор охлаждают до 10°C. В результате хлорид аммония выпадает в осадок, а раствор повторно используется для изготовления следующей партии соды.
Порошок для нормализации работы верхних дыхательных путей (как разжижающее средство, ощелачивание бронхиального секрета и ингибирование воспаления).
Общая характеристика Карбонатов натрия
Карбонат натрия добывают из пепла деревьев, называемых сальсола сода, и поэтому это общее название соединения (нагревание). По химическому составу карбонат натрия является натриевой солью угольной кислоты, а его природные свойства заключаются в том, что он представляет собой бесцветный кристаллический порошок с кристаллами различной формы (ромбовидные, квадратные и маленькие круглые гранулы). Он растворим в воде, спирте и эфире.

Польза и вред Карбонатов натрия
Карбонат натрия считается безвредной для здоровья человека добавкой, и всем известен старый способ борьбы с изжогой. Смешав чашку пищевой соды в половине стакана воды, вы погасите «пожар» в пищеводе. Однако помните, что это не лекарство, а лишь способ быстро избавиться от изжоги на некоторое время, не воздействуя на основную причину. Однако чрезмерное употребление пищевой соды в ее натуральном виде может вызвать спазмы, боли в животе и, в редких случаях, аллергические реакции.

Применение Е500
Карбонат натрия используется в пищевой промышленности в качестве сухой смеси, регулятора кислотности и антикоагулянта. E500 (карбонат натрия) наиболее часто встречается в кондитерских изделиях и используется в широком ассортименте хлебобулочных изделий, хлебопекарных смесей, некоторых колбасных и мясных изделий, сухого молока и продуктов, содержащих какао-порошок.
Карбонат натрия используется в металлургии цветных металлов, производстве целлюлозы, производстве стекла и химической промышленности, а также в пищевой промышленности.

Пищевая сода — универсальный препарат для борьбы с бытовыми загрязнениями и садовыми вредителями. Это вещество дезинфицирует и очищает поверхности до блеска. Однако при использовании карбоната натрия важно помнить о безопасности. Раствор готовят, предварительно защитив руки перчатками, а дыхательные пути — маской.
История открытия
Люди были знакомы с пищевой содой очень давно — 2 000 лет до нашей эры. Древние египтяне добывали его из озерной воды. Сода также использовалась для варки стекла и в качестве заменителя моющих средств.
Слово «содовая» происходит от фразы «содиферус солярис». Этот термин использовался древними людьми для обозначения растения, которое сжигали, чтобы получить пепел. Затем его нагревали до высокой температуры, т.е. воспламеняли. Материал, из которого была изготовлена сода. Этот процесс продолжался до начала 19 века.
Идея искусственного получения пищевой соды приписывается французскому фармацевту Н. Леблану. Он предложил получать это вещество путем сжигания смеси сульфата натрия, углерода и толченого мела. Из этой смеси карбонат натрия промывают водой, раствор выпаривают и извлекают чистую соду. Полученный сульфат кальция считался отходами.
Впоследствии был разработан новый метод извлечения пищевой соды, который значительно сокращает количество отходов.
В природе большие количества карбоната натрия встречаются в виде рассолов подземных вод и в рассолах соленых озер.
Крупные месторождения этого союза находятся в Канаде, США, Мексике, Кении и Южной Африке. Щелочные озера встречаются в Западной Сибири и Забайкалье.
Отличие от другой соды
Соду следует отличать от пищевой соды и соды для выпечки.
Пищевая сода, пищевая сода и бикарбонат натрия являются типичными соединениями натрия. Однако эти соединения имеют разные химические формулы.
Пищевая сода является безопасным продуктом и может использоваться в быту и в кулинарии. Он может причинить вред только при попадании в организм в больших количествах.
Пищевая сода имеет высокий уровень pH — 11. Это соединение является сильно щелочным и может вызвать ожоги и аллергию. Его можно использовать только в домашних условиях. Пищевая сода обладает прекрасными очищающими свойствами.
Каустическая сода является щелочью и хорошо удаляет грязь, но может разъедать органические вещества. Очищающее действие пищевой соды сильнее, чем у бикарбоната натрия или пищевой соды. Каустическая сода является токсичным веществом.
| Вид соды | Формула | pH | Химическое название | Внешний вид | Токсичность |
| Пищевая | NAHCO3 | 8 | Гидрокарбонат натрия | белый порошок (кристаллический) | Нетоксична |
| Кальцинированная | Na2CO3 | 11 | Карбонат натрия | бесцветный порошок (кристаллический) | + |
| Каустическая | NaOH | 13 | Гидроксид натрия | белая чешуйчатая масса (твердая) | + |
Польза и вред карбоната натрия
Пищевая сода является полезным соединением, потому что
- имеет хорошие дезинфицирующие и моющие свойства;
- помогает удалить засор из канализационных труб;
- разрешена к использованию для стирки белья, машинной или ручной;
- эффективно удаляет накипь с внутренних поверхностей стиральных машин, посуды;
- может быть использована для смягчения жесткой воды;
- помогает удобрить почву, уничтожить садовых вредителей.
Несмотря на многочисленные преимущества, пищевая сода имеет и недостатки.
- при высокой концентрации в воздухе может спровоцировать взрыв;
- может вызвать ожоги и раздражение кожи, поскольку создает агрессивную щелочную среду.

Пищевая сода, бикарбонат натрия E500ii разрешена к розничной продаже. Это простое, эффективное и недорогое средство для решения многих бытовых проблем.
Химические свойства карбоната натрия. Химические реакции карбоната натрия:
Карбонат натрия — это умеренная соль, образующаяся из слабой угольной кислоты (H)2CO3) и сильное основание — гидроксид натрия (NaOH).
Водные растворы Na2CO3 раствор подвергается щелочной реакции.
Для карбоната натрия характерны следующие химические реакции
1. реакция карбоната натрия с углеродом:.
Na2CO3 +2C → 2Na+3CO (t = 900-1000 oC).
В результате этой реакции образуется монооксид углерода и натрий.
2. реакция карбоната натрия с бромом:.
В результате этой реакции образуется бромид натрия, бромид натрия и диоксид углерода. В этой реакции используется карбонат натрия в виде концентрированного горячего раствора.
3. реакция карбоната натрия с йодом:.
В результате этой реакции образуется йодистый натрий, йодид натрия и диоксид углерода. В ходе реакции используется карбонат натрия в виде концентрированного горячего раствора.
4. реакция карбоната натрия с хлором:.
В результате этой реакции образуются хлорид натрия, хлорид натрия и диоксид углерода. В этой реакции используется карбонат натрия в виде концентрированного горячего раствора.
5. реакция карбоната натрия с азотной кислотой:.
В результате этой реакции образуется нитрат натрия, углекислый газ и вода. В ходе реакции азотная кислота используется в виде разбавленного раствора.
6. реакция карбоната натрия с углекислым газом:.
В результате реакции образуется карбонат натрия.
7. реакция натрия с ортофосфатом карбоната:.
В результате реакции в первом случае образуется гидрогенизированный натрий, диоксид углерода и вода; во втором случае — дигидроксилированный натрий, диоксид углерода и вода; в третьем случае — ортофосфорный натрий, диоксид углерода и вода. При проведении реакций в первом и третьем случаях ортофосфорная кислота используется в виде разбавленного раствора, а во втором случае — в виде густого раствора. Карбонат натрия используется в виде разбавленного раствора во время первой и второй реакций и в виде густого раствора во время третьей реакции. Третья реакция происходит при кипячении.
Аналогичные реакции происходят и с другими кислотами.
8. реакция натрия и фторида с гидрокарбонатом:.
В результате этой реакции образуется фторид натрия, углекислый газ и вода. В ходе реакции используется фтористый водород в виде разбавленного раствора.
9. реакция карбоната натрия с карбонатом кремния:.
В результате этой реакции образуются углекислый газ и метапираснатопиры.
10. реакция карбоната натрия и серы:.
В первом случае в результате реакции образуются диоксид углерода и сульфат натрия. В ходе реакции используется карбонат натрия в виде плотного раствора. Реакция протекает при комнатной температуре.
В первом случае в результате реакции образуются углекислый газ и натрий. В реакции используется карбонат натрия в виде плотного раствора. Реакция протекает при температуре 40-60 oC.
11. реакция карбоната натрия и оксида алюминия:.
В результате этой реакции образуется углекислый газ и натриевая глина.
12. реакция натрия и карбоновой кислоты:.
В результате этой реакции образуется углекислый газ и железистый натрий.
Применение и использование карбоната натрия:
Карбонат натрия используется во многих отраслях промышленности и в бытовых целях.
— Бытовая химия: в моющих средствах и чистящих порошках.
— Производство эмалей для производства.
— Выжать воду из пароварки.
— Отсрочка металлов, отсрочка чугуна, -E500
В пищевой промышленности в качестве пищевой добавки -E500, в качестве регулятора кислотности, ферментационной среды, антикоагулянта, антикоагулянта
— В нефтяной промышленности в сочетании с поверхностно-активными веществами, снижающими парфюмерное напряжение между водой и маслом, и
— В химической промышленности в качестве предшественника для получения нао2b4o7, на2HPO4;
— В табачной промышленности (табачные фильтры).
— В фотографии в качестве ускорителя факторов роста.
— Дизельное топливо для предотвращения полимеризации (концентрация 2 г на 1 л масла).
Примечание: ©Фото https://www.pexels.com, https://pixabay.com
Карбонат натрия реакция кислота 1 2 3 4 5 карбонат натрия реакция вода уравнение реакции связь масса
Описанные вещества широко используются в различных отраслях промышленности и в быту. Карбонат натрия наиболее востребован в промышленности, особенно в производстве стекла, металлургии, добыче и переработке нефти.
Предлагаем сотрудничество
Свяжитесь с нашим отделом продаж, чтобы убедиться, что наше предложение является самым выгодным на российском рынке. Менеджер сразу рассчитает ваш заказ с учетом скидок и недорогой железнодорожной доставки и сообщит вам ориентировочную дату доставки. Создайте свой первый тестовый заказ и убедитесь, что вы стали лучшим поставщиком E500 в вашей компании, где бы вы ни находились — в Санкт-Петербурге, Ижевске или Иркутске.
Наш завод продает готовый к употреблению карбонат натрия по самым доступным ценам. На каждую проданную партию распространяется гарантия производителя. Соответствие состава нормативным требованиям проверяется лабораторными испытаниями. Для контроля качества из каждой партии продукции отбирается случайная проба.
| Показатели качества | |
| Наименование показателя | Требования ТУ |
| 1. Внешний вид | Гранулированные кристаллы или кристаллический порошок белого цвета |
| Массовая доля двуокиси углерода (Na2CO3), в пересчете на сухое вещество, %, не менее | 99,0 |
| 3. Массовая доля потери при прокаливании (при 270-300 0 С), %, не более | 0,8 |
| 4. Массовая доля свинца (Рb), мг/кг, не более | 5 |
| 5. Массовая доля мышьяка (As), мг/кг, не более | 3 |
| 6. Массовая доля ртути (Hg), мг/кг, не более | 1 |
Условия хранения: хранить в упаковке производителя в герметичном, проветриваемом складе вдали от влаги.








