Английский химик. В 1852 году он ввел в науку понятие личной привязки. Это свойство человека позже назвали валентностью.
Химические формулы веществ
Химический тип — это изображение качественного и количественного синтеза вещества через его химический символ.
Химический символ элемента — это первая или первые две буквы латинского названия элемента.
Например, Ferrum — Fe, Caprum — Cu, Oxygen — O и т.д.
Таблица 1: Информация, которую дает химический знак
В большинстве случаев название химического символа читается как название химического вещества. Например, potassium — калий, calcium — калий, Mg — магний и Mn — марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
Химические формулы простых веществ
Химическим типом большинства простых веществ (все металлы и многие неметаллы) является соответствующий химический символ.
Таким образом, сущность железа и химические элементы железа символизируются одинаково -fe.
Если простое вещество имеет молекулярную структуру (имеет молекулярную форму, например, молекула железа), то химический тип вещества — это тип молекулы. Тип — это химический символ элемента с указателем в правом нижнем углу, обозначающим количество человек в молекуле.2, o2, o3, n2 ; f2, кл2, b2, p4, s.8 .
Таблица 3: Информация, которую дает химический знак
Химические формулы сложных веществ
Типы сложных веществ создаются путем записи химических веществ, из которых состоит вещество, с указанием количества человек каждого элемента в молекуле. Как правило, химические вещества записываются в ряд по возрастанию числа электронов в соответствии со следующим практическим порядком.
Me, Si, B, Te, H, P, P, As, I, Se, C, S, B, Cl, N, O, F, F
Например, h2O, Caso4 , Ал2o3 , cs2 , из2 Нет, нет.
Исключения составляют.
Химические вещества, существующие как двусторонние (no.2 , p2 o3 , P2 O5, соль3 и т.д.) записываются как n2 o4, p4 o6, p4 o10, h g2 cl2, h g2(Нет.3)2 .
Число лиц в химическом веществе молекул и сложных ионов определяется понятием валентности или состояния окисления и обозначается указателем внизу справа от символа каждого элемента (индекс 1 опущен). Применяются следующие правила
Алгебраическая сумма состояний окисления всех лиц в молекуле должна быть равна нулю (молекула электрически нейтральна), вместе с ионной нагрузкой, в комплексе ионов.
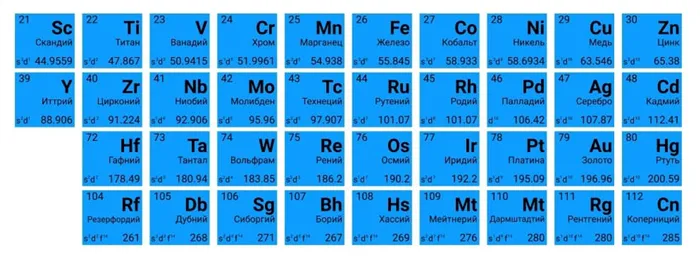
Это же правило используется при определении степени окисления химического вещества по типу вещества или комплекса ионов. Обычно элементы имеют различную степень окисления. Статус окисления других элементов, образующих молекулу или ион, должен быть известен.
Нагрузка комплексного иона является алгебраической суммой состояний окисления всех образующих ион веществ. Таким образом, после определения степени окисления химических веществ в ионном комплексе, сам ион заключают в скобки, а его нагрузку выводят из скобок.
В формулировке, основанной на живости, вещество представляется как соединение, состоящее из двух частиц разных типов, живость которых известна. Затем используются правила.
В молекуле произведения витальности на количество частиц одного типа должны быть равны произведениям валентности на количество частиц другого типа.
Число, предшествующее типу уравнения реакции, называется коэффициентом. Он указывает на количество молекул или число молекул вещества.
Коэффициент перед химическим символом указывает на количество индивидов конкретного химического вещества; если символ является простым типом вещества, коэффициент указывает на количество индивидов или количество молекул этого вещества.
- 3 Fe – три атома железа, 3 моль атомов железа,
- 2 H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Подгруппа меди или кислорода является элементом шестой группы (VIA) главной подгруппы. Отдельные из этих элементов лишены двух электронов для завершения внешнего электронного уровня и поэтому обладают сильными окислительными (неметаллическими) свойствами. Однако при переходе от кислорода к полонию они исчезают.
Структура Периодической системы элементов
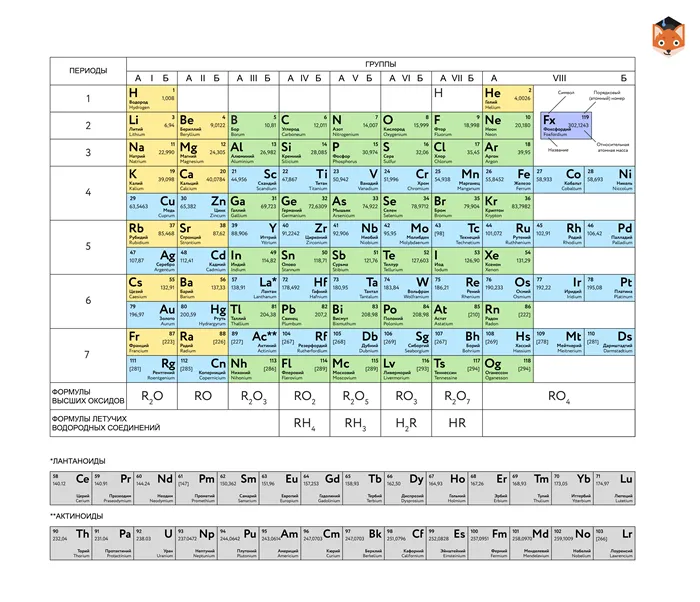
Периодическая таблица Менделеева теперь содержит 118 химических веществ. Каждый из них занимает свою позицию в соответствии со своим индивидуальным номером. Это число указывает на количество протонов, которые содержит ядро элементарного человека, и количество электронов в окружающем его человеке. Каждый последующий элемент содержит больше протонов, чем предыдущий.
Период — это строка в таблице. В настоящее время их семь человек. Все элементы одного периода имеют одинаковое количество энергоэффективных электронов.
Группы — это колонки. Элементы с одинаковым количеством электронов на внешнем энергетическом уровне индивидуума сгруппированы в периодической таблице. В более короткой версии таблицы, используемой в школьных учебниках, данные разделены на восемь групп. Каждая из них делится на одну основную (a) и одну подгруппу (b). Это элементы с похожими химическими свойствами.
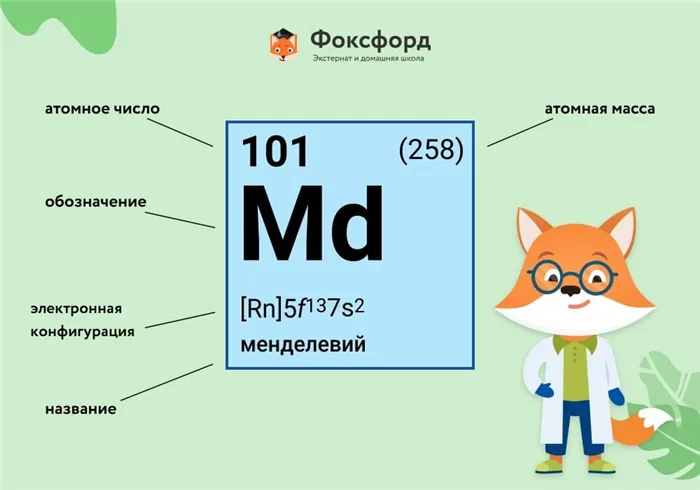
Каждый предмет обозначается одной или двумя латинскими буквами. Порядковый номер элемента (количество протонов в ядре) обычно указывается в левом верхнем углу. Клетка элемента также показывает его относительную индивидуальную массу (сумма масс протона и нейтрона). Это среднее значение, расчет, в котором используются индивидуальные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно это дробное число.
Чтобы найти число нейтронов в ядре элемента, отнимите номер класса от относительной индивидуальной массы (массового числа).
Свойства Периодической системы элементов
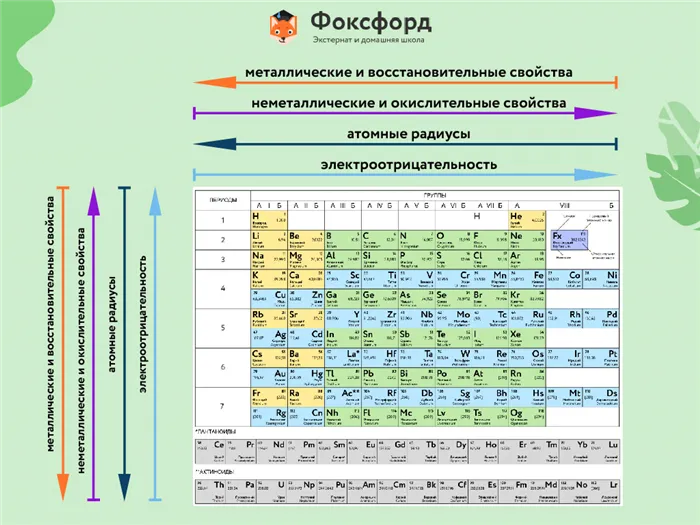
Химическая схема таблицы Менделеева позволяет учитывать не только индивидуальные массы, но и химические свойства.
Их изменение в группе (сверху вниз) происходит следующим образом
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В течение определенного периода времени (слева направо) свойства элемента изменяются следующим образом
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению определенных элементов можно определить, относятся ли они к металлу или неметаллу. Металлы расположены в левом нижнем углу таблицы, а неметаллы — в правом верхнем. До этого момента существует полу-семи-семи-ин. все периоды, кроме первого, начинаются со щелочных металлов. Каждый период заканчивается инертным газом.
Щелочные металлы

Первая основная подгруппа (k) данных — щелочные металлы. Это серебристые вещества (кроме цезуры, которая является золотом) и достаточно мягкие, чтобы их можно было резать ножом. Они могут очень легко вступать в реакцию, потому что у них есть только один неподатливый внешний электрон. Щелочные металлы имеют меньшую плотность, чем вода, поэтому они не тонут в воде, но бурно образуют щелочи и водород. Реакция настолько бурная, что водород может даже загореться или взорваться. Эти металлы очень сильно реагируют с кислородом воздуха, который необходимо хранить под слоем парафина (а литий — под слоем вазелина).
Посетите онлайн-учебник Фоксфорда по химии! Используйте промокод Chemistry892021 для бесплатного недельного доступа к 8-му и 9-му курсам химии.
Щелочноземельные металлы

Вторая основная подгруппа (IIA) представлена щелочноземельными металлами, которые имеют два электрона на внешнем энергетическом уровне атома. Бериллий и магний часто не считаются щелочноземельными металлами. Бериллий и магний также серебристые и легко реагируют с другими элементами, но не так легко, как металлы первой группы основных подгрупп. Щелочноземельные металлы имеют более высокие температуры плавления, чем щелочные металлы. Ионы магния и кальция делают воду более жесткой.
Лантаноиды и актиноиды
В третьей группе шестой и седьмой подгрупп (IIIB) есть несколько металлов с похожими структурами, похожими уровнями внешней энергии и похожими химическими свойствами. Электроны этих элементов начинают заполнять предпоследний слой внешней электронной оболочки. Это лантаниды и радиоактивные животные. Для удобства они размещаются под главным столом.

Лантаниды иногда называют «редкоземельными элементами», поскольку они встречаются в небольших количествах в редкоземельных минералах и не образуют собственной руды.
У киви есть одно общее важное свойство. Это радиоактивный распад. За исключением урана, все они редко встречаются в природе и синтезируются искусственно.
Переходные металлы
Типы сложных веществ создаются путем записи химических веществ, из которых состоит вещество, с указанием количества человек каждого элемента в молекуле. Как правило, химические вещества записываются в ряд по возрастанию числа электронов в соответствии со следующим практическим порядком.
Химическая формула в химии — виды записи и определение с примерами
Химические типы могут быть получены в результате различных химических экспериментов. Рассмотрим типы водородных соединений некоторых элементов (таблица 1).
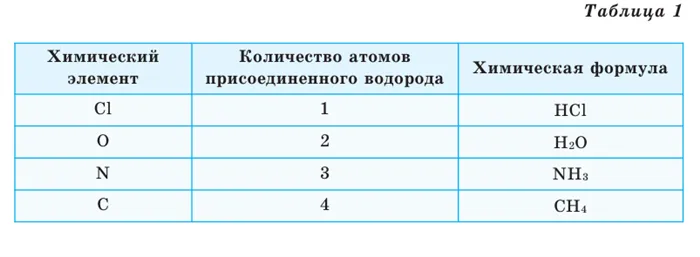
Из таблицы видно, что атомы хлора связаны с одним, атомы кислорода с двумя, атомы азота с тремя и атомы углерода с четырьмя атомами водорода. В результате химические элементы обладают различной способностью связывать с собой атомы водорода. Для описания этого факта используется термин «жизненная сила». Свойство атома химического элемента связывать ряд атомов других химических элементов называется его валентностью. Впервые понятие жизненной силы было введено английским ученым Э. Франклендом в 1852 году.

Английский химик. В 1852 году он ввел в науку понятие личной привязки. Это свойство человека позже назвали валентностью.
Кислород в угарном газе в ионе гидроксония I I I — валентным. А углерод бывает I I I — валентным только в угарном газе
Жизнеспособность выражается латинскими цифрами. Валентность водорода считается равной единице и сравнивается с валентностями других элементов.
Интенсивность конкретного химического элемента всегда остается одинаковой во всех соединениях. Другими словами, они всегда имеют одинаковое число. Это элементы постоянной жизненной силы (Таблица 2).

Однако разные группы элементов в разных соединениях имеют разную валентность. Элементы с переменной валентностью называются (Таблица 3).
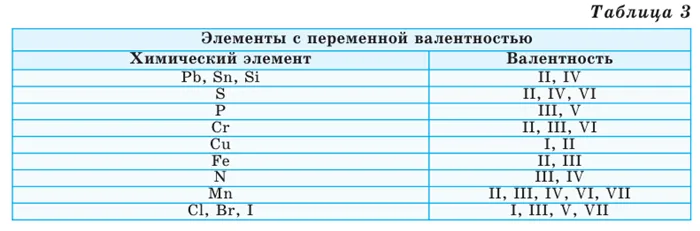
Зная силы химических элементов, легко составить типы бинарных (двухэлементных) соединений, образующихся из них. Для этого запишите химические символы элементов и поместите над ними их валентности. Затем определите наименьшее общее кратное для валентности этих элементов и разделите на их соответствующие валентности, чтобы найти их индексы. Например:.
1) Определим валентность атома алюминия по кислороду в химическом соединении

(2) Составьте химическую формулу соединения VII элементов — марганца и кислорода.
3) Если при построении типа, основанного на жизненной силе, полученный показатель сводится к минимальному целому числу, то в результате выполнения этого действия может получиться простой тип вещества (разделить VI и II на 2, 2, человек на человека — самый большой делитель). (происходят).
Химическая формула
Заполните таблицу. Как декларируется химический тип вещества?
Все вещества имеют химический тип. Символика синтеза вещества через его химические символы и индикаторы называется его хемотипом. Хемотип вещества указывает на его количественный и качественный состав. Качественный состав вещества показывает, из каких лиц состоят элементы, а количественный состав — его состав, то есть количество лиц элементов в молекуле. Число в правом нижнем углу символа предмета, указывающее на количество персон, называется индексом (см. рис. 1).
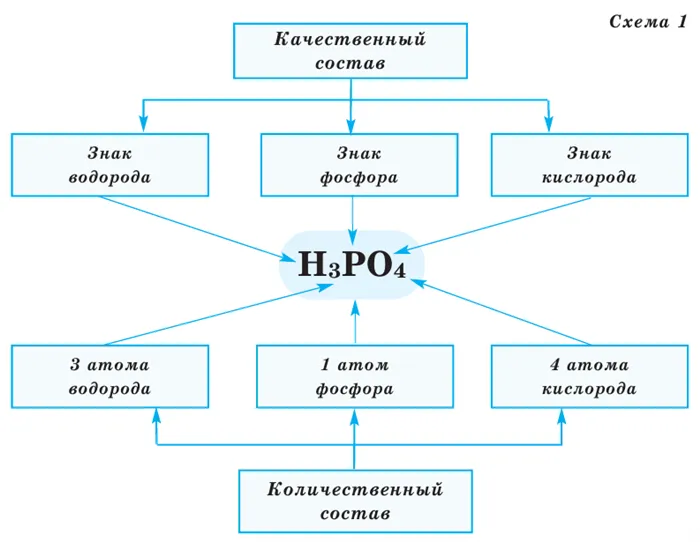
Число, стоящее перед химическим типом и химическим символом, называется фактором.
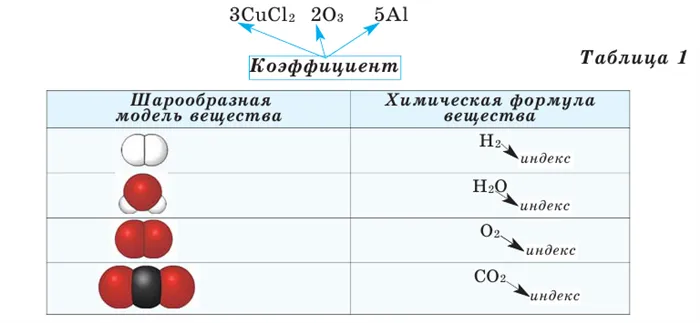
На основе модели химических типов водорода, кислорода, воды и углекислого газа, представленных в таблице 1, можно определить количество человек в их составе (таблица 2).

Краткое название химического вещества может быть использовано для чтения его типа.

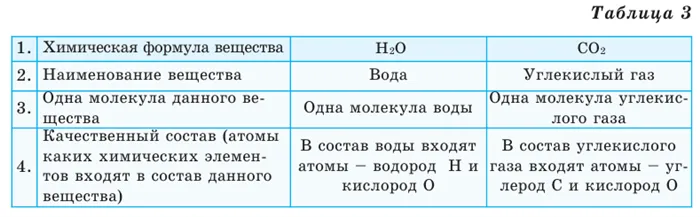
Выясните, можно ли получить информацию о веществе из его химической формулы (табл. 3).

Синтез вещества определяется различными естественными и химическими методами анализа результатов химических экспериментов. Например, в результате разложения воды под действием постоянной силы происходит двукратное превышение закона стабильности состава вещества. В настоящее время Закон о стабильности состава вещества гласит Независимо от способа получения, синтез и свойства молекулярно структурированных соединений всегда стабильны.

Французский химик. С 1799 по 1806 год он исследовал синтез различных оксидов, сульфидов и других веществ. В результате он открыл закон стабильности в синтезе химических веществ.
Этот закон стабильности и неизменности состава и свойств веществ с молекулярной структурой является одним из основных законов химии. Для большинства соединений с немолекулярной структурой закон композиционной стабильности не подходит.
Не все молекулярные структуры известны. Целые группы веществ имеют немолекулярные структуры. Как же синтезируются эти вещества? Химический тип немолекулярной структуры создается на основе количественного соотношения частиц элементов (индивидуальных или ионных) соединения. Для определения этого соотношения частицы элементов кристаллов немолекулярного вещества объединяют (комбинируют) с частицами элементов немолекулярного вещества, чтобы определить, сколько частиц других элементов их окружает. Изучение структуры кристаллов с помощью естественных методов дает такую информацию. Результаты данного исследования показывают, что в кварце количественное соотношение кремния (SI) и кислорода (O) составляет 1:2. Поэтому его тип может быть выражен следующим образом: и хлор
Начальные химические понятия и законы
Чтобы получить полное представление о размерах человека и его относительной и абсолютной массе, необходимо усвоить следующие основные понятия
Человек — это наименьшая химически неделимая частица материи.
Слово «атом» в переводе с древнегреческого языка означает ~ «неделимый».
Теперь показано, что человек состоит из множества мелких частиц.
Химический элемент — это тип какого-либо человека. Например, атом кислорода представляет собой элемент кислорода (Таблица 1).
Каждое химическое вещество обозначается символом — первой буквой его латинского названия или, при необходимости, первой и следующей буквой. Например, H (ASH) — химический символ водорода, от латинского hydrogen («образующий воду»).
Будучи маленькими частицами, люди имеют определенную массу. Например, абсолютная масса атома водорода составляет 0,00000000000000000000000000000000000000001674 г или 1,674- г.
Относительная масса человека — это количество раз, во сколько масса химического вещества больше массы человека, 1 а.е.м.
Относительная масса человека обозначается буквой AG, где G означает relative (относительная).
Количество вещества, которое численно равно относительной индивидуальной массе элемента, выражается в г молей (или молях).
Для одного моля вещества 6,02 называется постоянной Авогадро.
Индекс для определенных химических веществ.
19,993•
Абсолютная масса атома кислорода равна 2,667•
Решение. Единица массы 1 атома равна 1,66057•
Ответ:
Какой будет масса (г) 0,301 •
Решение. 6,02 •
6,02 — на 16 г атомов кислорода, 0,301 — кислород х.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например, он указывает, что молекула серной кислоты содержит два атома водорода, один серы и четыре атома кислорода, или один моль вещества.
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (
Один моль — это величина, выраженная в граммах и численно равная относительному молекулярному весу вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (
В 12 г углерода содержится 6,02•
Количество вещества обозначается буквой n, а его величина выражается в молях.
Молекулярная масса вещества обозначается буквой m и выражается в г/моль (Таблица 2). Таблица 2.
Индикаторы специфических химических веществ.
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 18 | 1 | 6,02• | |
| Углекислый газ | 44 | 1 | 6,02• | |
| Серная кислота | 98 | 1 | 6,02• |








