Многие металлы приобретают сверхпроводящие свойства при температуре жидкости. Если в металлическом кольце возбудить электрический ток, то подключенный к нему гальванометр будет показывать наличие электричества в течение очень долгого времени.
Характеристика главной жидкости на Земле: физические и химические свойства воды
Основным веществом, обеспечивающим жизнь на Земле, является вода. Это необходимо во всех штатах. Изучение свойств жидкостей привело к созданию целой науки — гидрологии. Предметом исследования большинства ученых являются природные и химические свойства воды. Под этими свойствами подразумеваются: критические температуры, кристаллические решетки, примеси и другие индивидуальные свойства соединений. ….
Типы воды известны всем студентам. Три простых пункта, но в нем содержится 75% общей массы всего, что есть на Земле.
H2O состоит из двух атомов водорода и одного атома кислорода. Структура молекулы является эмпирической, поэтому, несмотря на простой состав, свойства жидкости варьируются в широких пределах. Каждая молекула окружена соседними мориями. Они прикреплены к кристаллической решетке.
Простота структуры позволяет жидкостям существовать в различных кластерах. Ни одно другое вещество на Земле не может похвастаться этим. H2O очень подвижна, уступая только воздуху. Все знают о круговороте воды, и когда она испаряется с поверхности Земли, где-то вдали идет дождь или снег. Климат регулируется благодаря свойствам жидкости, которая может излучать тепло, сохраняя при этом одну и ту же температуру.
Физические свойства
H2O и ее свойства зависят от многих важных факторов. Основными из них являются: температура жидкости, температура снега и температура снега.
- Кристаллическая решетка. Строение воды, а точнее ее кристаллической решетки, обусловлено агрегатным состоянием. Она имеет рыхлое, но очень прочное строение. Снежинки показывают решетку в твердом состоянии, а вот в привычном – жидком, у воды нет четкости в строении кристаллов, они подвижны и изменчивы.
- Строение молекулы – шар. Но влияние земного притяжения заставляет воду принимать форму сосуда, в котором находится. В космосе она будет геометрически правильной формы.
- Реагирует вода с другими веществами, в том числе с теми, кто обладает неразделенными электронными парами, среди них спирт и аммиак.
- Обладает высокой теплоемкостью и теплопроводностью, быстро нагревается и долго не остывает.
- Еще со школы известно, что температура кипения 100 градусов Цельсия. В жидкости появляются кристаллы при понижении до +4 градусов, а вот лед образуется при еще большем снижении. Температура кипения зависит от давления, в которое поместить Н2О. Есть эксперимент, при котором температура химического соединения достигает 300 градусов, при этом жидкость не кипит, а плавит свинец.
- Еще одним важным свойством является поверхностное натяжение. Формула воды позволяет ему быть очень прочным. Ученые выяснили, чтобы разорвать его потребуется сила с массой больше 100 тонн.
Интересно! Незагрязненная H2O (дистиллированная) не может управлять током. Это свойство оксида водорода проявляется только при растворении солей.

Другие особенности
Лед — это уникальное состояние и характеристика оксида водорода. Он образует рыхлые соединения, которые легко деформируются. Кроме того, расстояние между частицами значительно увеличивается, в результате чего плотность льда становится намного меньше плотности жидкости. Это предотвращает полное замерзание водоемов зимой, позволяя поддерживать жизнь под слоем льда. Лед — это большой склад пресной воды.
Интересно! H2O имеет уникальное состояние, известное как явление тройной точки. Это когда одновременно существуют три ситуации. Такое состояние возможно только при температуре 0,01 град. Давление 610 Па.
Питьевая вода часто должна быть чистой, без запаха и не содержать болезнетворных бактерий. Природная вода, предназначенная для питьевых целей, поступает на станцию водоподготовки городской системы водоснабжения, где проходит через систему обработки (рис. 46). Сначала он проходит через металлический фильтр
Что реагирует с водой
Ключевые слова контура: вода, природные и химические свойства воды, водные растворы.
Чистая вода — это прозрачная жидкость без цвета, вкуса и запаха, с плотностью 1 кг/литр, температурой кипения 100°C и температурой плавления 0°C. Благодаря высокой специальной теплоемкости воды (4,12 кДж/кг/к), она долго нагревается и медленно охлаждается. Вода имеет высокую теплоту выхлопа. Для испарения 1 г воды требуется 2,25 кДж тепла.
Отдельные молекулы H и воды связаны между собой полярными связями. Атом водорода в H2его молекула O имеет небольшой положительный заряд d+, а кислород человека — небольшой отрицательный заряд Δ-. Молекула воды имеет угловую структуру и поэтому является биполярной диполярной молекулой.2 O.2 O.
Химические свойства воды
Вода вступает в реакцию со многими металлами в виде реакции замещения.
В наиболее активных металлах в диапазоне активности металлов при комнатной температуре, от Li до Al, происходят реакции замещения атомов H2 O. Для магния реакция происходит при нагревании. В случае алюминия это происходит после удаления защитной оксидной пленки. В результате реакции образуются гидроксиды металлов (соединения, содержащие гидроксигруппы OH и водород).
2Li + 2H2 O = 2LiOH + H2↑, Ca + 2H2 O = Ca(OH)2 +Н2↑.
Наименее активные металлы — Zn, Mo, W и Fe — взаимодействуют с водой при высоких температурах (400-600°C). В этих реакциях образуются оксиды металлов и водород.
Zn + H2 O = ZnO + H2↑, 3Fe + 4H2 O = Fe3 O4 + 4H2↑
Вода вступает в реакцию с активными оксидами металлов (реакция гидратации). В результате образуются растворимые в воде гидроксиды щелочных металлов.
Na2 O + H2 O = 2NaOH, CaO + H2 O = Ca(OH)2.
Вода соединяется с оксидами многих неметаллических элементов. В результате образуются водорастворимые неметаллические гидроксиды-кислоты.
CA O2 +Н2 O = H2C O3Итак.3 +Н2 O = H2Итак.4.
Гидролиз — это обратимая реакция обмена. воды и соли. В результате молекулы воды распадаются на H и OH, образуя два новых вещества.
К2C O3 +Н2 O = KNCO3 + KOH, PC l3 + CH2 O = H3RO3 + ZNSl.
Растворенные и попавшие в почву вещества, химически взаимодействуя с компонентами почвы и горных пород, активно участвуют в непрерывном процессе образования почвы и минералов, разрушения горных пород.
Типы химических реакций на примере свойств воды

Для упрощения темы и привлечения внимания учащихся приводится видеоролик, в котором на примере свойств воды рассматриваются все типы протекающих реакций. Анимации, изображающие реакции натрия, взаимодействующего с водой, интересны и увлекательны.
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам из комплекта, необходимо приобрести его в каталоге и добавить в личный кабинет.


Конспект урока «Типы химических реакций на примере свойств воды»
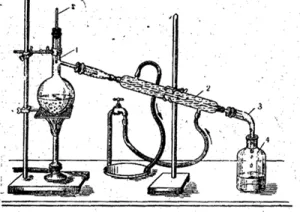
Для воды характерна реакция разложения, т.е. электролиз воды. Это происходит под действием электрического тока в специальном устройстве, называемом электролитом. Образуются два газа: кислород и водород
2H2Приблизительно 2 часа.2↑+О2↑
Растения также расщепляют воду в процессе фотосинтеза.
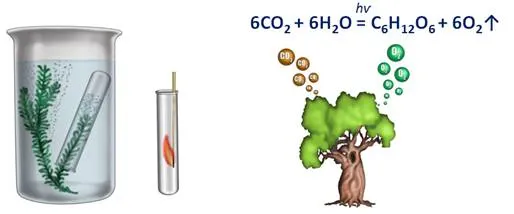
Когда ветви водного растения Elodea помещают в специальное устройство и подвергают воздействию яркого света, через 10-15 минут в результате разложения в воде выделяется кислород. Другими словами, происходит фотолиз воды (фото — свет, растворение — разложение). Образующийся водород вместе с углекислым газом в результате биохимических реакций образует глюкозу. Сумма всех этих реакций называется фотосинтетическим процессом. В результате фотосинтеза из углекислого газа и воды образуются глюкоза и кислород.
Для воды также характерны реакции сопряжения. Если положить несколько лаймов в фарфоровую чашку, а затем добавить небольшое количество воды, то по мере впитывания воды на чашке образуется пар. Таким образом, мы «стерли» известь водой. В результате этой реакции образуется новое вещество — известь.
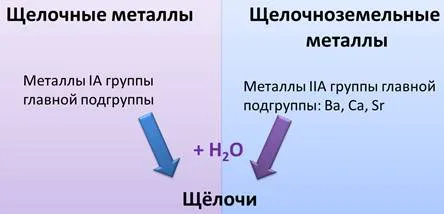
Оксиды металлов группы IA и металлов группы IIA: Ca, Ba и Sr образуют щелочи при реакции с водой. Поэтому основные металлы группы I A называются щелочными металлами, а металлы группы II A (такие как Ba, Ca и Sr) — щелочноземельными.
Когда оксиды неметаллов взаимодействуют с водой, образуются соответствующие кислоты, а неметаллы проявляют ту же степень окисления, что и оксиды. Например, в реакции оксида фосфора (V) образуется фосфорная кислота, где степень окисления фосфора также равна +5.
P2 O5 + 3 H2 O = 2 H3 PO4
Поэтому основания и кислоты на основе кислорода в химии называются гидроксидами.
Вода реагирует с оксидами металлов и неметаллов только при условии образования растворимых гидроксидов. Например, вода реагирует с оксидом калия с образованием растворимого основания — гидроксида калия, но вода не реагирует с оксидом меди (II), поскольку гидроксид меди (II) является нерастворимым основанием воды. Аналогично, ненейроксиды: вода реагирует с оксидом серы (VI) с образованием серной кислоты, но не с оксидом кремния (IV).
Реакции замещения происходят, когда щелочи или щелочные земли реагируют с водой. Когда натрий реагирует с водой, образуются щелочь и водород.
2 Na + 2 h2 o = 2 naoh + h2 ↑
Эту реакцию можно наблюдать в следующем эксперименте. Налейте воду в пластинку Петри и добавьте несколько капель фенола орбитального. Затем добавляется небольшой кусочек натрия. Кусочек натрия имеет округлую форму, так как он начинает плавиться под действием высокой температуры, и бежит по поверхности воды, так как выделяющийся водород выталкивает его, а раствор приобретает темно-малиновый цвет из-за образования щелочи.
Перекись водорода также используется для восстановления белых свинцовых таблиц, которые постепенно темнеют на воздухе, поскольку сероводород образует черный по цвету сернистый свинец. Перекись водорода окисляет сульфид серы таким же образом.
Вода в природе
Вода, по сути, очень распространена. Около 3/4 поверхности планеты занимает вода. Она включает океаны, моря, притоки пресной воды с суши, озера, сладкую и соленую воду, ледники, подземные воды и водяной пар. Они всегда имеются в больших или малых количествах в атмосфере и включают кристаллическую воду, которая является частью кристаллической воды.
Поскольку вода является хорошим растворителем, природные воды всегда содержат растворенные вещества. Морская вода растворяет различные соли, такие как хлорид натрия NaCl, сульфат магния4 и т.д., что придает ему горько-соленый вкус. Поступающие в породы подземные воды растворяют различные вещества, а растворы, которые выходят на поверхность, называются источниками металлов.
Особенно много источников металла на Кавказе. Вода из угольных фонтанов улучшает пищеварение и кровообращение. Углекислый газ растворяется в этих водах под давлением. Серные воды Матеасты и Пятигорска бывают холодными и теплыми и содержат сульфиды и сероводород.
Серные ванны снижают кровяное давление и улучшают работу сердца. Железноводские и липецкие железистые воды рекомендуются при малокровии. Кисловодский известняк используется при заболеваниях почек, а воды Забайкальского и Туркестанского источников в естественном виде — при общей слабости, нервных расстройствах и кожных заболеваниях.
Когда подземные воды находятся вблизи вулканических источников, они выходят наружу в виде тепла. Считается, что глубоко в земной коре находится большое количество горячей воды. Его можно использовать в качестве очень дешевого источника тепловой энергии.
С воды началась жизнь на Земле, какой мы ее знаем сейчас, она является средством водной жизни, но она необходима для всех живых организмов, которые не могут существовать без воды. Протоплазма каждой клетки представляет собой коллоидный раствор белка в воде. Человеческое тело на 65% состоит из воды.
Когда человеческий организм теряет 20% содержания воды, изменения, произошедшие в клетках, становятся необратимыми, и человек умирает. Человек может прожить 30-40 дней без пищи, но в течение 7 дней без воды. Жизнь растений также невозможна без воды. Вода является необходимым компонентом фотосинтеза в зеленых растениях.
Вопросы о воде в природе
- В какой состоянии и где вода встречается в природе? Запишите это в тетрада.
- Что представляют собой минеральные источники состав состав их воды, каково применение в медицине? (См. Ответ)
Химические свойства воды
Вода является индифферентным окислителем. Вода является очень слабым электролитом, разделенным узорами.
Некоторые из наиболее активных металлов (Na, K, Ca, Ba, Al) могут замещать водород из воды.
2Na + 2H + + + 2OH- = 2Na + + + 2OH- + H2↑
Когда железо нагревается, оно разлагает воду и выделяет водород, образуя соли.
Перегретый пар
Элементы с более сильными окислительными свойствами, чем кислород, например, хлор, вытесняют кислород из воды: например.
Cl 02 + H2O -2 = 2HCl -1 + O 0
Нагретый древесный уголь разлагает воду с образованием газообразной воды. По сути, это смесь водорода и угарного газа.
Вода может реагировать с основными и кислотными оксидами, образуя основания и кислоты. Тепло растворяется в воде едкими щелочами и серной кислотой.
Вода может реагировать с солями, образуя кристаллические гидриды. Например, синий сульфат меди является продуктом соединения белого сульфата меди и воды, в соответствии со следующей формулой
Вода является химически очень стабильным веществом, но может разлагаться под воздействием электричества.
Вода активно реагирует со сложными неорганическими и органическими веществами в реакциях гидролиза.
Вопросы по химическим свойствам воды
- Почему воду относят к числу безразличных окислов? (См. Ответ)
- Вполне ли правильно выражение «натрий растворяется в воде»?
- Напишите уравнения реакций взаимодействия с водой основных и кислотных окислов. С какими из них вода не реагирует?
- Для какой дели воду подвергают электролизу?
- Вода реагирует с солями с образованием кристаллогидратов. Напишите уравнение реакции образования кристаллогидрата. Какого иного характера взаимодействие возможно между водой и солями?
- В сосуд с 200 г воды поместили 9,2 г натрия. Какое вещество при этом образовалось? Растворимо ли оно? Если растворимо, то какова его процентная концентрация в полученном растворе?
- К 50 г 30% серной кислоты добавили 5 г серного ангидрида. Какой стала концентрация серной кислоты?
- Среди перечисленных в свойств воды укажите те, которые можно использовать для получения водорода.
- Какой объем водорода может быть получен при взаимодействии 5 кг железа с перегретым паром, если 10% веса железа прихо дится на окалину, а 20% полученного водорода теряются?
- Сколько окиси меди можно восстановить водородом, полученным в предыдущей задаче? (См. Ответ)
Вода, которая является частью кристалла, называется кристаллической водой. Он химически связан с веществом, придавая ему свойства, соответствующие кристаллам. Например, сульфат меди CuSO4-5H2O в виде кристаллогидрата, содержащего пять молекул воды, имеет ярко-синий цвет и не воспламеняется при удалении кристаллической воды.
Природный гипс CaSO4-2H2O слегка нагревается, удаляя молекулы воды, образуя соединение 2CaSO4-H2O, называемое полугидратным гипсом. Этот гипс обладает способностью «затягиваться». То есть при смешивании с водой он связывается с недостающими в себе молекулами воды и затвердевает, образуя двухводную штукатурку с составом CaSO4-2H2O.
Что такое кристаллогидраты
Кристаллогидраты — это соединения соли и воды. Они считаются сложными соединениями. Можно упомянуть многие другие кристаллогидраты, например, соли Глаубера
Na2SO4-10H2O, сульфат железа FeSO4-7H2O и др.
- Сколько нужно взять воды и кристаллогидрата Na2SO4 · 10H2O, чтобы приготовить 200 г 3% раствора сульфата натрия? (См. Ответ)
- В лаборатории для абсолютирования спирта применяют безводный сульфат меди, с которым кипятят спирт, пока сульфат меди не приобретет голубую окраску. Какая реакция происходит При этом? Насколько увеличится вес 25 г сульфата меди, если считать, что 75% сульфата превратилось в медный купорос?
- Сколько процентов воды содержалось в спирте, если абсолютированию подверглось 150 г спирта. 20 a FеSО4 · 7H2O растворили 180 г воды. Какова концентрация полученного раствора?
- Что такое двуводный гипс, полуводный гипс? Какое применение они находят в медицине? Какая вода называется кристаллизационной? (См. Ответ)








