Хлориды в растворе относительно хороши (проводимость при 800°C составляет LICL -2,17 -NACL -3,57 -êñ² -2,20 OHM -1 -C -1).
Что реагирует с хлором
Хлор (хлор — зеленый) является элементом главной подгруппы 7 группы 3 периода периодической таблицы Д.И. Менделеева, атомный номер 17. является химически активным неметаллом. Он относится к группе галогенов (первоначально название «галоген» было использовано для хлора немецким химиком Швайгером, а дословно «галоген» переводилось как водород, но без укоренения и стало общим для VII группы элементов, содержащих хлор).
Простые хлорные вещества (CAS No: 7782-50-5) обычно представляют собой желто-зеленые токсичные газы с сильным запахом. Хлор представляет собой двухатомную молекулу (тип Cl2 ).
Хлор впервые был обнаружен в 1772 году Шиле. Шиле описал разделение из-за взаимодействия пожарных и соляной кислоты в бумагах Пиритиса.
Шиле отметил запах хлора, похожий на запах царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако, согласно теории Флостро в то время, Шееле предположил, что хлор выделяет соляную кислоту, или оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мури, но их попытки разделения не увенчались успехом, поскольку поваренная соль может быть разложена на натрий, который затем может быть разложен на хлор путем электролиза.
Распространение в природе
Два изотопа хлора, 35 Cl и 37 Cl, вступают в естественные реакции. Хлор — самый распространенный галоген в земной коре. Хлор высокоактивен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в основном он появляется только в виде минеральных соединений: галогенит Naci, сильвинит KCL, сильвинит KCL -NaCl.2 -6H2O, KCL Carnival-MGCL2 -6.2O, KINITE KCL -MGSO4 -3 Nation.2O. Большие запасы хлора содержатся в соли океанов и морской воде.
Хлор составляет 0,025% от общего количества коры Земли, кларковое число хлора — 0,19%, а человеческое тело содержит 0,25% ионов хлора по весу. В организме человека и животных хлор содержится в основном в межклеточной жидкости (включая кровь) и играет важную роль в регуляции осмотических процессов и в процессах, связанных с функцией нейронов.
Изотопный состав
В природе существуют два постоянных изотопа хлора. 35 и 37 по массовому числу. Соответствующие фракции составляют 75,78% и 24,22%.
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35 Cl | 34.968852721 | Стабилен | — | 3/2 |
| 36 Cl | 35.9683069 | 301000 лет | β-распад в 36 Ar | 0 |
| 37 Cl | 36.96590262 | Стабилен | — | 3/2 |
| 38 Cl | 37.9680106 | 37,2 минуты | β-распад в 38 Ar | 2 |
| 39 Cl | 38.968009 | 55,6 минуты | β-распад в 39 Ar | 3/2 |
| 40 Cl | 39.97042 | 1,38 минуты | β-распад в 40 Ar | 2 |
| 41 Cl | 40.9707 | 34 c | β-распад в 41 Ar | |
| 42 Cl | 41.9732 | 46,8 c | β-распад в 42 Ar | |
| 43 Cl | 42.9742 | 3,3 c | β-распад в 43 Ar |
Хлор обычно важен в ионной форме как неорганический элемент. Он потребляется в пищу в основном в виде поваренной соли (хлорида натрия). Один человек ежедневно потребляет от 3 до 12 граммов соли. Он выводится через почки и пот.
Галогены
Галогены (греч. halus — соль + gene — рост) — химические элементы группы VIIA: F, Cl, Br, I, at. Реагируют с большинством других элементов и органических соединений.
Галогены широко распространены в природе. Их химическая активность снижается от фтора до омара.

Общие свойства элементов группы VIIA.
От F к (к вершине периодической таблицы) AT увеличивается индивидуальный радиус, металлические, основные и восстановительные свойства. Электроны, энергия ионизации и сродство к электрону уменьшаются.
Все галогены являются неметаллическими и сильными средствами окисления.
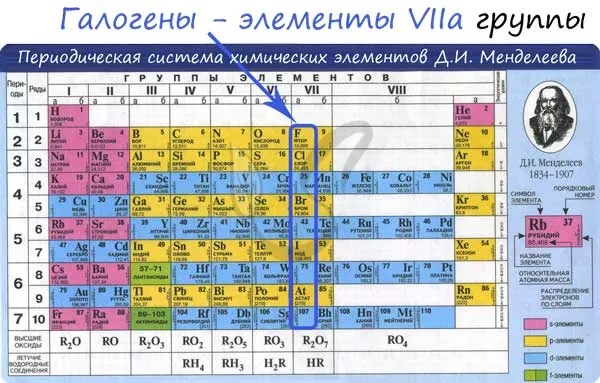
- F — 2s 2 2p 5
- Cl — 3s 2 3p 5
- Br — 4s 2 4p 5
- I — 5s 2 5p 5
- At — 6s 2 6p 5
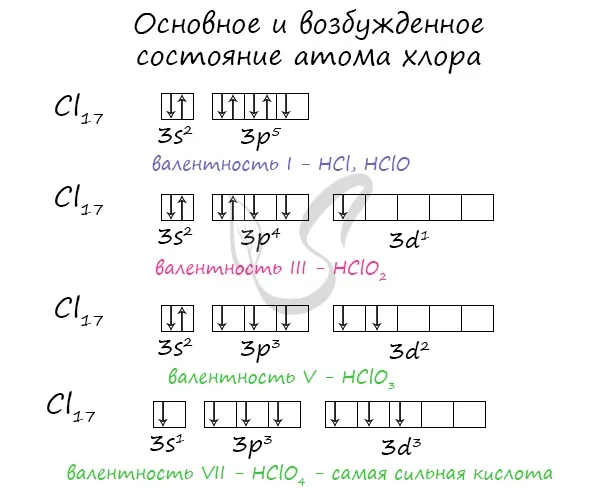
Галогены характеризуются нежелательными степенями окисления -1, +1, +3, +5 и +7: +7. Это связано с электронным составом человека в стимулированном состоянии.
Естественная ассоциация.
- NaCl — галит (каменная соль)
- CaF2 — флюорит, плавиковый шпат
- NaCl*KCl — сильвинит
- 3Ca3(PO4)2*CAF.2 — фторапатит
- MgCl2*6H2O — бишофит
- KCl*MgCl2*6H2O — карналлит

Простое вещество-F2, кл2, b2, I2
Конину в чистом виде получают путем электролиза водных растворов и плавления солей. Например, промышленный хлор получают путем электролиза растворов хлорида натрия.
При электролизе растворенного калия KHF2 С помощью безводной плавиковой кислоты — HF — впервые был получен фтор.
Наиболее активный галоген может заменить наименее активный. Активность галогенов уменьшается: от F к Cl к Br к I.

В лабораторных условиях галогены могут быть получены в следующих реакциях
Высокая реакционная способность является характерной чертой галогенов. Фториды реагируют со всеми металлами, а некоторые из них спонтанно сгорают в атмосфере фторидов.
Как и фтор, хлор химически очень активен. Он не реагирует с кислородом, азотом и благородными веществами.

f2 + h2 → HF (взрыв в темноте).
Галогены реагируют друг с другом. Определяет степень.
b2 + f2 → BRF (фтор более электроотрицателен, чем бром — F-)
b2 + i2 → IB3 (Бром более электроотрицателен, чем йод — BR-)
Реакция между фтором и водой является особенно активной и взрывоопасной.
Хлор реагирует с инвертной водой, образуя хлоридную воду — смесь хлорноватистой и соляной кислот. Бром участвует в той же реакции, что и хлор.

В тексте говорится о признанных на территории Российской Федерации организациях террористами и/или о том, что суды вынесли решения, вступившие в законную силу. К ним относятся:.
Хлор в химии — классификация, получение, свойства, формулы и определения с примерами
Химические вещества с самыми сильными неметаллическими свойствами в системном журнале относятся к группе VIIA: фторид F, хлор CL, бром BR, йод I и очень редкий ATAT ATAT. Эти элементы называются галогенами.
Наиболее распространенным в природе галогеном является хлор. Его массовая доля в земной коре составляет около 0,2 % — 11-е место по распространенности среди всех элементов. Широко распространены минералы и горные породы, содержащие хлориды, — соли соляной кислоты: галит (каменная или поваренная соль ) NaCl, сильвин KCl, карналлит

Хлор является одним из химических веществ, необходимых для существования всех живых организмов. Хлор и ионы натрия и калия регулируют водно-солевой обмен в организме человека. Хлор участвует в энергетическом обмене растений и оказывает положительное влияние на поглощение кислорода, а также соединений калия, кальция и магния корнями.
Атомы хлора имеют семь электронов во внешнем (неполном) электронном слое, поэтому этот элемент относится к неметаллам. Максимальная положительная степень окисления хлора +7, а его высший тип оксида
Хлор фактически важнее галогенов и применяется для отбеливания тканей и бумаги, дезинфекции питьевой воды, производства соляной кислоты, органических композиций, получения и удаления многих металлов хлорметаллургическим методом.
Мокрицу также используют в качестве отбеливающего и дезинфицирующего средства, хлорируют в согласии с пиротехникой, а суперкарфин применяют в качестве твердого рекламного ингредиента.
Хлор в небольших количествах может лечить респираторные заболевания, поскольку он имеет бактериальную природу. Благодаря своему дезинфицирующему действию хлор используется для обеззараживания гидрогенизированной воды.
Он используется для превращения водопроводной воды в соли хлора. В промышленности его используют для получения синтетической соляной кислоты, отбеливателей и получения солей, извлечения ценных минералов из руд и в реакциях органического состава.
Хлорид натрия является необходимым веществом для человеческого тела и организмов. Это соединение играет важную роль в нарушении или снижении активности хлорида натрия в организме.
Хлор свойства
Хлорный газ имеет желто-зеленый цвет. Она токсична, резка, бура и имеет неприятный запах. Хлор тяжелее воздуха и относительно хорошо растворяется в воде (2 к 1 объему воды), образуя хлоридную воду.2AQI переходит в жидкое состояние при температуре -34°C и застывает при температуре -101°C. Его плотность составляет 1,568 г/см³.
Галоген в качестве соли является важным фактором. Хлор поваренной соли используется в пищевых продуктах и входит в состав зеленого вещества растений — хлорофилла. Хлор реагирует с водородом при взрыве, но только на свету.
Когда струя водорода воспламеняется в атмосфере хлора, она горит бесцветным пламенем.
Многие металлы горят при контакте с хлором. Сурьма самовосстанавливается, в то время как другие металлы при нагревании реагируют с хлором.
Это является основой для увеличения доли драгоценных металлов в сплавах с низкой пробой. Для этого проталкиваемый материал нагревается в присутствии потока свободного хлора.
Там, где металлы могут иметь различные степени окисления, реакции с хлором проявляются наилучшим образом.
Железо реагирует с хлором до степени окисления, равной +3 -fe⁺, в то время как медь реагирует до + 2 -cu⁺. Хлор действует как окислитель во всех вышеперечисленных случаях.
Открытие хлора
Газ хлористый водород, соединение с водородом, был впервые получен Джозефом Пристли в 1772 году. Хлор был получен шведским химиком Карлом Вильгельмом Шиле в 1774 году.
Шиле отметил запах хлора, похожий на запах царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако, согласно тогдашним теориям пламени, Шиле предположил, что хлор был добыт мурджи (соляной кислотой).
Бертолле и Лавуазье обосновали новое вещество как оксид гипотетического элемента мури в контексте кислородной теории кислот.
Однако его изолированные усилия остались успешными, как и работа Г. Дейви, который смог продемонстрировать главную природу последнего, разложив поваренную соль на натрий и хлор путем электролиза.
1811. Дейви предложил название «Хлор» для нового предмета. Год спустя Ж. Гей-Люссак сократил название хлора (Chlore). В 1811 году немецкий физик Иоганн Швайгер предложил для хлора название «галоген» (буквально — хлор), но последняя часть термина была установлена для всей 17-й (VIIA) группы элементов, содержащих хлор.
В 1826 году атомный вес хлора был очень точно определен шведским химиком Йонсом Якобом Берцелиусом (в отличие от последних данных, которые составляют менее 0,1%).
Во время Первой мировой войны хлор CL использовался в качестве боевого отравляющего вещества, поскольку он тяжелее воздуха и легко захватывается на земле. Максимально допустимая концентрация свободного хлора в воздухе составляет 0,001 мг/л.
Хроническое отравление хлором вызывает обесцвечивание кожи, заболевания легких и бронхов. В случаях отравления хлором в качестве антидота следует использовать эфир смеси паров спирта или смеси паров аммиака.
Хлор — это острый, удушливо пахнущий, неметаллический, тяжелый желто-зеленый газ. При вдыхании он сильно раздражает слизистые оболочки и может вызвать сильный кашель и даже массовую смерть.
Физические свойства
При нормальных условиях хлор представляет собой газ. Он имеет едкий, резкий запах и классифицируется как токсичный. Хлор относительно растворим в воде: 0,0921 молекул на литр при 25 C при нормальном атмосферном давлении.
Этот раствор хлора называется хлористым водородом и содержит небольшое количество соляной кислоты.
Химические свойства
Хлор не горит на воздухе, но является одним из самых активных элементов в периодической таблице. Он реагирует со многими элементами и многими органическими и неорганическими соединениями даже при нормальной температуре.
Реакции хлора
Помимо фтора, хлор является одним из самых активных элементов. Он является мощным окислительным фактором. Даже при комнатной температуре хлор вступает в реакции со многими элементами и выделяет большое количество тепла (экзотермические реакции). Он образует ионные соединения и соли металлов в зависимости от щелочей, щелочных земель и других металлов.
Неметаллы, такие как водород и фосфор, и полусемейные проводники, такие как бор и кремний, реагируют с хлором, образуя молекулярные соединения. Хлор является очень активным элементом и поэтому часто встречается в природе. Огромные соляные месторождения содержат в основном минеральную каменную соль (NaCl), сильвин (KCL) или сильвинит. Поскольку морская вода состоит в основном из хлористых солей, количество растворенного хлора, растворенного в Мировом океане, практически неизмеримо.
Изотопы
Природный хлор представляет собой смесь двух постоянных изотопов: 35Cl и 37 Cl.
В атмосфере также происходит взаимодействие между изотопами хлора и протонами космического излучения с образованием нестабильного изотопа36 Cl. Большое количество этого изотопа было получено во время атмосферных испытаний ядерного оружия в период с 1952 по 1958 год.
Хлор фактически важнее галогенов и применяется для отбеливания тканей и бумаги, дезинфекции питьевой воды, производства соляной кислоты, органических композиций, получения и удаления многих металлов хлорметаллургическим методом.
2. Реакции с неметаллами .
Окислительную способность галогенов можно сравнить с их реакциями с неметаллическими элементами. Всадники реагируют со многими неметаллами (исключение составляют аристократы, азот n2и кислород o2).

Всадники реагируют с водородом, и состояние реакции зависит от того, какой галоген вступает в реакцию.
В случае фторидов реакции могут начаться даже при T° = -250°C, при горении хлора в хлораторе или даже при легкой комнатной температуре. Для брома и йода реакция происходит при температуре 350-500°C. Реакция йодистого водорода HI является обратимой. Таким образом, по мере увеличения относительной молекулярной массы галогена от фторида F2 с йодом I.2 условия реакции должны быть более строгими.
Галогены реагируют с серой. Фтор взаимодействует с серой даже при температуре жидкого воздуха, окисляя её до высшей степени окисления:
Реакция серы с хлором приводит к образованию либо SCl2Либо с2cl2:
Примечание: Здесь происходит относительно редкое окисление +2 до серы.
Бог не вступает в реакцию с йодом.. Более глубокое окисление серы во время фторидных реакций указывает на самую высокую окислительную способность фтора.
Галогены реагируют с фосфором. Красный и белый фосфор уже при комнатной температуре самовоспламеняется во фторе и хлоре, реагирует с жидким бромом. При этом в реакции со фтором происходит более глубокое окисление фосфора:
При реакции фосфора с хлором и бромом может образоваться PCCL3 и PBG3образуются, но с повышением температуры глубина окисления увеличивается фосфором — PCCl5 и PBG5.
Фтор реагирует с графитом при температуре выше 900 °С:
Другие галогены не реагируют с простыми углеродообразующими веществами (алмаз, тонер).
3. Реакции с водой .
Рассмотрим реакции галогенов со сложными веществами. Галогены взаимодействуют с водой. При этом фтор окисляет кислород воды. Пары воды горят в атмосфере F2:
Хлор обратимо реагирует с водой, но при этом не происходит окисление кислорода. В этой реакции хлор сам является как окислителем, так и восстановителем (такие реакции называют реакциями диспропорционирования ):
4. Реакции со щелочами .

Хлор, бром и йод реагируют со щелочами, при этом хлор в ходе реакции является как окислителем, так и восстановителем.
Галогены вытесняют друг друга из галогенов и галогенированных углеводородов. Фторид f2 Все остальные галогены вытесняются из галогенов и галогенидов (в растворе реакции окисления происходят параллельно). Хлор f2 Вытесняет бром и йод из HBG, грязи, HI и йода. Бром БГ.2 Вытесняет йод из йода и йодистого водорода. Йод I2 Не вытесняет других лошадей:.
Признаком этой реакции на раствор является изменение цвета от бесцветного до желтого.



Курс химии «Химические свойства галогенов». Выберите дальнейшие действия.








