Фосфин образуется при разложении белковых тел, и этот газ обладает мигающим светом, который пугает прохожих на кладбищах. Это означает, что, как и азот, фосфор является биоатомом. Биологические свойства соединений фосфора объясняются ниже.
Фосфор
Фосфор (греч. light — свет + body — тело) — это химический элемент, относящийся к группе VA и находящийся в третьем периоде. Это простое желтоватое вещество, легко воспламеняющееся и яркое.

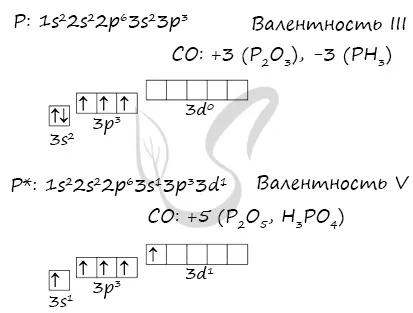
Основные и стимулированные состояния фосфора
При возбуждении атома фосфора электроны в S-такте испаряются и переходят в D-тело.
Природные ассоциации

В промышленности фосфор производится путем сплавления фосфата кальция, песка и углерода.
Химическая активность фосфора намного выше, чем у азота. Эта активность также определяется гомологичной модификацией. Белый фосфор является наиболее активным и светящимся фотофором за счет окисления кислородом.
Во влажной и газообразной форме при температуре до 800°C фосфор состоит из p4. Выше 800°C, p4 молекулы разлагаются на p2.
В неметаллах фосфор часто действует как восстановитель и как окислитель. Он легко окисляется кислородом.
Фосфор и хлор реагируют аналогичным образом.
2p + 3cl2 →2PCL3 (Дефицит хлора)
2р + 5кл2 →2PCL5 (Очень хлорированный)
Реакции с водородом очень сложны. Однако при разложении фосфидов металлов могут образовываться токсичные газы, фосфин, который является боевым отравляющим веществом.

2p + 3CA → CA3p2 (фосфид кальция)
Фосфор реагирует с водой в реакции дисбаланса (термин, используемый для описания реакции, в которой вещество одновременно является окислителем и восстановителем).
При добавлении фосфора в щелочной раствор также происходит реакция несогласия.
Когда спичка зажигается, происходит реакция между фосфором, действующим как окислитель, и вертикальной солью.

Оксид фосфора V -p2o5
Кислотные оксиды, где пар имеет тип p4o10. Твердые оксиды характеризуются белым цветом.
Он положительно реагирует с водой, образуя фосфатную воду. При недостатке воды образуется метафосфат. o
Реагирует с основаниями с образованием основных оксидов и фосфатов. Какая соль образуется, зависит от соотношения основного оксида/основания и окисляемой кислоты.
6 кОм + p2o5 = 2K3по4 + 3H2O (фосфат калия, избыток щелочи — соотношение 6:1)
4 кОм + p2o5 = 2K2HPO4 + h2O (кислый калий, небольшой избыток оксида кислоты — соотношение 4:1)
2кОм + p2o5 = 2kh2по4 + h2O (дигидрофосфат калия, избыток оксида — соотношение 2:1)

Происходит сильное выделение воды (дегидратация): вода легко извлекается из других соединений.
Фосфат
- Ортофосфорная кислота — H3по4 (трибациловая кислота, соль — фосфат по4 3- )
- Метафосфорная кислота — HPO3 (мономасляная кислота, соль — модифицированная соль PO3 — )
- Фосфористая — H3по3 (две основные кислоты, соль — фосфор HPO)3 2- )
- Фосфорноватистая — H3по2 (мономасляная кислота, соль — низкофосфорный цетель -h)2по2 — )
Реагирует с основаниями с образованием основных оксидов и фосфатов. Какая соль образуется, зависит от соотношения основного оксида/основания и окисляемой кислоты.
Шкала степеней окисления фосфора:

Электронов фосфора (2,32) намного меньше, чем у типичных неметаллических элементов, и немного больше, чем у водорода. Он образует различные кислоты, включая кислородную, соли и бинарные соединения, и проявляет неметаллические (кислотные) свойства. Большинство фосфатов нерастворимы в воде.
В природе существует 13-й более распространенный элемент (6-й среди неметаллических элементов). Встречается только в химически связанных формах. Важные элементы.
Недостаток фосфора может быть компенсирован в основном добавлением высокофосфатных удобрений.
Аллотропные модификации фосфора
Красный и белый фосфор p. Известны различные свободные гомологичные формы фосфора, основными из которых являются белый фосфор p4 и красный фосфор pn. В уравнениях реакций гомологичные формы представлены как p (красный) и p (белый).
Красный фосфор состоит из полимерных молекул pn разной длины. Аморфный, медленно превращается в белый фосфор при комнатной температуре. Испаряется при нагревании до 416°C (белый фосфор конденсируется при охлаждении паров). Нерастворим в органических растворителях. Химическая активность ниже, чем у белого фосфора. При нагревании воспламеняется только с воздухом.
Используется в качестве реагента неорганического состава (безопаснее белого фосфора), как компонент наполнителя коробок при производстве спичек и как наполнитель в лампах накаливания. Он не является токсичным.
Белый фосфор — это PMIA p4. Он мягкий, как свеча (можно разрезать ножом). Он плавится и кипит без разложения (tМел. 44.14°C, tТемпература кипения. 287,3°C, p 1,82 г/см3). Окисляется на воздухе (зеленое свечение в темноте), высокая масса, может быть самовоспламеняющимся. В особых условиях он преобразуется в красный фосфор. Он хорошо растворим в бензоле, эфирах и двухуглеродных дисульфидах. Хранится под слоем воды, а не вступает в реакцию с водой. Очень реактивный. Обладает окислительно-восстановительными свойствами. Извлекает драгоценные металлы из солевых растворов.
Используется в производстве h3 свиньи.4 И красный фосфор, как реагент в органической композиции, плотность аллоксида, сжигание cen агента. Горящий фосфор необходимо тушить песком (но не водой!).. Очень токсичен.
Уравнения важнейших реакций фосфора: 
— Восстановление флюорита раскаленным колом (для связывания кальция добавляется песок):.
ок.3 (PO4)2 + 5C + 3SIO2 = 3CASIO3 + 2 P + 5CO (1000°C).
Пары фосфора охлаждаются и превращаются в твердый белый фосфор.
Красный фосфор получают из белого фосфора, в зависимости от условий степени полимеризации n (p) (см. выше)n ) Оно может варьироваться.
В 1669 году Хеннингбранд нагрел смесь белого песка и испарившейся мочи, чтобы получить вещество, светящееся в темноте, которое первоначально называли «холодным огнем». Вторичное название «фосфор» происходит от греческого слова «фос», от греческого слова «феро», означающего «несущий». В греческой мифологии название Фосфор (или Эфес, греч. Фосфор) возникло благодаря стражу Утренней звезды.
Химические свойства
Химическая активность фосфора намного выше, чем у азота. Химические свойства фосфора в значительной степени определяются его гомологичными модификациями. Белый фосфор очень активен — при переходе к красному и черному фосфору его химическая активность быстро снижается. Белый фосфор светится в темноте на воздухе. Блеск обусловлен окислением паров фосфора в низких оксидах.
Во влажном растворенном состоянии и в парах при температуре до 800°C фосфор состоит из p4. При нагревании выше 800°C молекула разлагается: p4 =2р2. При температуре выше 2000°C молекула разлагается на отдельные части.
Взаимодействие с простыми веществами
- 4P + 5O2 →2P2o5 (с избытком кислорода),
- 4P + 3O2 →2P2o3 (при медленном окислении или при недостатке кислорода).
Взаимодействует со многими простыми веществами, такими как галогены, сера, некоторые металлы, проявляя окислительные и восстановительные свойства.
Уменьшается неметаллами:.
Взаимодействие с водой
Взаимодействует с водой, что непропорционально: o
Взаимодействие со щелочами
Перераспределение происходит в значительной степени в щелочных растворах.
Восстановительные свойства
Сильные окислители превращают фосфор в фосфат:.
Реакции окисления также происходят при включении спички: окислительная среда апексной соли.
Применение
Фосфор является наиболее важным биоэлементом и в то же время имеет очень широкий спектр промышленного применения. Красный фосфор используется в производстве спичек. Он наносится на боковые стороны коробки в дополнение к тонко измельченному стеклу и клею. Он воспламеняется при растирании спички с хлоридом калия и серой.
Элементарный фосфор
Возможно, первое свойство фосфора, используемое человеком, — это его невежество. Воспламеняемость фосфора очень высока и зависит от гомологической модификации.
Часто используется белый («желтый») фосфор, поскольку он наиболее химически активен, токсичен и огнеопасен (например, при сжигании центробежных бомб).
Красный фосфор является основной модификацией и производится и потребляется промышленностью. Он используется в качестве газопоглотителя в производстве ламп накаливания, в производстве спичек, взрывчатых веществ, составов, похожих на бурконтасен, топлива и нескользящих смазочных материалов.
Соединения фосфора в сельском хозяйстве
Фосфор (в виде фосфорной кислоты) является одним из трех важнейших питательных веществ (NPK) и участвует в составе АТФ. Большая часть добываемого фосфата используется для производства фосфорных удобрений, высокофосфатных, осадочных пород и песчаных дюн.
Соединения фосфора в промышленности
Фосфат широко используется
В качестве композитов (смягчители воды), пассивный синтез поверхности металла (защита от эрозии, например, так называемые композиты «Маджеф»)
Фосфатные связующие
Фосфаты и фосфатные глины получают, используя способность фосфатов образовывать стабильные трехмерные полимерные сетки.
Биологическая роль соединений фосфора
Фосфор присутствует в живых клетках в виде орто- и пирофосфата и является компонентом нуклеотидов, нуклеиновых кислот, фосфопротеинов, фосфолипидов, когулов и ферментов. Кость человека состоит из гидроксиапатита 3CA3(PO4)3-каф.2. Зубная эмаль содержит фторапатит. Печень играет важную роль в метаболизме соединений фосфора в организме человека и животных. Метаболизм соединений фосфора регулируется гормонами и витамином D. Суточная потребность человека составляет 800-1500 мг. Недостаток фосфора в организме приводит к развитию различных заболеваний костей.
Токсикология элементарного фосфора
Красный фосфор практически нетоксичен. Пыль красного фосфора попадает в легкие и при активном воздействии вызывает пневмонию. Белый фосфор очень токсичен и растворим в липидах. Смертельные дозы белого фосфора составляют 50-150 мг. При контакте с кожей белый фосфор вызывает сильные ожоги.
Острое отравление фосфором обжигает рот и желудок и проявляется головной болью, слабостью и рвотой. Желтый цвет появляется через два-три дня. Хроническая форма характеризуется нарушением обмена кальция, поражением сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительные средства, промывание кишечника и внутривенное введение раствора глюкозы. При ожогах кожи обрабатывайте пациентов растворами сульфата меди или соды. Предельно допустимая концентрация паров фосфора в воздухе составляет 0,03 мг/м3.
Токсикология соединений фосфора
Некоторые соединения фосфора (фосфин) очень токсичны. Химикаты зарин, зоман и табун являются соединениями фосфора.
Селитры являются компонентами взрывчатых веществ. Например, нитрат калия является компонентом черного пороха. Азотная кислота может быть получена из сухих нитратов, содержащих серную кислоту высокой плотности.
Жёлтый фосфор
Неочищенный белый фосфор обычно называют «желтым фосфором». Очень токсичный (ПДК 0,0005 мг/м³ в окружающем воздухе), легковоспламеняющийся кристаллический желтый до темно-коричневого цвета. Особый вес 1,83 г/см³, значение +43,1°C, кипит при +280°C. Он нерастворим в воде, легко окисляется и спонтанно воспламеняется на воздухе. Он горит ослепительным ярко-зеленым пламенем и дает тонкие семена плотного белого табака — тетрафиллос.4o10.
Фосфор реагирует с водой только при температуре выше 500 градусов Цельсия, поэтому для тушения фосфора используйте большое количество воды (перенос фосфора в твердом состоянии) в жидком песке. Желтый фосфор хранят и транспортируют под слоем воды (раствор хлорида кальция), чтобы защитить его от самонаблюдения.
Красный фосфор

Красный фосфор является более термодинамически постоянной модификацией элементарного фосфора. Впервые полученный австрийским химиком А. Шретером в Швеции в 1847 году белый фосфор нагревался при 500 °C в атмосфере угарного газа в запаянной стеклянной ампуле.
Красный фосфор имеет pn и представляет собой полимер со сложной структурой. В зависимости от способа производства и степени разрушения красный фосфор имеет пурпурно-красный оттенок, а в отливках — бронзово-фиолетовый, металлический блеск. Химическая активность красного фосфора намного ниже, чем белого — его растворимость очень низкая. Красный фосфор может быть растворен только в определенных растворенных минералах (свинец и епископ). Иногда его используют для получения более крупных кристаллов. Так, например, в 1865 году немецкий физико-химик Й. В. Гитторф впервые получил идеально сконструированный, но маленький кристалл (Гитторф Росфор). Красный фосфор не воспламеняется самопроизвольно на воздухе до 240-250°C (при этом переходит в белую форму при сублимации), но самопроизвольно воспламеняется при трении или ударе, полностью лишенный химических явлений. Он нерастворим в воде, а также в бензоле, дисульфиде углерода и т.д. и растворим в тримидрине. Красный фосфор превращается в пар, который переходит в температуру сублимации, а при охлаждении образуется в основном белый фосфор.
Его токсичность в тысячи раз меньше, чем у белого фосфора, поэтому он гораздо шире используется, например, при производстве спичек (составы на основе красного фосфора покрывают коробки с фрикционной поверхностью). Плотность красного фосфора также высока и достигает 2400 кг/м3 при литье. При хранении на воздухе красный фосфор постепенно окисляется в присутствии влаги, образуя гигроскопичные оксиды, которые поглощают воду и высыхают («размокают»), образуя вязкую фосфорную кислоту, которая хранится в герметичных контейнерах. После «замачивания» его промывают водой для удаления остатков фосфатов, сушат и используют по назначению.
Чёрный фосфор
Черный фосфор является наиболее термодинамически и химически постоянной формой первичного фосфора. Впервые черный фосфор был приобретен американской компанией Natural P. W. Bridgeman в 1914 году. Белый фосфор Bridgeman в виде черных блестящих кристаллов, высокой плотности (2690 кг/м3). Для получения композиции черного фосфора Бриджмен применил давление 2-10 9 PA (20 000 атм) и температуру около 200°C. Начало быстрой миграции происходит при давлении 13 000 атмосфер и температуре около 230 °C.
Черный фосфор очень похож на графит и совершенно нерастворим в воде и органических растворителях. Черный фосфор может воспламениться только в том случае, если его сначала сильно нагреть в атмосфере чистого кислорода до 400°C. Черный фосфор поднимает электричество и обладает полупроводниковыми свойствами. Температура плавления черного фосфора составляет 1000°C при давлении 18-10 5 Па.
Качественной реакцией является осаждение желтого ортофосфата серебра (I). Используется в производстве минеральных удобрений, для осветления сахарозы, в качестве катализатора в органических композициях и как ингредиент антикоррозийных покрытий для чугуна и стали.
Соединения фосфора
Давайте рассмотрим свойства соединений фосфора.

- Фосфин РН3 — газ при комнатной температуре, но уже при небольшом повышении температуры разлагается. Растворим в органических растворителях, но мало растворим в воде. По химическим свойствам — восстановитель. Ядовит. Практического значения это вещество не имеет.
- Оксиды наиболее стабильным оксидом является фосфорный ангидрид — оксид фосфора V (P2O5). Кристаллическое вещество является очень гигроскопичным и активно используется как осушающий агент. В зависимости от условий при взаимодействии с водой образует либо метафосфорную (НРО3), либо ортофосфорную (Н3РО4), либо пирофосфорную (Н4Р2О7) кислоты. Оксид фосфора III неустойчив. Взаимодействие с водой приводит к образованию фосфорноватистой кислоты (Н3РО3).
- Кислоты разделяют на фосфорные (содержащие атом фосфора в степени окисления +5) ортофосфорная (Н3РО4), пирофосфорная (Н4Р2О7), метафосфорная (НРО3) и низшие фосфорнокислые кислоты фосфористая (Н3РО3), фосфорноватистая (Н3РО2).
- Галогениды хлориды фосфора — широко используемые вещества в органическом синтезе в качестве хлорирующих агентов.
Способ получения

В промышленности P извлекают из природного ортофосфата при температуре 800-1000°C без доступа воздуха с помощью колы и песка.
CA3(PO4)2 + 5C + 3SIO2 = 3CASIO3 + 5CO↑ + 2p↑
Полученный пар концентрируется при охлаждении с белым P
В лаборатории он используется в производстве P особой чистоты.








