Названия алленов образуются путем добавления названий заместителей к основной цепи, бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители перечислены в алфавитном порядке, как обычно. При наличии различных заместителей в бензольном кольце выбирается кратчайший путь между ними.
§ 15. Ароматические углеводороды. Бензол
Название «ароматическая ассоциация» появилось давно, на ранних этапах развития органической химии. Они содержат соединения, полученные из натуральных смол, эфирных масел и бальзамов, которые имеют приятный запах. Впоследствии было обнаружено, что существует множество веществ, которые по структуре и химическим свойствам напоминают ароматические соединения, но не обладают приятным запахом. Однако исторически сложившиеся названия были сохранены.
Большинство ароматических углеводородов опасны для жизни человека, они токсичны, и работа с ними требует строгого соблюдения мер безопасности. Таким образом, бензол является токсичным веществом и может поражать почки и разрушать структуру хромосом, при длительном контакте изменяются группы крови. Это типичный и самый простой представитель ароматических углеводородов.
Строение бензола
Молекулярный тип бензола — c6н6. Это явно ненасыщенный углеводород — ему не хватает восьми водородов до полного насыщения — c6н14. Неизвестные углеводороды характеризуются обесцвечиванием раствора перманганата и бромистой воды. Проверьте это с помощью бензола.
Вопрос. Почему бензол не обесцвечивает водные растворы бромида и КМПО4; Какие предположения можно сделать о структуре бензола?
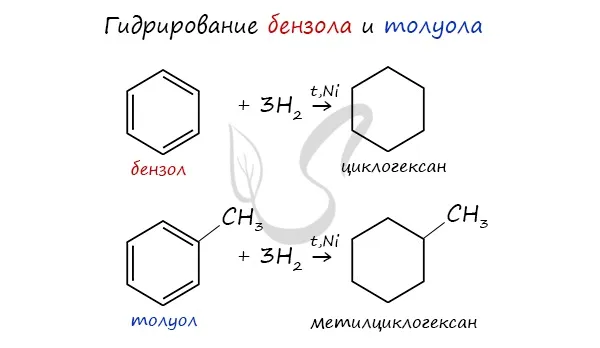
Опыт показывает, что бензол не образует прямых или разветвленных цепей, содержащих двойные или тройные связи. Реакции гидрогенизации бензола доказывают то же самое. Также экспериментально было установлено, что молекула бензола (одна молекула) может соединить только три молекулы водорода (три молекулы), что приводит к круговому соединению.
Это показывает, что бензол является круговым углеводородом.
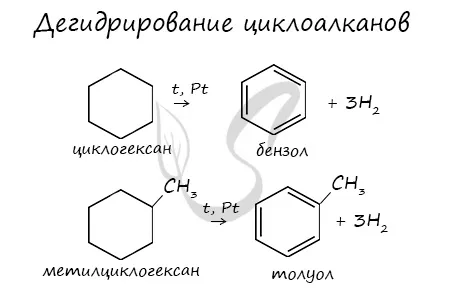
Много позже русский ученый Н.Д. Зелинский осуществил обратную реакцию — каталитическое дегидрирование цикла. Эта реакция привела к образованию бензола.

В 1865 году немецкий химик Ф.А. Кекуле предложил, что путем чередования простых (одиночных) и двойных (кратных) связей можно предположить круговую структуру бензола, которая выражается следующей структурной формулой (1, 2).
Все атомы углерода молекулы бензола находятся в гибридном состоянии SH 2. Каждый углерод образует три связи с двумя соседними атомами углерода и одним атомом водорода. Эти связи находятся на одном уровне и имеют угол 120° (рис. 30). Таким образом, шесть атомов углерода образуют обычный шестиугольник. Кроме того, каждый атом углерода имеет негибридную 2p-орбиталь, содержащую электрон.
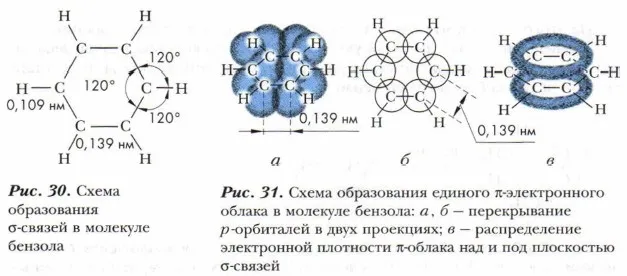
Негибридные орбитальные p-электроны каждого углерода перекрываются с соседними негибридными p-электронными облаками по обе стороны, образуя единое шестиэлектронное электронное облако. Плотность электронов в этом облаке распределена равномерно (рис. 31). Все связи между атомами углерода идентичны. Покрытия возникают выше и ниже уровня сцепления. Вы уже были знакомы с подобным явлением при изучении диеновых углеводородов, содержащих сопряженные двойные связи (см. § 13).
Исследования показывают, что бензол не имеет простой двойной связи и что расстояние между центрами соседних атомов углерода уменьшается до 0,139 нм, поскольку ядра углерода движутся ближе друг к другу под влиянием облака p-электронов. Напомним, что длина простой связи C-C составляет 0,154 нм, а длина двойной связи C = C — 0,134 нм.
В настоящее время используются следующие современные структурные типы молекул бензола.
Наиболее часто используемым типом является обычный шестиугольный тип с кругами на кругах.
Физические свойства бензола
Бензол представляет собой бесцветную, слабо кипящую (температура кипения 80,1°°) жидкость, нерастворимую в воде. Он имеет определенный запах. При охлаждении он легко застывает и превращается в белую кристаллическую массу с температурой плавления 5,5°C.
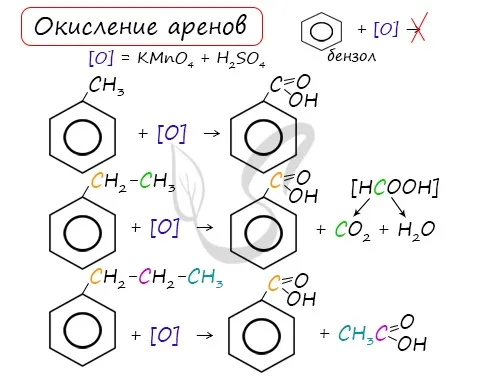
Как и все углеводороды, бензол сжигает слои углерода и двуокиси водорода.
Бензол горит коптящим пламенем.
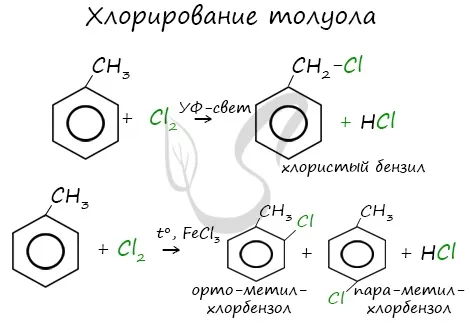
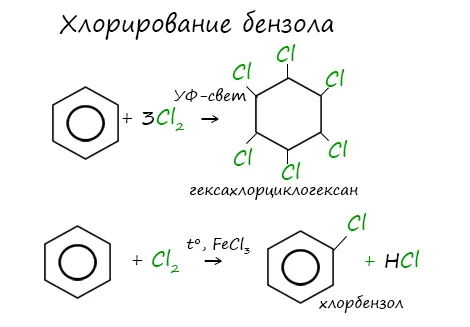
Наличие электронного облака P в бензольном кольце и его пространственная доступность создают условия для инициирования реакции обмена. Арнес характеризуется электрозависимыми реакциями бензольного кольца. Наиболее важными из этих реакций являются галогенирование и нитрование.
é. галогенирование.
При нормальных условиях бензол не обесцвечивает бромную воду, но при нагревании в присутствии железных отложений он вступает в реакцию и образует тяжелую жидкость бромбензол -cwarr.н5HG:.
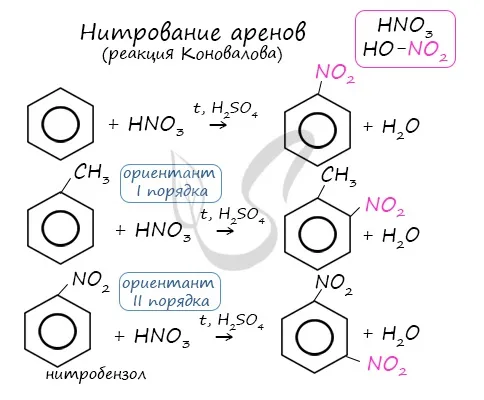
Ухудшить нитрификацию.
При заражении бензола нитратом (плотным сульфатом и азотной кислотой) и нагревании происходит реакция вытеснения. Группа нитро нитратов — нет.2 Заменяет атомы водорода в молекуле бензола.
Образуется тяжелая желтоватая жидкость, нерастворимая в воде, с запахом горького миндаля — нитровензол6h5Нет.2 Используется в качестве растворителя и для получения анилина.
Выпуск. Бензол с большим трудом участвует в дополнительных реакциях. Почему это происходит;
Присоединение аренов связано с разрушением стабильных систем бензольных колец. Они возникают только тогда, когда энергия не приносит прибыли и нагревается или излучается.
é. галогенирование.
Реакция присоединения хлора к бензолу происходит под ультрафиолетовым излучением и при температуре кипения бензола. Поэтому она производится пилотным контуром.
Экструдированные контуры являются пестицидами и до недавнего времени использовались для защиты растений от насекомых, но они опасны для жизни человека, поэтому их заменили более безопасными и легко разлагаемыми пестицидами.
Исследования показывают, что бензол не имеет простой двойной связи и что расстояние между центрами соседних атомов углерода уменьшается до 0,139 нм, поскольку ядра углерода движутся ближе друг к другу под влиянием облака p-электронов. Напомним, что длина простой связи C-C составляет 0,154 нм, а длина двойной связи C = C — 0,134 нм.
Бензол и его гомологи
Аллены — это ароматические углеводороды, содержащие одно или несколько бензольных колец. Бензольное кольцо состоит из шести атомов углерода, включая двойные и простые связи.
Важно отметить, что двойные связи в молекулах бензола не являются стабильными, они всегда движутся по кругу.
Ароматические углеводороды также известны как ароматические углеводороды. Первым членом ряда связей является бензол, c6h6. Общий вид облигационного заказа — cnh2n-6.
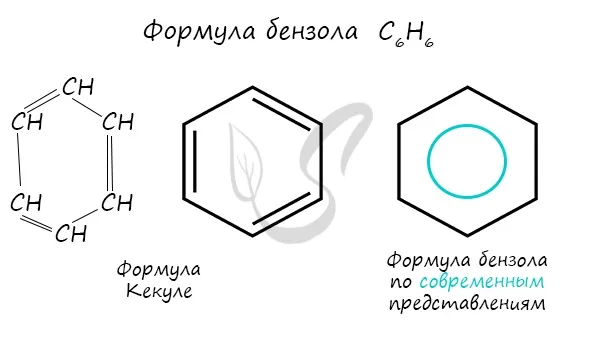
Долгое время структурный тип бензола оставался загадкой. Человек, предложенный Кекуром с тремя двойными связями, не мог учесть тот факт, что бензол не участвовал в дополнительных реакциях. Как уже упоминалось выше, согласно современным представлениям, двойная связь в молекуле бензола находится в постоянном движении, поэтому целесообразнее оформить ее в виде кольца.
Вращение двойной связи в молекуле бензола образует сопряжение. Все атомы углерода находятся в SP 2. SP 2. Угол валентности равен 120°.
Номенклатура и арена ISIS
Названия алленов образуются путем добавления названий заместителей к основной цепи, бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители перечислены в алфавитном порядке, как обычно. При наличии различных заместителей в бензольном кольце выбирается кратчайший путь между ними.
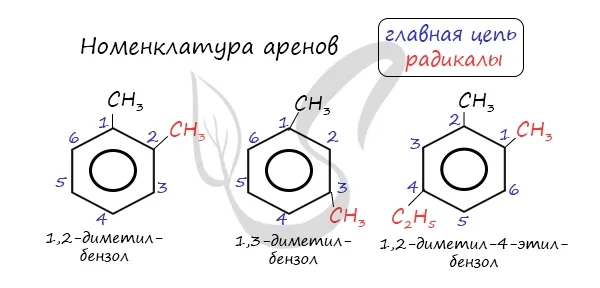
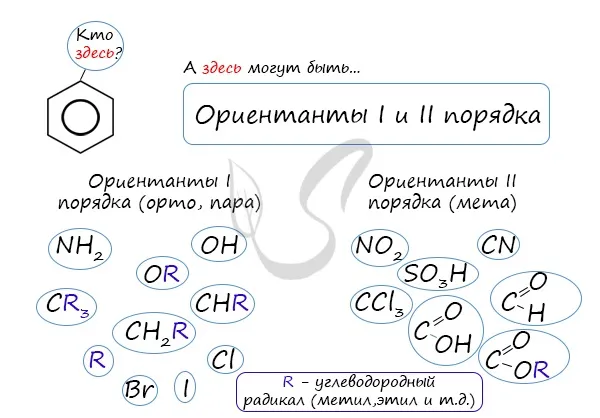
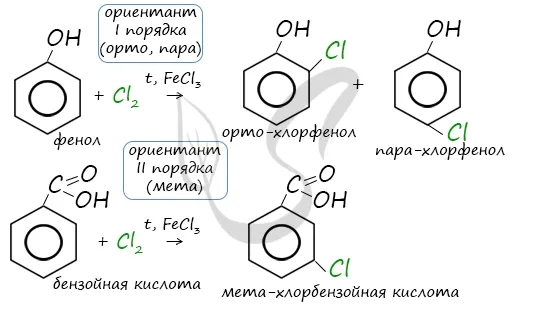
Alenia характеризуется структурными различиями, связанными с положением заместителя. Например, два заместителя бензольного кольца могут находиться в разных положениях.
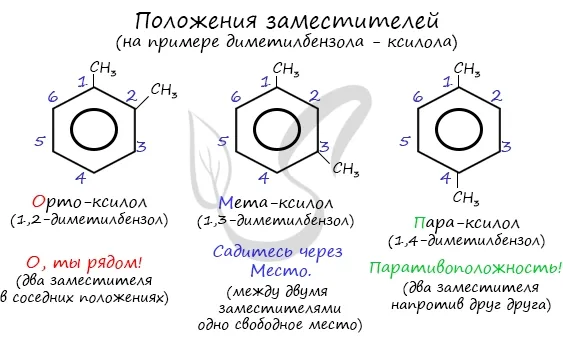
Положения заместителей в бензольном кольце называются положениями друг друга. Это символизируется префиксами орто-, мет- и пара-. (Есть ли ниже мнемонические указания на их успешные мемуары?)
Создание Аллена.
-
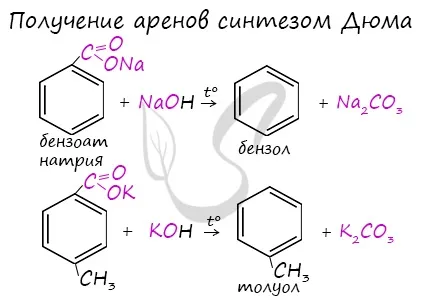
Реакция Зелинского (тримеризация ацетилена)
Эта реакция происходит при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический бензольный углеводород.
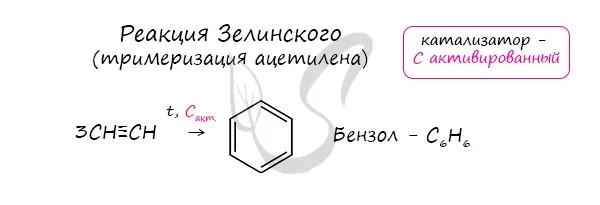
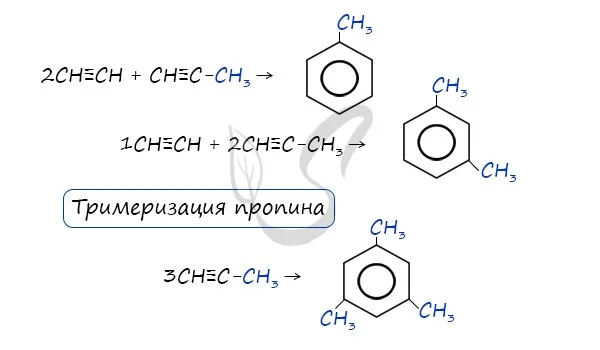
Добавление пропициатора к ацетилену может привести к образованию тортола. Увеличивая предохранительную пропорцию, можно добиться окончательного образования 1,3.5-триметолбензола.
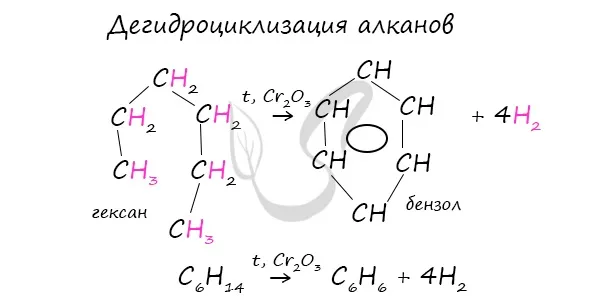
В ходе этих реакций, которые протекают при высоких температурах и в присутствии катализатора, CR2o3O, линейная структура алкана замыкается в круг и отщепляет водород.
В результате резидентного дегидрококциклирования образуется толуол.
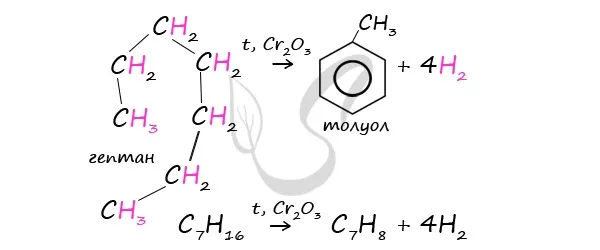
Дегидродегидратация уже «завершенного» циклита «завершает» цикл, приводя к трехминутному водородному отшелушиванию, образуя кольцо и соответствующий альний с теми же заместителями.
Эта реакция происходит при пропускании ацетилена над активированным углем при t = 400°C. В результате образуется ароматический бензольный углеводород.
Качественные реакции на альдегиды
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:
- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты различают на моноциклические и многоатомные (по числу групп OH) и определяют с помощью различных качественных реакций.
1. для человеческих спиртов
1.1. оксид меди (II) — при пропускании паров спирта через нагретый оксид образуются альдегиды. Это определяется путем тестирования с кислотой окулярного типа — раствор превращается в характерный светло-фиолетовый цвет.
1.2 Йодный тест — йод и гидроксид натрия образуют осадок желтого цвета:.
1.3 Тест Лукаса на распознавание вторичных и третичных спиртов — первичные спирты не вступают в реакцию. При взаимодействии одноатомного спирта с плотным раствором соляной кислоты и хлорида цинка он расслаивает раствор и образует мутный жирный слой алкилхлорида.
2. многоатомные спирты с глицерином, напр.
Синий гидроксид меди (II) растворяется в глицерине при нормальных условиях с образованием ярко-синего комплексного соединения меди.
Качественные реакции на карбоновые кислоты
1. окрасьте фиолетовый раствор карбоновой кислоты в красный цвет.
2. исключено с окисью углерода и серной кислотой в воде. Образующийся угарный газ можно поджечь синим пламенем.
Аналогичным образом разлагается щавелевая кислота.
3. щавелевая кислота реагирует с солями меди (II) — выпадает зелено-голубой кристаллический осадок оксалата меди:.
Давайте сегодня займемся с вами химией. Надевайте свой виртуальный халат и вперед. Попробуйте угадать все символы химических элементов, так как в современном мире важно знать их о своих перспективах.
Качественные реакции на альдегиды
(a) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала).
ПРИМЕЧАНИЯ. Реакция серебряного зеркала может также выявить метан (муравьиную кислоту) HCOOH. Какое отношение кислота имеет к альдегиду? Просто. Муравьиная кислота — единственная карбоновая кислота, которая содержит как альдегидные, так и карбоксильные кислотные группы.
В ходе реакции метановая кислота окисляется до карбоновой кислоты, которая разлагается на углекислый газ и воду.
(b) Взаимодействие с гидроксидом меди(II) (реакция медного зеркала).
Для этого альдегид добавляют к свежеприготовленному гидроксиду меди(II) и смесь нагревают.
CH 3 -CHO + 2Cu(OH)2 -> CH3 -COOH + Cu2 O↓ + 2H2 O (реакция происходит при нагревании)
Оксид меди (I) Cu2O-красный осадок.
(c) Взаимодействие с раствором сульфата фуксина.
При добавлении альдегида к раствору сульфата фуксина раствор становится светло-фиолетовым.
Качественные реакции на спирты
Спирты могут быть одноатомными, двухатомными и многоатомными, в зависимости от количества гидроксильных групп. Реакция отличается для одноатомных и многоатомных спиртов.
(a) Окисление спиртов оксидом меди.
Для этого пары спирта проходят через накаленный оксид меди. Образовавшийся альдегид задерживается сульфатом фуксина, и раствор становится фиолетовым.
(b) Взаимодействие с натрием.
Качественные реакции с многоатомными спиртами.
(a) Взаимодействие с гидроксидом меди(II).
В отличие от альдегидов, полиспирты реагируют с гидроксидом меди(II) без нагревания.
Например, при добавлении глицерина образуется медь(II) глицерина (темно-синий хелатный комплекс).
Качественные реакции на карбоновые кислоты
Качественные реакции муравьиной кислоты.
(a) Реакция серебряного зеркала.
(b) реакция с концентрированной серной кислотой.
При добавлении концентрированной серной кислоты H.2Итак.4 раствор муравьиной кислоты, образуются монооксид углерода и вода.
Поскольку молекула этана не имеет двойных связей, при прохождении этана через бромированную воду не происходит химической реакции, и раствор брома остается оранжевым.
Список веществ, которые обесцвечивают бромную воду?
Следующие алкены, алкины и фенолы C6H5OH + 3Br2 = C6H2Br3OH (твердый) + 3HBr (качественная реакция для фенола), амин C6H5NH2 + Br2 = C6H2Br3Nh2 (твердый, белый) + 3HBr (качественная).
Полиэтилен не влияет на бромированную воду и не обесцвечивает раствор перманганата калия.
Какие газы обесцвечивают бромированную воду?
Эта страница категории «Химия» содержит ответы на вопрос Список веществ, обесцвечивающих бромированную воду. Уровень сложности вопроса рассчитан на учащихся 10-11 классов. Для получения дополнительной информации по интересующей вас теме воспользуйтесь автоматическим поиском в той же категории, чтобы посмотреть ответы на похожие вопросы. Используйте кнопки в верхней части страницы, чтобы создать новый запрос, наиболее соответствующий вашим критериям поиска. Удобный интерфейс позволяет обсуждать интересующие вас темы с посетителями в комментариях.
Уравнение реакции (предполагая, что сила железа равна 2, как не указано в вопросе) Найдите количество Fe + HgCl2 = FeCl2 + Hg железа, 5, 6 \ 56 = 0, 1 моль ртути, соответственно количество железа в уравнении = 0, 1 моль массы ртути.
H2SO4 + BACL2 = BASO4 + 2HCL N(H2SO4) = 9, 8:98 = 0, 1 моль N(BACL2) = 25:208 = 0, 12 моль. m (BASO4) = 0, 1 x 233 = 23, 3 г.
CH3 CH3! CH3 -CH2 -C -CH -CH -CH3! CH3 CH3.
Тепловой процесс. В этом блюде овощи сохраняют свои полезные свойства. А овощи в этом блюде сохраняют свои свойства и не попадают в суп.
V (C3H4) = N * VM = 0, 1 * 22, 4 = 2, 24 L M (C3H4) = N * M = 0, 1 * 40 = 4 г (C3H4 = AR (C) * 3 + молекулярная масса AR (H) * 4 = 12 * 3 + 1 * 4 = 36 + 4 = 40 г \ моль).

Способность химических веществ людей притягивать к себе общие пары электронов. Например, HCl. хлор более электроотрицателен. Хлор электризуется, к нему притягиваются общие пары электронов, и связи являются ковалентными. Хлор электроотрицателен, притягивает к себе пары общих электронов, и связь становится ковалентной. Полярный.


Живость — в картине.
Качественной реакцией для сульфат-ионов является взаимодействие растворимых солей бария, таких как хлорид бария, с солями соли в растворе: BACL2 + NA2SO3 = BASO3 + 2NACL.
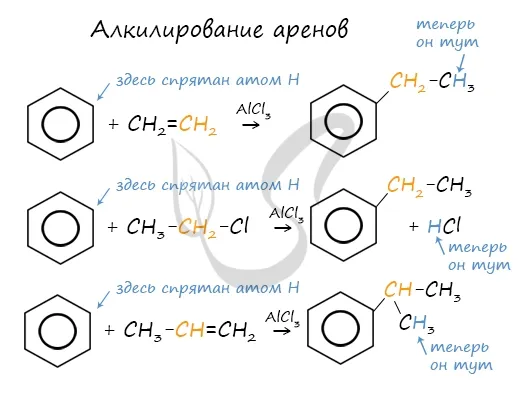
Алкилирование алленов осуществляется путем введения алкильного корня в молекулу бензола. Алкильные корни часто представляют собой алкены или галогенированные алкены. В этих реакциях катализатор ALCL3.
Вопросы и задания
1. напишите уравнение реакции сложения: а) водорода, б) хлора в этилене и пропилене. Сообщите о продуктах реакции. Как на практике можно отличить метан от этилена?
2.Напишите уравнение реакции грязного водорода с букетом-2. Сообщите продукт реакции.
Раствор 3.Gut-1 добавляется в грязную воду. Какое явление наблюдается? Напишите уравнение реакции.
4. напишите форму реакции взаимодействия пропилена с раствором перманганата калия.
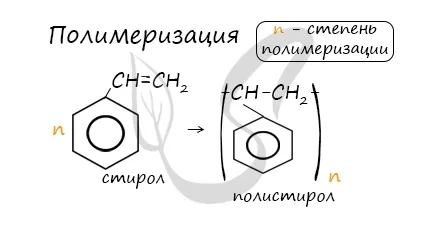
5. полимеризация этилена при массе 140 г дала полимер с макромолекулой 1,505°10 22. Рассчитайте: a) среднюю молекулярную массу полимера b) степень полимеризации.
6. 20 дм3 (н.у.) После пропускания смеси этана и этилена через пробирку (избыток) с бромидом воды масса пробирки увеличилась на 20 г. Определяется количество (н.у.) этанида в газовой смеси.
7*. Нарисуйте схему реакции, которая может привести к образованию 2,2,3,3-тетраметилбутана из 2-метилбутана.

Перейдите по ссылке с QR-кодом, чтобы прочитать больше об асимметричной реакции асимметричного алкения.








