Единственная общая закономерность взаимодействия азотной кислоты и металла заключается в том, что чем тоньше кислота и чем активнее металл, тем глубже восстанавливается азот.
Азотная кислота
(HNO3), сильная кислота, содержащая основание, при нормальных условиях бесцветная жидкость, является одним из важнейших продуктов химической промышленности.
Плотность безводной азотной кислоты p = 1522 кг/м3, температура плавления tТемпература плавления. —41.15°C, температура кипения tтемпература кипения t 84°C.
Смешивается с водой в любой пропорции для образования азеотропной смеси с tтемпература кипения t = 121,8°C, содержащий 69,2% кислоты. Существует также кристаллический гидрид HNO3∙ H2O с tТемпература плавления. -37.85°C и HNO3∙ 3H2O c tТемпература плавления. -18,5°C. В отсутствии воды азотная кислота нестабильна, разлагается на свету и выделяет кислород уже при комнатной температуре (4HNO3 → 4NO2 + 2H2O + O2), если выделяющийся диоксид азота становится желтым, а концентрация NO2 — Красный.
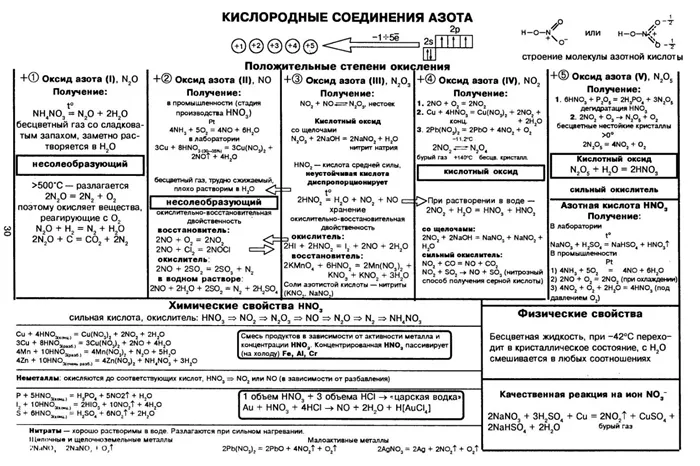
Азотная кислота является мощным окислителем, окисляя серу до серной кислоты и фосфор до фосфорной кислоты. Только золото, тантал и некоторые платиновые металлы не реагируют с азотной кислотой. Азотная кислота реагирует с большинством металлов, в основном выделяя оксиды азота: ZCu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O.
Некоторые металлы, такие как железо, хром и алюминий, легко растворяются в разбавленной азотной кислоте, но устойчивы к воздействию концентрированной азотной кислоты из-за образования защитного оксидного слоя на поверхности металла. Эта особенность позволяет хранить и транспортировать концентрированную азотную кислоту в стальных контейнерах.
Смесь 1:3 концентрированной азотной и соляной кислот, известная как Королевская вода, растворяет даже золото и платину. Органические соединения окисляются или нитруются азотной кислотой, в результате чего образуется остаток (нитрогруппа NO2 +) замещает водород в органическом соединении (происходит нитрификация).

Получение
В XIII веке было описано образование азотной кислоты путем нагревания нитрата калия с квасцами, железным купоросом и глиной.
В середине XVII века И. Р. Глаубер предложил получать азотную кислоту путем умеренного (до 150°C) нагревания нитрата калия с концентрированной серной кислотой: KNO3 + H2Итак.4 → HNO3 + KHSO4 До начала 20-го века этот метод использовали в промышленности, заменяя нитрат калия самым дешевым природным нитратом из Чили — NaNO.3.
Современные методы получения азотной кислоты основаны на контактном окислении аммиака кислородом воздуха. Основными этапами процесса являются.
- контактное окисление аммиака до окиси азота: 4NH3 + 5O2 → 4NO+6H2O;
- окисление окиси азота до двуокиси и поглощение смеси «нитрозных газов» водой: 2NO + O2 → 2NO2 3NO2 + H2O → 2HNO3 + NO
- смесь аммиака (10 — 12% ) с воздухом пропускают через нагретую до 750 — 900°С сетку катализатора, которым служат сплавы платины — тройной (93% Pt, 3% Rh, 4% Pd) или двойной (90 — 95% Pt, 10 — 5% Rh)
- окисление NO до NO2 и растворенный NO2 в воде — может быть проведенj при атмосферном давлении, под давлением до 1 Мн/м 2 или комбинированным способом, при котором под давлением происходит только поглощение нитрозных газов водой
Азотную кислоту получают при концентрации 45-49% или (при использовании давления) 55-58%. Перегонка таких растворов может привести к получению азеотропной азотной кислоты. Более концентрированные кислоты (до 100%) могут быть получены перегонкой растворов азотной кислоты, содержащих концентрированную H2Итак.4 или прямой синтез — взаимодействие N2O4 с водой (или разбавленной азотной кислотой) и кислородом: 2N2O4 + 2H2O + O2 → 4HNO3.
Применение азотной кислоты
Наиболее важные области применения азотной кислоты — производство нитратов и сложных удобрений, взрывчатых веществ (например, тринитротолуола) и органических красителей.
Смеси концентрированной азотной кислоты и серной кислоты, известные как нитрификационные смеси, широко используются в органических композициях.
Азотная кислота используется для получения серной кислоты в камерах, для получения фосфорной кислоты из фосфора и в качестве окислителя в ракетном топливе.
В металлургии азотная кислота используется для образования и растворения металлов и отделения золота и серебра.
Азотная кислота — HNO3, бесцветная жидкость с сильным запахом, плотность 1,513 г / см & sup3, tpl 41,59 .C, tfp 82,6.C. Смешивается с водой во всех отношениях. Его получают путем контактного окисления аммиака. Он используется в производстве удобрений и …
Получение азотной кислоты
Азотная кислота образуется в результате действия окислителей на азотную кислоту.
Безводная азотная кислота может быть получена перегонкой под пониженным давлением концентрированных растворов азотной кислоты в присутствии P4O10 или H2Итак.4 в несмазанном стеклянном аппарате в темноте.
Промышленный процесс производства азотной кислоты основан на контактном окислении аммиака на нагретой платине.
Химические свойства азотной кислоты
Азотная кислота — одна из самых сильных кислот, и в разбавленных растворах она полностью распадается на ионы. Его соли называются нитратами.
Азотная кислота характеризуется сильной окислительной способностью. Азотная кислота является одним из самых активных окислителей. Многие неметаллы легко окисляются им и превращаются в соответствующие кислоты. Например, сера постепенно окисляется до серной кислоты при кипячении с азотной кислотой, а фосфор окисляется до фосфорной кислоты. Медленно горящий уголь, пропитанный концентрированной HNO3горит интенсивно.
Азотная кислота действует почти на все металлы (кроме золота, платины, тантала, родия и иридия), превращая их в нитраты, а некоторые — в оксиды.
Концентрированная азотная кислота пассивирует некоторые металлы.
При взаимодействии разбавленной азотной кислоты с менее активными металлами, например, с медью, выделяется диоксид азота. Для более активных металлов, таких как железо и цинк, образуется оксид азота. Сильно разбавленная азотная кислота взаимодействует с активными металлами (цинк, магний, алюминий) с образованием ионов аммония, образуя с кислотой нитрат аммония. Обычно одновременно формируется несколько продуктов.
При действии азотной кислоты на металлы водород обычно не выделяется.
Смесь, состоящая из одного объема азотной кислоты и трех-четырех объемов концентрированной соляной кислоты, называется маточной водой. Царь-водка растворяет некоторые металлы, которые не реагируют с азотной кислотой, например, золото, «король металлов». Его действие обусловлено тем, что азотная кислота окисляет соляную кислоту с выделением свободного хлора, образуя нитро(III) хлорид или нитрозилхлорид NOCl.
Применение азотной кислоты
Азотная кислота — одно из важнейших соединений азота. Азотная кислота используется в больших количествах при производстве нитратных удобрений, взрывчатых веществ и органических красителей, выступает в качестве окислителя во многих химических процессах и используется в производстве серной кислоты. Нитратный метод, он используется в производстве лаковой целлюлозы и пленок.
| Задание | Вычислите рН 6,3×10 -5 М раствора азотной кислоты. |
| Решение | Известно, что водородный показатель вычисляется по формуле |
В расчетах используется четырехзначная логарифмическая таблица.
pH = -lg(6,3 x 10 -5) = 5-0,7993 = 4,2007.
Округлите делитель до двух цифр, так как логарифмический подтерм содержит две значащие цифры: pH = 4,20.
Азотная кислота — одна из самых сильных кислот, и в разбавленных растворах она полностью распадается на ионы. Его соли называются нитратами.
Какие вещества реагируют с азотной кислотой
Ключевые слова: азотная кислота, молекулярная структура, физико-химические свойства, производство азотной кислоты, применение.
Лучшим гидроксидом азота является азотная кислота HNO3. Азотная кислота — это вещество с молекулярной структурой. HNO внутримолекулярный3 Химические связи ковалентно полярны. Диаграмма азотной кислоты:.
В азотной кислоте степень окисления азота составляет +5, а интенсивность — IV. В этом случае азот не может быть пятивалентным, поскольку на втором энергетическом уровне нет орбитальной щели, необходимой для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трем атомам: двум атомам кислорода и одному атому азота — трехцентровая связь.
При нормальных условиях азотная кислота представляет собой бесцветную жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе и смешивается с водой в любых пропорциях. Концентрированные растворы азотной кислоты часто желтеют из-за оксида азота (IV) NO.2Он образуется в результате частичного расщепления HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ

Азотная кислота является сильной моноосновной кислотой и распадается на ионы в водном растворе.
The H3Ионы O + можно обнаружить в растворе с помощью маркеров. Цвет камня меняется с фиолетового на красный, а цвет метилового оранжевого — с оранжевого на красный.
Азотная кислота обладает общими свойствами кислоты. Он вступает в реакцию с:.
KOH + HN O3 = KN O3 + H2 O O- + N + = H2 O
Mn(OH)2 + 2HNO3 = Mn(NO)3)2 + 2H2O Mn(OH)2 + 2H + = Mg 2+ + 2 H2 O
Цинк (OH)2 + 2 HNO3 = Zn (NO3)2 + 2 H2 O Zn(OH)2 + 2H + = Zn 2+ + 2 H2 O
CuO + 2 HNO3 = Cu(NO3)2 + 2H2O CuO + 2H + = Cu 2+ + H2O
Cu 2C O3 + 2HNO3 = 2KNO3 + CO2↑+O + 2HNO = 2KNO + CO2O CO3 2- + 2H + = CO2↑+O + 2HNO = 2KNO + CO2O
В то же время молекула азотной кислоты содержит один атом азота в высшей степени окисления. Это объясняет особые свойства азотной кислоты.
- Реакция с металлами. Азотная кислота взаимодействует со многими металлами, окисляя их не за счёт Н + , а за счёт азота в высшей степени окисления (+5). В результате таких реакций водород не образуется. Продуктами реакции являются нитрат металла, продукт восстановления азота и вода. Реакция идёт по схеме:
Здесь I — это металл.
В результате реакции обычно образуется смесь продуктов восстановления азота, причем один из них обычно преобладает. Глубина снижения содержания азота показана на диаграмме.

Восстановление азота до NO2 Не глубже, чем снижение до NO и т.д.
Глубина снижения содержания азота зависит от:.
- от природы металла (от восстановительной способности металла; чем левее положение металла в электрохимическом ряду напряжений металлов, тем глубже восстановление азота);
- от концентрации азотной кислоты (в более концентрированных растворах происходит менее глубокое восстановление азота);
- от температуры (понижение температуры способствует более глубокому восстановлению);
- от чистоты азотной кислоты.
Азотная кислота не реагирует с:.
- а) благородные металлы Au, Ru, Rh, Os, Ir, Pt вследствие слишком малой их восстановительной способности;
- б) некоторые металлы (Al, Сг, Fe) не реагируют с концентрированной (> 68%) азотной кислотой вследствие образования на поверхности металла плотной защитной оксидной плёнки – эти металлы пассивируются. Тем не менее при нагревании может происходить реакция окисления данных металлов.
Азотная кислота — мощная водка Словарь русских синонимов. Азотная кислота Существительное, количество синонимов: 1 — крепкая водка (1) Словарь синонимов ASIS. B… Словарь синонимов.
Специфические реакции
Появление определенных свойств АА связано с тем, что эффекты химических взаимодействий с АА могут различаться даже при реакции с одним и тем же веществом. Другими словами, его окислительные свойства зависят от концентрации. В химических процессах с использованием АК окислителем является азот, а не водород.
АК в любой концентрации является восстановителем, и азот восстанавливается на глубину, которая зависит от концентрации АК и природы восстановителя.

Если металл находится в последовательности напряжений справа от водорода, концентрированного АА, азот восстанавливается до NO2, который восстанавливается в реакции с разбавленными оксидами.
В реакции с металлами из той части последовательности напряжений, которая находится слева от водорода, концентрация АА сильно зависит от степени восстановления азота и преобладания любого из его составных продуктов реакции. Например:.
- результатом реакции Zn с HNO3, разбавленной до 3%, кроме нитрата цинка и воды, будет нитрат аммония (аммиачная селитра) NH4NO3;
- для 10% — азот в газообразном состоянии;
- для 20% — закись азота N2O;
- для 30% — оксид, а для 60% — диоксид.
Из этой зависимости можно сделать вывод. Чем тоньше кислота и чем активнее металл, тем больше азота восстанавливается, но не до кислотных оксидов. Тип азотного ангидрида — N2O5.

АК во всех концентрациях не реагирует с платиной, золотом или другими металлами, принадлежащими к той же серии мендели, что и золото. Однако смесь трех частей хлористого водорода (соляной кислоты) и части AA растворяет большинство металлов, включая драгоценные, в So -Calcined Aqua regia. Смесь H2SO4 и HNO3 используется для получения серной кислоты H2SO4. Это называется чернила.
Высокая концентрация холодного АА будет проходить через алюминий, железо и хром. Это означает, что концентрированный АА можно переносить на железные или алюминиевые емкости, поскольку он окисляет поверхностный слой металла, образуя защитную пленку.
Реакции Fe с разреженной HNO3 происходят так же, как и с другими металлами. Продукты возникают в виде различных типов N N и различных продуктов окисления Fe. Взаимодействие Al с разреженной HNO3 происходит аналогичным образом.
Взаимодействие с органическими веществами
АА реагирует только при нагревании углеводородов таких категорий, как парафины (алканы) и ароматические углеводороды (АРНИА), а азотная кислота является кислотой не только как окислительный, но и как нитрификационный элемент. Эта реакция очень хорошо протекает с АА, который разбавляется при повышении температуры и давления. Это называется реакцией нитрификации. Например, в результате этого взаимодействия с этаном получается только ниттан. В случае нитрования пропана получается смесь различных нитропарафинов.

АК реагирует с белками и противодействует реакции ксанопротеина. Эта реакция заключается в появлении желтых пятен на коже при контакте с АК. Это связано с тем, что кислота имеет тенденцию окрашивать в желто-оранжевый цвет белки, содержащие ароматические аминокислоты. Внешний вид цвета можно определить, проведя специальные эксперименты по определению наличия аминокислот в белке.
Соли азотной кислоты
Соли АК называются нитратами и обычно имеют белый цвет и кристаллическую форму. Когда берут минералы, такие как щелочи и щелочные металлы, и растворяют их в азотной кислоте, получают нитраты металла. Нитраты также можно получить из оксидов (Cu2O, K2O) или слабых кислот, таких как карбонат H2CO3. Калий, натрий, кальций и аммоний называются солевыми растворами.

- KNO3 — индийская селитра;
- NаNО3 — чилийская селитра;
- Са (NО3)2 — норвежская селитра;
- NH4NO3 — аммиачная селитра, ее месторождений в природе нет.
Помимо лития, щелочные и щелочноземельные нитратные соли разлагаются на нитриты.
В твердом виде все нитраты входят в состав фейерверочной смеси. Черный порох: 2kno3 + s + 3c = 3co2 + n2 + k2s.
Высокая концентрация холодного АА будет проходить через алюминий, железо и хром. Это означает, что концентрированный АА можно переносить на железные или алюминиевые емкости, поскольку он окисляет поверхностный слой металла, образуя защитную пленку.
Цена азотной кислоты
Азотная кислота, как и большинство потребляемых кислот, чистая или техническая, может деформировать пятна. Последний вариант дешевле. Чистые реагенты стоят дороже. Для справки, ГОСТ 4461-77 является правилом для очищенных кислот. Российские реагенты стоят около 30-55 рублей за килограмм. Значение зависит от концентрации раствора.
Для технических кислот максимальный предел цены обычно составляет 40 рублей за килограмм. Также доступны более крупные пакетные устройства. Например, существуют 25-литровые контейнеры для азотной кислоты. Оптовые заказы позволяют приобретать реагенты с максимально возможной выгодой. Они достаются компаниям, которые знают правила обработки реагентов.

Он разъедает слизистые оболочки, а также металл. Пары этого вещества могут затруднить дыхание и вызвать повреждение трахеи, в которую вложены ткани носа. По этой причине при работе с кислотами необходимо надевать маски. Если правила не соблюдаются, наступает отравление, за исключением затрудненного дыхания. Отравление проявляется рвотой, зудом, нарушениями зрения и обоняния. Только слабые растворы реагентов в основном безвредны. Например, они используются в школьных мастерских. Стоит научиться обращаться с химическими веществами с раннего возраста.








