Они также являются сильными окислителями и бурно реагируют с широким спектром неметаллических веществ. Продукты этих взрывных реакций зависят от температуры, концентрации кислоты и используемого восстановителя.
Кислород: химия кислорода
Кислород является главной подгруппой VI группы (или 16 группы в последней форме ETS) и включен во второй период периодической таблицы химических элементов Д. Менделеева.
Электронная конфигурация кислорода в основном состоянии выглядит следующим образом.
+8O 1s 2 2s 2 2p 4 1s 2p
Атомы кислорода содержат два неспаренных электрона на внешнем энергетическом уровне и два неспаренных электрона в основном состоянии.
В промышленности кислород получают путем перегонки жидкого воздуха.
Экспериментальные методы получения кислорода:.
Разложение перманганата калия:.
Разложение позвоночных солей в присутствии катализатора MnO.2 :.
2KClO3 →2KCl+3O2
Разложение пероксида водорода в присутствии оксида марганца (IV):.
2HgO → 2Hg+O2
Соединения кислорода
Основные состояния окисления кислорода + 2, + 1, 0, -1 и -2.
Оксиды металлов и неметаллов Na2O, SO2 и т.д.
Кислородсодержащие соли
Органические вещества, содержащие кислород
При нормальных условиях чистый кислород является очень активным веществом и мощным окислителем. В воздухе окисляющая способность кислорода не так сильна.
1. кислород проявляет окислительные (включая большинство химических элементов) и восстановительные (включая только наиболее электроотрицательные фториды) свойства. Как окислитель, кислород реагирует как с металлами, так и с неметаллами. Большинство реакций горения простых веществ в кислороде протекают очень бурно и иногда сопровождаются взрывами.
1.1 Кислород реагирует с фтором с образованием фторированного кислорода.
Кислород фактически не реагирует с хлором или бромом, но только при определенных очень жестких условиях.
1.2 Кислород реагирует с серой и кремнием, образуя оксиды.
1.3 Фосфор сгорает с кислородом с образованием оксидов.
При недостатке кислорода может образоваться оксид фосфора (III).
Однако в большинстве случаев фосфор сгорает с образованием оксида фосфора (V).
1.4 Кислород реагирует с азотом в разряде или при очень высоких температурах (2000°C) с образованием оксида азота (II).
N2 + O2 →2NO
1.5 В реакциях со щелочноземельными металлами, литием и алюминием кислород также является окислителем. Образуются оксиды:.
2Ca + O2 → 2CaO
Однако при сжигании натрия в кислороде образуется в основном пероксид натрия.
2Na + O2 → нет.2O2
Калий, рубидий и цезий, с другой стороны, при сгорании образуют смесь продуктов, в основном пероксидов.
K + O2 → КО2
Переходные металлы обычно окисляют кислород до устойчивого состояния окисления.
Цинк окисляется до оксида цинка (II):.
2Zn + O2 →2ZnO
Железо образует либо оксид железа (II), либо оксид железа (III), либо железный фон, в зависимости от количества кислорода.
2Fe + O2 →2FeO
4Fe + 3 O2 →2Fe2O3
3Fe + 2 O2 →2Fe3O4
1.6 При нагревании в большом количестве кислорода графит сгорает с образованием монооксида углерода (IV).
При недостатке кислорода образуется монооксид углерода CO.
2C + O2 → 2CO
Алмазы горят при высоких температурах:.
Горение алмазов в жидком кислороде:.

1,1 литра воды весит приблизительно 998,5 грамма. 2. 1 литр мелко измельченной поваренной соли весит 1 кг 200 г. 3. при температуре +20°C масса 1 л концентрированной серной кислоты составляет 1,83 кг (1830 г). 4. при температуре +200°C средний вес литра подсолнечного масла составляет 0,92-0,93 кг (920-930 г).
Азотная кислота HNO3 свойства
Молекулярная масса: 63,012 г/моль Внешний вид: бесцветная или дымящаяся желтовато-красная жидкость Запах: неприятно горький или резкий, удушливый
Сопряженное основание: нитрат Показатель кислотности (pKa): -1,4
Температура плавления: 231 K или -42 °C. Температура кипения: 356 K или 83 °C (чистая кислота). Плотность: 1,51 г / см3 (чистая кислота) — 1,41 г / см3 (68% водный раствор)
Структура
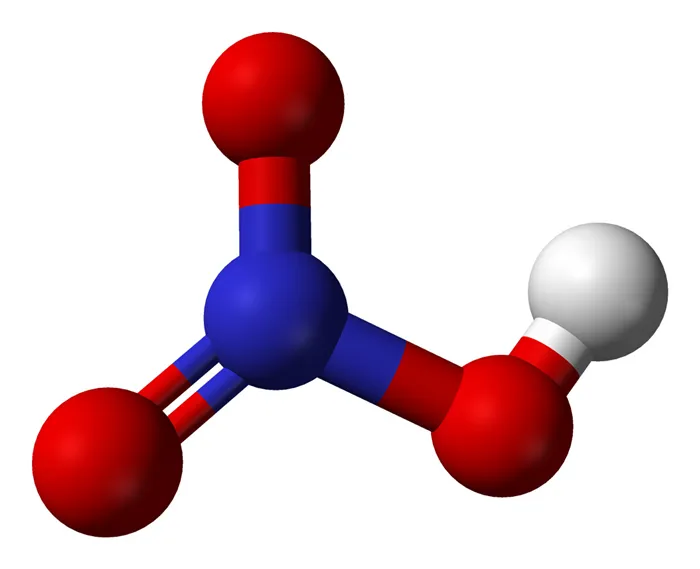
HNO3 имеет один атом азота (синий), один атом водорода (белый) и три атома кислорода (красный). Атом азота связан со всеми тремя атомами кислорода и несет заряд +1. Один атом кислорода несет заряд -1, один связан с водородом, а другой образует двойную связь с азотом.
Кислород вообще имеет тенденцию притягивать больше электронов, чем азот, поэтому он несет отрицательный заряд, в то время как атом азота несет положительный заряд.
Структура Льюиса
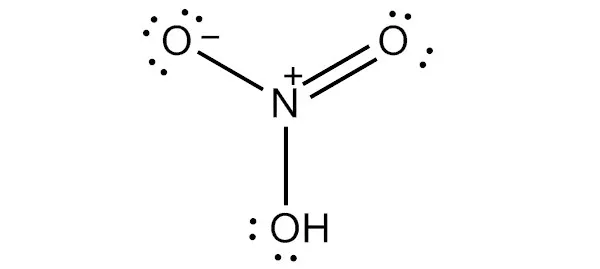
Чтобы составить структурную формулу Льюиса для азотной кислоты, необходимо рассчитать общее число валентных электронов в молекуле HNO3.
- Валентный электрон в одном атоме азота = 5
- Валентный электрон в одном атоме водорода = 1
- Валентный электрон в трех атомах кислорода = 18 (6*3)
Это дает общее число валентных электронов в молекуле HNO (5 + 1 + 18).3. Поскольку азот имеет больше валентных электронов, чем кислород, атом азота может быть помещен в центр структуры.
Следующий шаг — формирование связей и маркировка простых пар особей. Далее, каждый атом заряжается. Атом азота получает заряд +2, а два атома кислорода — заряд -1.
Наконец, нагрузка на атомы должна быть сведена к минимуму, чтобы стабилизировать структуру. Это может быть сделано путем преобразования простых пар в атомы кислорода внутри связи. Конечная структура состоит из двух одинарных связей между атомом азота и двумя атомами кислорода и двойной связи между атомом азота и остаточным атомом кислорода.

Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Как она производится?
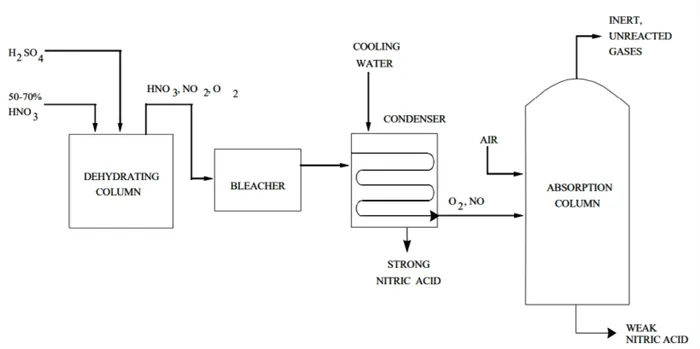
Для получения HNO используются два метода3 Используются два метода. Первый синтезирует HNO у пациентов с помощью окисления, концентрации и поглощения3 в концентрациях от 30 до 70 процентов. Во втором случае образуется сильная HNO3 (90-процентная концентрация) от пациентов с HNO.3 В нем сочетаются процессы обезвоживания, отбеливания, конденсации и абсорбции.
Производство слабой азотной кислоты
Большая часть азотной кислоты производится путем контактного окисления аммиака при высоких температурах. Это известно как процесс Оствальда. Он состоит из трех этапов.
1) Окисление аммиака.
Смесь аммиака и воздуха (1:9) окисляется при высоких температурах (750-800°C), проходя через каталитический конвертер. Катализатор обычно состоит из 90% платины и 10% родия. В результате этой (экзотермической) реакции образуются оксиды азота и вода в виде пара.
(2) Окисление оксида азота.
Оксид азота, образовавшийся в предыдущей реакции, окисляется: он некаталитически реагирует с остаточным кислородом, образуя диоксид азота. Это медленная и гомогенная реакция, которая сильно зависит от давления и температуры. При высоком давлении и низкой температуре в результате этой реакции образуется максимальное количество диоксида азота за очень короткое время.
3) Поглощение.
В последней реакции оксид азота поглощается водой. В результате получается желаемый продукт (азотная кислота в разбавленном виде) вместе с закисью азота. Концентрация HNO3 концентрация зависит от давления, температуры, количества ступеней абсорбции и концентрации оксида азота, поступающего в абсорбер.
Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Лекция № 11. Энергетический обмен
Энергетический метаболизм (катаболизм, анаболизм) — это совокупность реакций распада органических веществ с выделением энергии. Энергия, выделяемая при расщеплении органических веществ, не используется клеткой сразу, а запасается в виде АТФ и других высокоэнергетических соединений. АТФ является универсальным источником энергии для клетки. АТФ образуется в клетках всех организмов в процессе фосфорилирования — присоединения неорганического фосфата к АДФ.
У аэробных организмов (живущих в среде, лишенной кислорода) существует три стадии энергетического метаболизма: подготовка-окисление, окисление без кислорода, окисление кислорода; у анаэробных организмов (живущих в среде, насыщенной кислородом) стадии: подготовка без кислорода, окисление.
Подготовительный этап
Она заключается в ферментативном расщеплении сложных органических веществ на простые, например, белковых молекул на аминокислоты, жиров на глицериновые кислоты и карбоновые кислоты, углеводов на глюкозу и нуклеиновых кислот на нуклеотиды. Расщепление высокомолекулярных органических соединений осуществляется желудочно-кишечными или лизосомальными ферментами. Вся высвобождаемая энергия распространяется в виде тепла. Образовавшиеся небольшие органические молекулы могут быть использованы в качестве «структурного материала» или для дальнейшего расщепления.
Эта стадия заключается в дальнейшем расщеплении органического материала, образовавшегося на стадии подготовки, которое происходит в цитоплазме клетки и не требует присутствия кислорода. Основным источником энергии в клетке является глюкоза. Процесс неполного распада глюкозы без участия кислорода — это гликолиз.
Потеря электронов называется окислением, а увеличение — уменьшением; доноры электронов окисляются, а приемники уменьшаются.
Следует отметить, что биологическое окисление в клетках может происходить как с участием кислорода, так и без него.
или, если этого не происходит, путем переноса атомов водорода из одного вещества в другое. Например, вещество «А» окисляется в ущерб веществу «В».
Или посредством переноса электронов, например, в трехкольцевом железе окисляется один миллиард железа.
Гликолиз — это сложный многоступенчатый процесс, включающий 10 реакций. В ходе этого процесса глюкоза дегидратируется, а коферменты NAD+ (никотинамид динуклеотид аденин) действуют как приемники водорода. Глюкоза преобразуется в две молекулы пирувата (ПВС) по цепи2:.
Судьба ПВА зависит от наличия кислорода в клетке. В отсутствие кислорода в пастбищах и растениях происходит спиртовое брожение, при котором сначала образуется альдегид уксусная кислота, а затем этиловый спирт.
У животных и некоторых бактерий молочнокислое брожение происходит в отсутствие кислорода в результате образования молочной кислоты.
В результате гликолиза молекул глюкозы высвобождается 200 кДж, из которых 120 кДж рассеивается в виде тепла, а 80% сохраняется в связях АТФ.
Кислородное окисление, или дыхание
Включено полное расщепление пирувата, происходящее в митохондриях, которое должно происходить в присутствии кислорода.
Пируват переносится в митохондрии (Структура и функция митохондрий — лекция 7). Здесь ПВС вступает в цикл реакций, называемый циклом Кребса, в котором дегидратация (удаление водорода) и восстановление (удаление углекислого газа) образуют группу двухуглеродных ацетилов. Происходит дальнейшее окисление, включая дегидрирование и декарбоксилирование. В результате три выброса CO2Образуются пять пар атомов водорода2fad-h2), и молекулы АТФ.
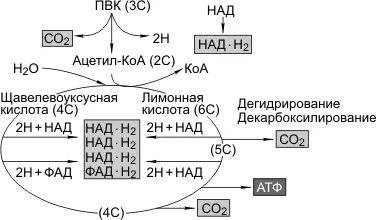
Общая реакция гликолиза и распада АТФ в митохондрии на водород и углекислый газ выглядит следующим образом
Две молекулы АТФ образуются в результате гликолиза, две — в результате цикла KREBS; две пары атомов водорода (2HADCHN2) образуются в результате гликолиза, 10-парный цикл KREBS; два атома водорода (2HADCHN2) образуются в результате цикла KREBS, 10-парный цикл KREBS.
Последним шагом является окисление пары атомов водорода кислородом в воде, но при этом происходит фосфорилирование АДФ из АТФ. Водород переносится на три больших ферментных комплекса (флавопротеины, коэнзим Q и цитохром) в дыхательной цепи, расположенной во внутренней мембране митохондрий. Водород отнимает электроны и в конечном итоге соединяется с кислородом в митохондриальной матке.
Купить Контрольная работа и тест по биологии




Протоны направляются в область бранеуса митохондрий, которая является «резервуаром для протонов». Внутренняя мембрана не может быть пронизана ионами водорода — с одной стороны, она заряжена отрицательно (из-за O2 — ), с другой стороны, он заряжен положительно (для H+). Когда динамическая разница во внутренней мембране достигает 200 мВ, протоны проходят через ферментный канал АТФ-синтазы, вырабатывается АТФ, а цитохроматическая оксидаза исключает восстановление кислорода. Таким образом, окисление 12 атомов водорода приводит к образованию 34 молекул АТФ.
1 — наружная мембрана — 2 — пространство средней мембраны, протонный резервуар — 3 — цитохром — 4 — ат.
Окисление NAD-H при перфорации внутренней митохондриальной мембраны.2 Окисление NAD-H продолжается, но синтез АТФ не функционирует, и АТФ не образуется в дыхательной цепи. Энергия распространяется в виде тепла (бурые жировые клетки млекопитающих).
Общая реакция распада глюкозы на углекислый газ и воду выглядит следующим образом
Переход к лекции 10 «Концепции метаболизма. Биосинтез белка».
Существует два правильных способа построения структурной формулы HNO Льюиса3(1) Структурная формула Льюиса HNO. Поэтому существует два основных формата координации. Двунаправленные стрелки на изображении выше показывают, что существует несколько способов создания структуры азотной кислоты.
Как применяют
Сбор и распознавание необходимы для выделения чистого кислорода. Чистый кислород используется в промышленности для окисления веществ и поддержания зон под водой и заполненных дымом (кислород необходим пожарным). В медицине кислородные баллоны помогают пациентам с затрудненным дыханием. Кислород также используется для лечения респираторных заболеваний.
Кислород используется при сжигании топлива — углерода, нефти и газа. Кислород широко используется в металлургии и машиностроении. Плавление, резка и сварка металлов.
Яркая окраска фейерверков обусловлена передачей электронов металлическим людям, соединения которых вводятся в пиротехническую смесь. Желтая окраска фейерверков вызвана людьми
Вопрос 6 из 25
Четыре одинаковые пробирки были полностью заполнены водой (1), мелко измельченной поваренной солью (2), серной кислотой (3) и подсолнечным маслом (4). Затем пробирки взвешивались. Какая из них имеет наименьшую массу?
Наш ответ — номер 4.
1,1 литра воды весит приблизительно 998,5 грамма.
2. 1 литр мелко измельченной поваренной соли весит 1 кг 200 г.
3. при температуре +20°C масса 1 л концентрированной серной кислоты составляет 1,83 кг (1830 г).
4. средний вес литра подсолнечного масла при температуре +200°C соответствует 0,92-0,93 кг (920-930 г).
Вопрос 7 из 25
Известно, что озон O3 в верхних слоях атмосферы поглощает жесткое ультрафиолетовое (UVB) излучение солнца и тем самым защищает поверхность Земли. Однако сам озон также образуется в атмосфере под воздействием ультрафиолетового излучения. Откуда она берется?
Ответ: кислород.
Озон образуется из ультрафиолетового (УФ) света и углекислого газа с его выбросом в атмосферу Земли.
Вопрос 8 из 25
Когда водолаз всплывает с глубины, внешнее давление быстро падает, и газ, растворенный в крови под давлением, выделяется в виде пузырьков. Это приводит к образованию пузырьков в крови. Для предотвращения этого водолаза немедленно помещают в декомпрессионную камеру. Какой газ ответственен за это явление?
Наш ответ: азот.
В норме это индифферентный газ, не участвующий в метаболических процессах. Однако под давлением азот становится наркотиком и, что еще опаснее, растворяется в крови и тканях и буквально «кипит» (выделяется в свободную фазу в виде пузырьков) при падении давления.








