Для достижения высококачественного эффекта расплава необходимо использовать материал, известный как поток. Они предназначены для улавливания и удаления грязи и загрязнений из расплава.
Алюминий

Алюминий — это ковкий, легкий белый металл, покрытый матовой пленкой оксида серебра. В периодической таблице Менделеева этот химический элемент называется Al (алюминий) и относится к главной подгруппе III группы III периода, атомный номер 13. Вы можете приобрести алюминий на нашем сайте.
В 16 веке Парацельс сделал первые шаги к получению алюминия. Он выделяет «квасцовую землю» из квасцов, которые содержали оксиды неизвестного тогда металла. В XVIII веке немецкий химик Андреас Маргграф вернулся к этому эксперименту. Он назвал оксид алюминия «глиноземом». В переводе с латыни это означает «терпкость». В то время этот металл не был популярен, поскольку его нельзя было найти в чистом виде. На протяжении многих лет британские, датские и немецкие ученые пытались выделить чистый алюминий. Алюминий произвел фурор на Всемирной выставке в Париже в 1855 году. Поскольку металл был довольно дорогим, из него изготавливали только предметы роскоши и ювелирные изделия. В конце 19 века появились более современные и дешевые методы производства алюминия. В 1911 году в Дюрене была произведена первая партия дюралюминия, названного в честь города. В 1919 году из этого материала были изготовлены первые аэропланы.
Физические свойства
Металл алюминий характеризуется высокой электро- и теплопроводностью, коррозионной и морозостойкостью и гибкостью. Его можно хорошо уплотнять, ковать, тянуть и прокатывать. Алюминий можно успешно сваривать различными видами сварки. Важным свойством является его низкая плотность — около 2,7 г/см³. Температура его плавления составляет около 660°C. Механические, физико-химические и технические свойства алюминия зависят от наличия и количества примесей, которые снижают свойства чистого металла. Основными природными примесями являются кремний, железо, цинк, титан и медь.
Различают алюминий высокой чистоты и алюминий технической чистоты. Реальная разница заключается в различии коррозионной стойкости конкретной среды. Чем чище металл, тем он дороже. Промышленный алюминий используется для производства сплавов, изделий из него и кабелей. Металлы высокой чистоты используются для специальных целей. По электропроводности алюминий уступает только золоту, серебру и меди. Сочетание низкой плотности и высокой проводимости делает его конкурентоспособным по сравнению с медью в проводке и кабелях. Длительный отжиг улучшает электропроводность, а отжиг ухудшает ее.
Теплопроводность алюминия увеличивается с ростом чистоты металла. Примеси марганца, магния и меди снижают это свойство. По теплопроводности алюминий уступает только меди и серебру. Благодаря этому свойству металл используется в теплообменниках и холодильниках. Алюминий обладает высокой удельной теплоемкостью и высокой температурой плавления. Цены на них гораздо выше, чем на большинство металлов. Чем выше чистота алюминия, тем больше вероятность отражения света от его поверхности. Металл хорошо отполирован и анодирован.
Алюминий имеет много сродств с кислородом и в воздухе покрывается тонкой, твердой пленкой оксида алюминия. Эта пленка защищает металл от последующего окисления и обеспечивает превосходные антикоррозионные свойства. Алюминий устойчив к атмосферной коррозии, воздействию рыбы и пресной воды, реагирует с органическими кислотами и концентрированными или разбавленными кислотами.
Химические свойства
Алюминий является достаточно активным амфифильным металлом. При нормальных условиях прочная оксидная пленка определяет его долговечность. Когда оксидная пленка разрушена, алюминий выступает в качестве активного восстановительного металла. Металл реагирует с кислородом до тонкого состояния и вступает в реакцию при высоких температурах. При нагревании он вступает в реакцию с серой, фосфором, азотом, углеродом и йодом. В нормальных условиях металл реагирует с хлором и бромом. Он не реагирует с водородом. Алюминий образует сплавы с металлами, содержащими подгруппу — алюминий.
Сильно реагирует с водой, если оксидная пленка чистая. Легко реагирует со слабыми кислотами. При нагревании происходит реакция с плотными нитратами и сульфатами. Алюминий легко вступает в реакцию со щелочами. Практическое применение в металлургии нашли реакции алюминия — способность восстанавливать металлы из оксидов и солей.
Вместо чистого алюминия в качестве строительных материалов обычно используются различные сплавы на его основе. Нумерация сплавов в этой статье дана по США (маркировка Alcoa).
СТРУКТУРА
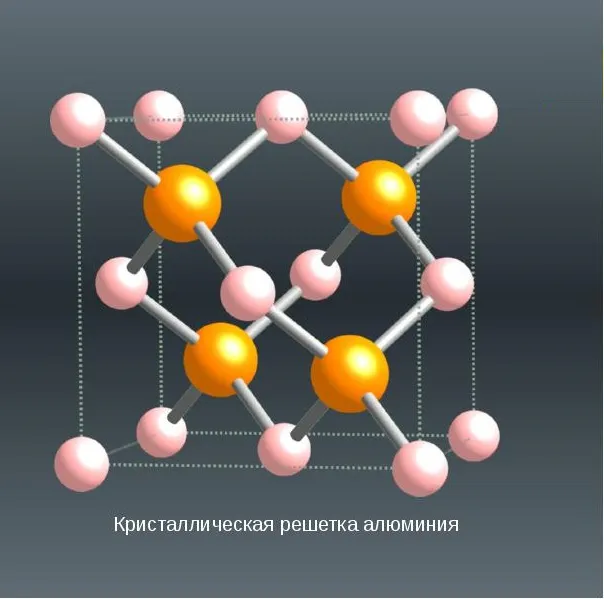
Кубическая конструкция с гранями. Четыре оранжевых человека.
Кристаллическая решетка алюминия представляет собой центральный куб и стабильна в диапазоне от 4°K до температуры плавления. Алюминий не имеет гомогенных превращений. Это означает, что его структура постоянна. Ячейка состоит из четырех человек размером 4,049596 x 10 -10 -10 -10 м. Атомный объем составляет 9,999 x 10 -6 м 3 /г. Примеси в алюминии оказывают незначительное влияние на параметры решетки. Алюминий обладает многими химическими свойствами, и энергии, связанные с кислородом, серой и углеродом, очень высоки. При ряде напряжений он является одним из самых электрочувствительных элементов, и нормальный потенциал его электродов составляет -1,67 В. При нормальных условиях, во время реакции с кислородом воздуха, алюминий в течение 1 мин (2-10 -5 см), является прочной пленкой оксида алюминия A1203Это защищает его от дальнейшего окисления и тем самым повышает его коррозионную стойкость. Однако в присутствии Hg, Na, Mg, Ca, Si и некоторых других элементов алюминия или окружающей среды прочность оксидной пленки и ее защитные свойства внезапно снижаются.
СВОЙСТВА
Эндемический алюминий. Поле зрения 5 x 4 мм; Азербайджан, Гобустанский район, Каспийское море, остров Кеджазира или бык.
Алюминий — это мягкий, легкий серебристый металл с высокой тепло- и электропроводностью, парамагнитный. Температура его плавления составляет 660°C. Преимуществами алюминия и его сплавов являются низкая плотность (2,7 г/см3), относительно высокие прочностные характеристики, хорошая тепло- и электропроводность, технологичность и высокая коррозионная стойкость. Сочетание этих свойств делает алюминий одним из важнейших технических материалов. Его можно легко скрутить в проволоку и завернуть в тонкие листья. Алюминий химически активен (на воздухе покрывается защитной оксидной пленкой — оксидом алюминия), которая надежно защищает металл от дальнейшего окисления. Однако при сильном нагревании алюминиевой пыли или алюминиевого листа металл сгорает в ослепительном пламени, превращаясь в оксид алюминия. Алюминий также растворим в редкой соляной и серной кислоте, особенно при нагревании. Однако в очень разреженной и густой холодной азотной кислоте алюминий нерастворим. При воздействии щелочных растворов на алюминий оксидный слой растворяется, и образуются соли алюминия — соли, содержащие алюминий в качестве аниона.
ЗАПАСЫ И ДОБЫЧА

Что касается его присутствия в земной коре, то он сохраняет одну из трех позиций между металлом и элементом, уступая только кислороду и кремнию. По данным различных исследователей, большая концентрация алюминия в земной коре оценивается между 7,45 и 8,14%. Процесс Холла-Геру, современный метод производства, был независимо разработан американцем Чарльзом Холлом и французом Полем Геру в 1886 году.2o3 Холодная пресс-форма na3альф.6 последующий электролиз с использованием растущих расходных материалов из кокса или тонера. Этот метод производства требовал очень большого количества электроэнергии и поэтому использовался только в промышленных целях в 20 веке.
По прочности металлы разочаровывают магний, медь и кремний. Алюминиевые сплавы остаются прочными при низких температурах. Все они подразделяются на литые и деформируемые сплавы. Медно-алюминиевые сплавы превосходят медь по химической прочности.
Металл в природе
7,4-8,1% земной коры состоит из алюминия. В природе он представлен горными породами и минералами, образующими кору Земли.
Почти всегда это соединения алюминия.
- Бокситы (оксиды с примесью кремния, кальция, железа).
- Глиноземы (каолиново-песчаная либо известковая, магнезиальная смесь).
- Нефелины (с калием).
- Каолиниты.
- Корунды.
На кукурузном поле они сосуществуют с «твердым» наждаком и драгоценными камнями — сапфиром и рубином. Структура их плоти идентична.
Соединения алюминия содержатся в речной, морской и океанической воде. В чистом виде встречается только в вулканах.
Месторождения и методы добычи
Основным источником алюминия является боксит. Их месторождения сосредоточены в тропических и субтропических регионах.

Добыча алюминия
Россия богата нефелиновой рудой, поступающей с севера страны (Кольский и Керрово-Херсониссос).
Мировые запасы сырья оцениваются в миллионы тонн.
Они добываются открытым или подземным способом.
Физико-химические характеристики
Следующие свойства алюминия важны для практических целей: это очень хороший материал для производства алюминия.
Наконец, он прост в использовании. Металл пригоден для всех видов обработки (ковка, вытягивание, штамповка, прокатка, шлифовка).

Микроскопическое семейство алюминия на гравированной поверхности кирпича, чистота 99,9998%.
Сплавы AL-MG обрабатываются хромом, марганцем, титаном, кремнием или ванадием для улучшения прочностных характеристик. Медь и железо в сплавах этой системы избегаются для снижения устойчивости к коррозии и сварке.
В авиации использование легких и прочных металлов не только необходимо.

Пуленепробиваемые и бронированные стекла и экраны смартфонов содержат сапфир. Это стекло обладает высокой устойчивостью к сжатию.
Интересно: ученые продолжают разрабатывать виды стекла, которые обеспечивают устойчивость к уменьшению толщины и веса сфер. Прозрачные монокристаллические сапфировые экраны считаются перспективной разработкой.
Алюминий используется для изготовления алюминиевой фольги для использования в электрических конденсаторах. Домохозяйки любят запекать продукты в фольге для своей семьи. Кастрюли, сковородки и другие предметы домашнего обихода изготавливаются из «крылатого металла».

Тонко измельченные металлические порошки используются для изготовления прочных красок.
Возможно, вы удивитесь, узнав, что кухонные алюминиевые кастрюли, самолеты и кольца с сапфирами связаны друг с другом. У каждого из нас есть свои герои.
Удивительно, но треть всего железнодорожного транспорта составляет самоходная артиллерия. Вес груженого вагона составляет одну треть от веса повозки. Не говоря уже о легковых автомобилях, где вес людей в машине составляет всего 5% от веса транспортного средства; остальное — вес автомобиля.
Оксиды алюминия — это корунд. К ним относятся алюминийсодержащие драгоценные камни сапфир, рубин и изумруд. Сам корунд используется в качестве наждака.
Вместо чистого алюминия в качестве строительных материалов обычно используются различные сплавы на его основе. Нумерация сплавов в этой статье дана по США (маркировка Alcoa).
Химические свойства


В нормальных условиях алюминий покрыт тонкой, прочной оксидной пленкой и не вступает в реакцию с обычными окислителями.2O(t°); O2, HNO3 (без отопления). В результате алюминий практически не подвержен коррозии и поэтому пользуется большим спросом в современной промышленности. Однако, если оксидный слой поврежден (например, при контакте с растворами аммонийных солей NH)4 +аммиачные растворы, термические щелочи или амальгамы), алюминий действует как активный восстановительный металл.
Он легко вступает в реакцию с простыми веществами:.
- с кислородом, образуя оксид алюминия(если Al находится в виде пыли или амальгамы): 4Al + 3O2 = 2Al2o3
- с галогенами (кроме фтора) 6, образуя хлорид, бромид или иодид алюминия: 2Al + 3Hal2 = 2AlHal3 (Hal = Cl, Br, I)
- с другими неметаллами реагирует при нагревании:
- с фтором, образуя фторид алюминия: 2Al + 3F2 = 2AlF3
- с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3
- с азотом, образуя нитрид алюминия: 2Al + N2 = 2AlN
- с углеродом, образуя карбид алюминия: 4Al + 3С = Al4С3
Сульфид алюминия и карбид алюминия полностью гидролизуются.
- с водой (после удаления защитной оксидной пленки, например, амальгамированием или растворами горячей щёлочи): 2Al + 6H2O = 2Al(OH)3 + 3H2
- со щелочами (с образованием тетрагидроксоалюминатов и других алюминатов): 2Al + 2NaOH + 6H2O = 2NaAl(OH)4 + 3H2 2 (NaOH-H2O) + 2Al = 2NaAlO2 + 3H2
- Легко растворяется в соляной и разбавленной серной кислотах: 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2Итак.4(разбавление) = Al2(Итак.4)3 + 3H2
- При нагревании растворяется в кислотах — окислителях, образующих растворимые соли алюминия: 8Al + 15H2Итак.4(Концентрация) = 4Al2(Итак.4)3 + 3H2S + 12H2Al + 6HNO3(концентрат) = Al(NO)3)3 + 3NO2 + 3H2o
- восстанавливает металлы из их оксидов (алюминотермия): 8Al + 3Fe3o4 = 4Al2o3 + 9Fe 2Al + Cr2o3 O = Al2o3 + 2Cr
Производство

Согласно легенде «Historia Naturalis», к римскому императору Тиберию (42 г. до н. э. — 37 г. н. э.) пришел ювелир с небьющейся металлической обеденной тарелкой, вероятно, сделанной из глинозема.2o3. Пластина была очень легкой и блестела, как серебро. По всем признакам, он должен был быть изготовлен из алюминия. Ювелир также утверждал, что только он и боги знали, как получить этот металл из глины. Тиберий опасался, что легкодоступный глиняный металл снизит стоимость золота и серебра, поэтому он приказал обезглавить ювелиров на всякий случай. Миф сомнителен, так как природного алюминия не существует в природе из-за его высокой активности, а во времена Римской империи не было технической возможности добывать алюминий из глинозема.
В 1825 году, всего через 2000 лет после Тиберия, датский физик Ханс Кристиан Ольстед получил несколько миллиграммов металлического алюминия; в 1827 году Фридрих Вёлер разбил частицы алюминия на более мелкие частицы, которые он тут же покрыл очень тонкой пленкой. Алюминий.
Алюминий не производился в промышленных масштабах до конца 19 века.
Только в 1854 году на улице Анри. Клер Девиль (его исследования финансировал Наполеон III, который оценил, что алюминий послужит его армии7 8) изобрел первый промышленный процесс получения алюминия на основе двуххлористого натрия и NaCl, заменив алюминий металлическим натрием.. -AlCl алюминий.3. Первые 6-8 кг металлической стружки были произведены в 1855 году. За 36 лет использования в период с 1855 по 1890 год метод St. Clare Deville произвел 200 тонн алюминиевого металла. В 1856 году алюминий также был получен электролизом расплавленного хлорида натрия-алюминия.
В 1885 году в Гмерингеме, Германия, был построен завод по технологии, предложенной Николаем Бекетовым. Технология Бекетова мало чем отличалась от метода Девиля, но была проще и использовала криолит (Na3альф.6) и магний. За пять лет комбинат произвел около 58 тонн алюминия. Это эквивалентно более чем четверти мирового производства химических металлов с 1854 по 1890 год.
Изобретенный почти одновременно Чарльзом Холлом в США и Полем Геру (1886) во Франции, этот метод, основанный на использовании алюминия, полученного электролизом глинозема, растворенного в расплавленном криолите, заложил основы современных методов производства алюминия. С тех пор производство алюминия усовершенствовалось благодаря достижениям в области электротехники. Значительный вклад в развитие глиноземного производства внесли российские ученые К. И. Байер, Д. А. Пеняков, А. Н. Кузнецов, Е. И. Жуковский, А. А. Яковкин и другие.
Первый алюминиевый завод в России был построен в Волхове в 1932 году. В 1939 году советская металлургическая промышленность произвела 47,7 тыс. тонн алюминия, еще 2,2 тыс. тонн было импортировано.
Вторая мировая война значительно увеличила производство алюминия. В 1939 году мировое производство алюминия составляло 620 000 тонн без учета СССР, но к 1943 году оно выросло до 1,9 млн. тонн.
К 1956 году в мире производилось 3,4 миллиона тонн первичного алюминия, в 1965 году — 5,4 миллиона тонн, в 1980 году — 16,1 миллиона тонн, а в 1990 году — 18 миллионов тонн.
В 2007 году в мире было произведено 38 млн. тонн первичного алюминия, а в 2008 году — 39,7 млн. тонн. Основными производителями являются.
Поэт Андрей Вознесенский осенью 1959 года, в 12 году, написал стихотворение, в котором в качестве художественного образа использовал алюминий.
… А за окном — поле с алюминием в молодом инее …
Виктор Цой написал песню ‘AluminiumCucumbers’ с припевом.
Посадка алюминиевых огурцов на поле с брезентом
Ленинградская рок-группа «Народная милиция» записала одну песню «Алюминиевый дом» на своем альбоме 1989 года «Брежнев жив».
Алюминий играет важную роль в исторической и мистической трилогии «Алюмен» Андрея Валентинова и Олди.
В произведениях эпохи знакомства человечества с алюминием
- В повести Н. Г. Чернышевского «Что делать?» (1862—1863) один из главных героев повести в своём письме другому пишет, что ему довелось увидеть слиток металла, « который называется алюминиум », и что, учитывая свойства алюминия, он уверен, что за алюминием большое будущее (во времена Н. Г. Чернышевского алюминий ещё только начинали открывать).
- В повести Герберта Уэллса «Война миров» (1897 год) марсиане, покинув один из своих лагерей, оставили (бросили) в нём несколько листов алюминия.








