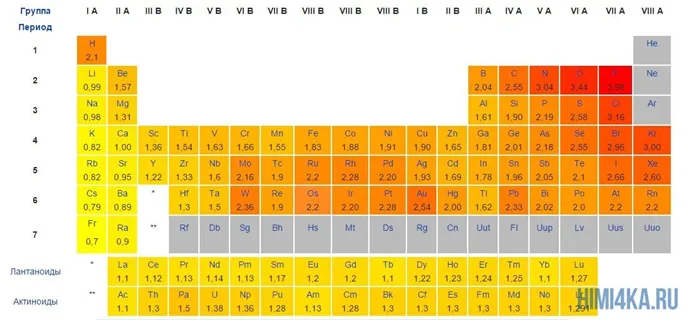
Попробуйте вспомнить наиболее электроотрицательные химические элементы в порядке убывания электроотрицательности: I, Br, N, Cl, O, F. Вы всегда можете воспользоваться приведенной ниже таблицей электроотрицательности, чтобы помочь себе.
7 класс
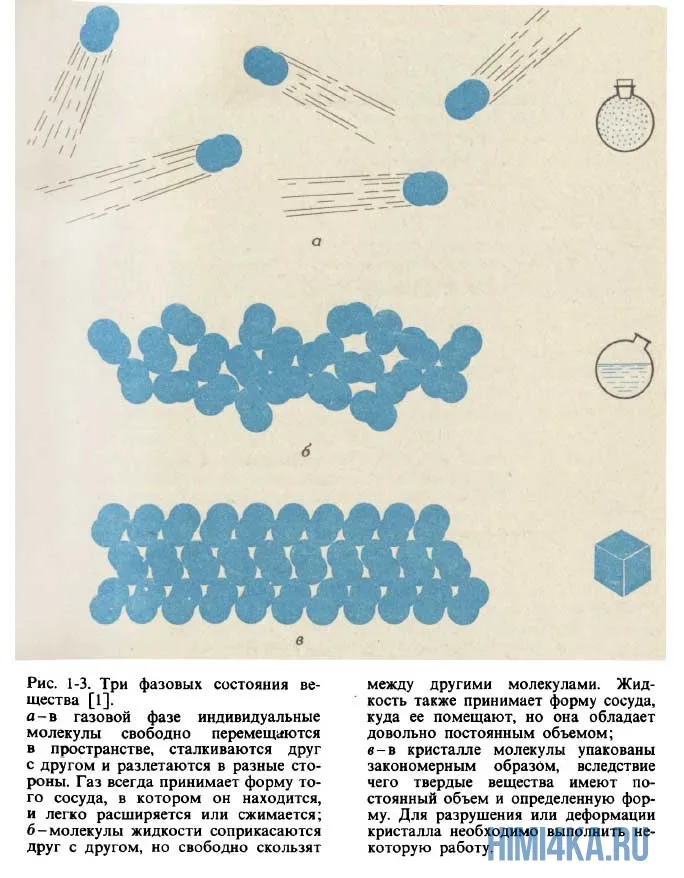
Если все тела состоят из мельчайших частиц (молекул или атомов), почему твердые и жидкие вещества не распадаются на отдельные молекулы или атомы? Что удерживает их вместе, потому что молекулы разделены между они мешают друг другу и находятся в постоянном беспорядочном движении?
Дело в том, что между молекуламИ существует взаимная притяжение. Каждая молекула привлекает всех своих соседей молекулы и сам притягивается к ним.
Когда мы рвем нитку, ломаем палку или рвем лист бумаги, мы преодолеваем силы. притяжения между молекулами.
Заметить притяжение между двумя молекулами это совершенно невозможно. Но когда многие миллионы этих частиц притягиваются, взаимное притяжение достигается смысл. Поэтому канаты или стальную проволоку трудно разорвать вручную.
Притяжение между молекуламПричем в разных веществах он разный. Это объясняет разную прочность тел. Стальная проволока, например, прочнее медной. Это означает, что частицы стали сильнее притягиваются друг к другу, чем частицы меди.
Притяжение между молекулами становятся видимыми только тогда, когда они находятся очень близко друг к другу. На расстоянии, превышающем размер самих частиц молекул, притяжение они ослабевают. Две капли воды сливаются в одну, когда они соприкасаются друг с другом. Два свинцовых цилиндра слипаются, когда их ровные, прямолинейные поверхности плотно прижимаются друг к другу. Связь может быть настолько прочной, что цилиндры невозможно разделить даже при сильном заряде (рис. 26).

Однако осколки стекла не могут сплавиться, даже если их плотно прижать друг к другу. Из-за неоднородности невозможно подвести их на расстояние, на котором частицы смогут притягиваться друг к другу. Однако если размягчить стекло, нагрев его, то различные части можно сблизить, и тогда стекло сплавится.
Это означает, что частицы стекла находятся на расстоянии, на котором притяжение между ними.
Соединение металлических деталей сваркой или пайкой, а также сварка основаны на на притяжении молекул друг к другу.
Следовательно, между молекулами (атомы) существуют взаимные притяжение, которые могут быть восприняты только на расстояниях, связанных с размером молекул (атомов).


Давайте попробуем понять, почему между молекуламесть пробелы. Если молекулы притягиваются друг к другу, они должны оставаться вместе. Это не тот случай, поэтому что между молекулами (атомы) существуют одновременно отталкивание.
На расстояниях, сравнимых с размерами молекул (атомы), наиболее заметен притяжение, и на меньших расстояниях — отталкивание.
Многие наблюдаемые явления подтверждают существование…. отталкивания между молекулами.
Например, сжатое тело выпрямляется. Это происходит потому, что компрессы молекулы находятся так далеко друг от друга, что оказывают сильное и мощное воздействие на организм. отталкивание.
Некоторые явления в природе можно объяснить с помощью притяжением молекул друг друга, например, смачивание твердого тела жидкостью.
Стеклянная пластина подвешивается на нити так, чтобы нижняя сторона пластины была горизонтальной (рис. 27). Эту пластину помещают в емкость с водой так, чтобы она находилась на поверхности воды (рис. 27, а). Когда пластина отодвигается от воды, пружина заметно расширяется (рис. 27, b). Это доказывает существование притяжения между молекулами. По удлинению пружины можно судить о ее размерах. Когда пластина разорвана, видно, что на ней остался тонкий слой воды, т.е. пластина была смочена водой (рис. 27, в). Это означает, что, отсоединив пластину, мы имеем притяжение между молекулами вода. Поломка не произошла, когда молекулы воды и стеклянных частиц, но где где молекулы воды соприкасаются друг с другом.
Заметить притяжение между двумя молекулами это совершенно невозможно. Но когда многие миллионы этих частиц притягиваются, взаимное притяжение достигается смысл. Поэтому канаты или стальную проволоку трудно разорвать вручную.
Притяжение и отталкивание молекул
Физические свойства тел и их общее состояние зависят от от взаимодействия молекул или атомы, из которых состоят тела. Когда мы надкусываем яблоко, рвем кусок туалетной бумаги или отламываем сухую веточку, мы преодолеваем силы, с которыми взаимодействуют молекулы, — силы их притяжения.
Если смочить листья водой, они слипнутся. как молекулы воды приблизятся к молекулам до такой степени, что силы притяжения.
Взаимное молекулярное притяжение варьируются от материала к материалу, что приводит к различиям в плотности, эластичности и прочности.
Кусочки пластилина можно легко отделить друг от друга, потому что силы притяжения между частиц пластилина малы.
Металлы обладают сильными притяжением между молекулами. Поэтому металлические куски трудно разорвать или сломать. Это свойство металлов используется для изготовления прочных изделий. Некоторые металлические сплавы имеют прочность, отличную от прочности металлов, из которых они изготовлены. Медь, сплав меди и олова, прочнее меди и олова.
Эффективный диаметр молекулы — Минимальное расстояние, на котором центры двух предметов находятся молекул при столкновении.
На больших расстояниях, чем фактический диаметр. молекулы, преобладают силы притяжения. Большая близость имеет электростатическую природу. отталкивание.
Межмолекулярное взаимодействие является электростатическим по своей природе. В этом взаимодействии физическая и химическая природа вещества не меняется.
Данный веб-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой в понимании статьи 437 Гражданского кодекса Российской Федерации. Анна Евкова не предлагает никаких услуг.
Температура плавления и кипения
Возможно, вы слышали, что температура — это мера тепловой энергии. молекул т.е. скорость движения и вибрации молекул (и атомов) зависит от температуры. При низких температурах энергия теплового движения составляет молекул очень мала, поэтому молекулы несколько «сонный», и силы Ван-дер-Ваальса без труда удерживают его в упорядоченной, плотно упакованной кристаллической решетке. Очевидно, что это состояние описывает твердое кристаллическое состояние. Если к телу в твердом кристаллическом состоянии подводится тепло, то молекулы кристаллы просыпаются и начинают все больше колебаться относительно своего равновесного положения в кристаллической решетке. Когда к кристаллу подводится достаточное количество энергии, молекулы они начинают «просыпаться»: прорываются сквозь кристаллическую решетку и начинают свободно скользить друг по другу, но все еще находятся в контакте друг с другом. Это состояние представляет собой жидкое состояние, а температура перехода из твердого состояния в жидкое называется температурой плавления вещества. Но молекулы Жидкость все еще удерживается вместе силами Ван-дер-Ваальса, хотя они уже обладают таким количеством энергии, что не остаются в стабильном положении. Когда к жидкости добавляется дополнительная энергия, молекулы они превращаются в суперлюдей, двигаются очень быстро и даже могут преодолевать силы Ван-дер-Ваальса. притяжения, Они полностью отдаляются друг от друга. Это соответствует переходу из жидкой фазы в газообразную. Молекулы в газе движутся хаотично (по независимым орбитам). молекулярнезависимые пути). Температура кипения вещества — это температура, необходимая для полного преодоления ван-дер-ваальсовых сил в жидкости.
В приведенной ниже таблице сравниваются температуры плавления и кипения некоторых веществ, полученных из простых молекул. В целом, самые высокие молекулам вещества обычно имеют более высокие температуры плавления и кипения, потому что они молекулы имеют большую площадь поверхности, что приводит к увеличению ван-дер-ваальсовых сил, так что при одинаковом давлении H2 кипит при -252°C, а CH4 при -164 °C и C8H18 необходимо нагреть до +125,7 °C для того, чтобы его молекулы отделяются друг от друга и переходят в газовую фазу.

Ковалентная полярная химическая связь
Помимо сил Ван-дер-Ваальса, существуют и другие силы междумолекулярного взаимодействия, связана с типом химической связи, т.е. с полярностью молекул. Если два атома соединены ковалентной связью, но один из них притягивает пару электронов сильнее, чем другой атом, пара электронов смещается в сторону «более сильного» атома. В «сильном» атоме имеется избыточный отрицательный заряд, записываемый символом δ — (а не минусом, так как это означало бы полный заряд электрона), а в другом атоме появляется небольшой положительный заряд δ +, и когда противоположные заряды начинают притягиваться друг к другу, образуется ковалентная полярная химическая связь.
Сила» атома определяется его электроотрицательностью: Чем больше электроотрицательность химического элемента, тем сильнее он притягивает к себе электроны.
Приведем примеры молекул, Атомы с ковалентными полярными связями: CO, H2O, HCl. Как видно из примеров, ковалентные полярные химические связи, как и неполярные, образуют только между неметаллические атомы и разница в электроотрицательности между неметаллических атомов должно быть больше 0,4, но меньше 2,0. Если разница в электроотрицательности атомов меньше 0,4 между он считается неполярным ковалентным продуктом. Думаю, теперь вы имеете представление о различиях между ковалентными полярными и ковалентными неполярными химическими связями.
Попробуйте вспомнить наиболее электроотрицательные химические элементы в порядке убывания электроотрицательности: I, Br, N, Cl, O, F. Вы всегда можете воспользоваться приведенной ниже таблицей электроотрицательности, чтобы помочь себе.
Данный веб-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой в понимании статьи 437 Гражданского кодекса Российской Федерации. Анна Евкова не предлагает никаких услуг.








