Устойчивость к лекарствам редко возникает у штаммов дикого типа, но устойчивые штаммы получают от пациентов, которые их принимают. Чувствительность и устойчивость вирусов к амантадину и римантадину являются перекрестными реакциями.
Обратная транскрипция у вирусов
Процесс репликации РНК-вирусов во многом отличается от только что рассмотренного процесса репликации ДНК-вирусов. Их геном состоит из РНК, которая является уникальной среди генетических систем; эта РНК транскрибируется, транслируется и реплицируется совершенно иначе, чем ДНК. Более того, механизмы этих процессов значительно отличаются у РНК-вирусов разных групп.
По сравнению с большинством ДНК-вирусов, РНК-вирусы несут лишь крайне ограниченный объем генетической информации и поэтому кодируют относительно небольшое количество ферментов; само собой разумеется, что им требуется хотя бы одна РНК-зависимая РНК-полимераза. Наконец, для подавляющего большинства РНК-вирусов характерно то, что они созревают путем почкования через цитоплазматические мембраны.
Прежде чем перейти к систематическому обзору репликации РНК-вирусов, мы кратко остановимся на тех фазах цикла, где существуют важные различия между РНК- и ДНК-вирусами.
К чести Балтимора (1971b), вирусологи выработали четкое понимание различных путей транскрипции, трансляции и репликации РНК-геномов в РНК-вирусах разных родов. РНК, выделенная из вируса, является инфекционной только в том случае, если а) геном не фрагментирован и б) отсутствует транскриптаза (вирион). Последнее отражает полярность вирусной РНК.
Транскриптаза требуется только в том случае, если вирусная РНК является «антиматричной» и поэтому должна быть транскрибирована для образования комплементарной мРНК. Особым случаем является обратная транскриптаза лейковируса.
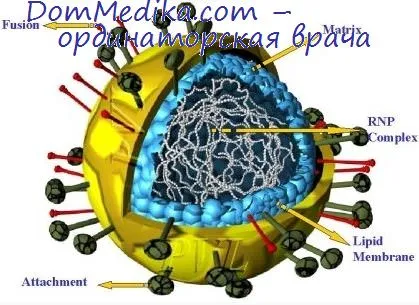
Чтобы упростить обсуждение, сначала необходимо объяснить терминологию, которую мы будем использовать для вирусной РНК различных видов. В этой книге мы используем термин «кРНК» для обозначения РНК, комплементарной вирусной РНК (вРНК), независимо от полярности вРНК. Другими словами, мРНК пикорнавирусов идентична вРНК (может называться вмРНК), в то время как мРНК рабдовирусов — это кРНК (или кмРНК).
Нам кажется, что эта терминология вызывает меньше путаницы, чем любая из двух альтернативных терминологий, которые читатель может встретить в литературе, а именно: а) традиционное обозначение вирусной РНК как «+» и ее комплементарной РНК как «-» или б) более позднее предложение Балтимора обозначать мРНК как «+» и комплементарную РНК как «-«.
Обе идеи логичны, но существование двух противоположных обозначений говорит о том, что мы не должны использовать ни одно из них; предлагаемая нами терминология четко определяет тип РНК, о котором идет речь.
Альтернативные механизмы, с помощью которых генетическая информация, закодированная в рРНК, может попасть в процесс трансляции, следующие:
1. Одноцепочечная молекула вирусной РНК (вРНК) пикорнавирусов и тогавирусов может рассматриваться как гигантская матричная молекула (мРНК), содержащая важную генетическую информацию («смысл»), которая транслируется непосредственно в белок рибосомами. Образовавшийся гигантский полипептид последовательно расщепляется ферментами на более мелкие полипептиды.
2. однако одноцепочечная молекула РНК парамиксовирусов и рабдовирусов является «антиматрицей». В этом случае транскрипция должна сначала привести к образованию РНК с комплементарной нуклеотидной последовательностью (кРНК), и только она распознается молекулами тРНК и рибосомами как мРНК и может быть переведена для образования белков. Кодируемая вирусом РНК-зависимая РНК-полимераза (транскриптаза), расположенная в спиральном нуклеокапсиде рибонуклеопротеина (РНП) этих вирусных родов, катализирует синтез кРНК in situ во внутриклеточном рибонуклеопротеине. По крайней мере, некоторые из синтезированных транскриптов имеют полную длину генома; вопрос о том, как образуются более мелкие молекулы, еще предстоит выяснить. В любом случае, небольшие моноцистронные молекулы кРНК образуются либо путем прямой транскрипции, либо путем расщепления полноразмерных молекул кРНК. К 3-концевому концу каждой из этих молекул присоединяется поли(А), и затем они транслируются независимо друг от друга, образуя отдельный полипептид.
Читайте также
Через десять лет после открытия структуры ДНК и расшифровки генетического кода Джеймс Уотсон в 1952 году сформулировал гипотезу об однонаправленной передаче генетической информации (от нуклеиновой кислоты к РНК).
Глава 6 ИСТОРИЯ ТЕЛА И ОТНОШЕНИЯ ГЕНЕРАЛЬНОЙ ЛИНИИ В этой главе рассматривается, как последовательности ДНК различных генов антител в клетках зародышевой линии могли измениться в ходе эволюции. Некоторые данные свидетельствуют о том, что существует генная обратная связь, т.е.
Перезапись генетического текста и перевод в белковый текст (транскрипция и трансляция)
Транскрипция генетического текста и перевод в белковый текст (транскрипция и трансляция) В клетке ДНК служит матрицей, на которой сначала синтезируются различные РНК. Процесс транскрипции генетической информации из ДНК в текст РНК называется
Транскрипция генетического текста и перевод в белковый текст (транскрипция и трансляция) В клетке ДНК служит матрицей, на которой сначала синтезируются различные РНК. Процесс транскрипции генетической информации из ДНК в текст РНК называется
БИОЛОГИЧЕСКАЯ ОБРАТНАЯ СВЯЗЬ (БОС)
7. БИОЛОГИЧЕСКАЯ ОБРАТНАЯ СВЯЗЬ (БОС) Интерес к исследованиям биологической обратной связи (БОС) для волевого управления ФС на основе объективной информации о динамике психофизиологических маркеров возник на основе данных об изменениях в ФС человека,
Транскрипция Транскрипция — это процесс переноса генетической информации с ДНК на РНК. Только одна из двух цепей ДНК (так называемая смысловая цепь) служит шаблоном для синтеза РНК. Транскрипция происходит не во всей молекуле ДНК, а в части гена. Ген
Функция в вирусах
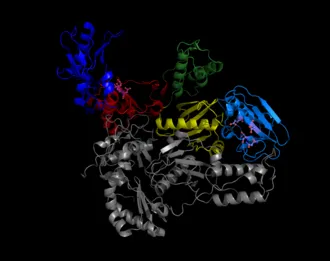
Обратная транскриптаза содержится в пальцах, ладонях и больших пальцах. Каталитическая аминокислота из активного сайта РНКазы H и полимеразы Активный сайт показан в виде кружка.
Эти ферменты кодируются и используются вирусами, которые используют обратную транскрипцию в качестве одного из этапов процесса репликации. РНК-вирусы с обратной транскрипцией, такие как ретровирусы, используют фермент для обратной транскрипции своего РНК-генома в ДНК, которая затем включается в геном хозяина и реплицируется вместе с ним. Обратной транскрипцией ДНК вирусы, такие как гепаднавирусы, могут использовать РНК в качестве матрицы для сборки и создания клонов ДНК. ВИЧ заражает людей с помощью этого фермента. Без обратной транскриптазы вирусный геном не может быть интегрирован в клетку-хозяина, что делает репликацию невозможной.
Процесс обратной транскрипции или ретротранскрипции
Обратная транскриптаза генерирует двухцепочечную ДНК из матрицы РНК.
У видов вирусов с обратной транскриптазой, у которых отсутствует активность ДНК-зависимой ДНК-полимеразы, генерация двухцепочечной ДНК может осуществляться с помощью кодируемой хозяином ДНК-полимеразы δ, которая смешивает вирусную ДНК-РНК с праймером и синтезирует двухцепочечную ДНК по тому же механизму, что и абляция праймера, при котором вновь синтезированная ДНК вытесняет исходную РНК-матрицу.
Процесс обратной транскрипции, называемый также ретротранскрипцией или ретротранспозицией, характеризуется высокой вероятностью ошибок, и на этом этапе могут возникать мутации. Такие мутации могут привести к лекарственной устойчивости.
Обратная транскрипция ретровирусов
Механизм обратной транскрипции ВИЧ. Номера ступеней не совпадают.
Ретровирусы, также известные как RT-вирусы класса VI osRNA, — это вирусы, осуществляющие обратную транскрипцию РНК с вмешательством ДНК. Их геномы состоят из двух одноцепочечных молекул РНК в положительном смысле, с 5′ кэпом и полиаденилированным 3′ хвостом. Примерами ретровирусов являются вирус иммунодефицита человека (ВИЧ) и Т-лимфотропный Т-вирус человека (HTLV). Генерация двухцепочечной ДНК происходит в цитозоле 10 в виде серии таких этапов:
- ЛизилтРНК действует как праймер и гибридизуется с комплементарной частью генома вирусной РНК, называемой сайтом связывания праймера или PBS.
- Затем обратная транскриптаза добавляет нуклеотиды ДНК на 3′-конец праймера, синтезируя Комплементарная ДНК в U5 (некодирующую область) и R-область (прямой повтор, обнаруженный на обоих концах молекулы РНК) вирусной РНК.
- Домен фермента обратной транскриптазы, называемый РНКаза H разрушает области U5 и R на 5 ’конце РНК.
- Праймер тРНК затем «перескакивает» на 3 ’конца вирусного генома, и вновь синтезированные цепи ДНК гибридизуются с комплементарной областью R на РНК.
- Комплементарная ДНК (кДНК), добавленная в (2), дополнительно удлиняется.
- Большая часть вирусной РНК расщепляется РНКазой H, оставляя только последовательность PP.
- Начинается синтез второй цепи ДНК с использованием оставшегося фрагмента РР вирусной РНК в качестве праймера.
- Праймер тРНК уходит, и происходит «прыжок». PBS из второй цепи гибридизуется с комплементарным PBS на первой цепи.
- Обе цепи удлиняются с образованием полной двухцепочечной ДНК-копии исходного генома вирусной РНК, которая затем может быть включена в геном хозяина с помощью фермента. интегрировать.
В клеточной жизни
Самовоспроизводящиеся сегменты эукариотического генома, называемые ретротранспозонами, используют обратную транскриптазу для перемещения из одного положения в геноме в другое через промежуточную РНК. Их много в геномах растений и животных. Теломераза — еще одна обратная транскриптаза, обнаруженная во многих эукариотах, включая человека, которая несет свой собственный шаблон РНК; эта РНК используется в качестве шаблона для репликации ДНК. 15
Первые сообщения об обратной транскриптазе у прокариот появились еще в 1971 году во Франции (Belyansky et al., 1971a, 1972) и несколькими годами позже в СССР (Ромащенко 1977 16 ). С тех пор они были широко описаны как часть бактериальных ретронов — одиночных последовательностей, которые кодируют обратную транскриптазу и используются в синтезе мсДНК. Для начала синтеза ДНК необходим праймер. У бактерий праймер синтезируется во время репликации. 17
Валериан Доул из Университета штата Орегон утверждает, что вирусы сыграли эволюционную роль в развитии клеточной жизни благодаря своему разнообразию, а обратная транскриптаза играет центральную роль. 18
Структура
Обратная транскриптаза использует «декстроротаторную» структуру, подобную структуре других полимераз вирусных нуклеиновых кислот. 19 20 Помимо транскрипционной функции, ретровирусные обратные транскриптазы имеют участок, принадлежащий к семейству РНКаз H и необходимый для их репликации. Разрушая матрицу РНК, он позволяет синтезировать другую цепь ДНК. 21 Некоторые фрагменты переваривания также служат праймерами для ДНК-полимеразы (того же фермента или белка хозяина), которая отвечает за образование другой (плюсовой) нити. 19
В течение жизненного цикла ретровируса существуют три различные системы репликации. Сначала обратная транскриптаза синтезирует вирусную ДНК из вирусной РНК, а затем из вновь образованной комплементарной цепи ДНК. Второй процесс репликации происходит, когда ДНК-полимераза клетки-хозяина копирует встроенную вирусную ДНК. Наконец, РНК-полимераза II транскрибирует превирусную ДНК в РНК, которая затем упаковывается в вирусы. Поэтому мутация может произойти на любом или всех этапах репликации. 22
Обратная транскриптаза имеет высокий процент ошибок при транскрибировании РНК в ДНК, поскольку, в отличие от большинства других ДНК-полимераз, она не обладает корректирующей способностью. Такая высокая частота ошибок позволяет мутациям накапливаться быстрее, чем исправляемые формы репликации. Коммерчески доступные обратные транскриптазы от компании Promega В их руководствах приводится частота ошибок 1 к 17 000 оснований для AMV и 1 к 30 000 для M-MLV 23
Помимо создания однонуклеотидных полиморфизмов, обратные транскриптазы также участвуют в таких процессах, как транскрипция слияния, перестановка экзонов и создание искусственных антисмысловых транскриптов. 24 25 Было высказано предположение, что эта изменяющая паттерны активность обратной транскриптазы, которая может быть полностью обнаружена in vivo, может быть одной из причин обнаружения многих тысяч неаннотированных транскриптов в геномах модельных организмов. 26
Переключение шаблонов
В каждой ретровирусной частице упакованы два РНК-генома, но после заражения каждый вирус производит только один белок. 27 После заражения обратная транскрипция сопровождается матричным переключением между двумя копиями генома (копийно-селективная рекомбинация). 27 Во время каждого цикла репликации на один геном происходит от 5 до 14 событий рекомбинации. 28 Переключение паттернов (рекомбинация), по-видимому, необходимо для поддержания целостности генома и в качестве репарационного механизма для устранения повреждений генома. 29 27
Structure edit
Обратная транскриптаза использует «правостороннюю» структуру, подобную структуре других полимераз вирусных нуклеиновых кислот. 20 21 Помимо транскрипционной функции, ретровирусные обратные транскриптазы имеют участок, принадлежащий к семейству РНКазы Н, который является критическим для их репликации. Разрушая РНК-шаблон, он обеспечивает синтез другой нити ДНК. 22 Определенные фрагменты, полученные в результате переваривания, также служат праймерами для ДНК-полимеразы (либо того же фермента, либо белка-хозяина), которая отвечает за построение другой (плюсовой) цепи. 20
В течение жизненного цикла ретровируса существуют три различные системы репликации. Первый процесс — это синтез вирусной ДНК обратной транскриптазой из вирусной РНК, которая затем образует новые комплементарные цепи ДНК. Второй процесс репликации происходит, когда клеточная ДНК-полимераза хозяина копирует встроенную вирусную ДНК. Наконец, РНК-полимераза II транскрибирует превирусную ДНК в РНК, которая затем упаковывается в вирусы. Мутация может произойти во время любого или всех этих этапов репликации. 23
Обратная транскриптаза имеет высокий процент ошибок при транскрибировании РНК в ДНК, поскольку, в отличие от большинства других ДНК-полимераз, она не имеет возможности коррекции. Такая высокая частота ошибок позволяет ускорить накопление мутаций по сравнению с исправленными моделями репликации. Согласно руководству, коммерчески доступные обратные транскриптазы компании Promega имеют частоту ошибок 1 на 17 000 оснований для AMV и 1 на 30 000 оснований для M-MLV 24
Помимо создания однонуклеотидных полиморфизмов, обратные транскриптазы также участвуют в таких процессах, как слияние транскриптов, перестановка экзонов и создание искусственных антисмысловых транскриптов. 25 26 Было высказано предположение, что эта активность обратной транскриптазы, которая может быть полностью обнаружена in vivo, может быть одной из причин обнаружения многих тысяч неаннотированных транскриптов в геномах модельных организмов. 27
Template switching edit
В каждой ретровирусной частице упакованы два РНК-генома, но после заражения каждый вирус производит только один белок. 28 После инфицирования обратная транскрипция сопровождается переключением шаблона между двумя копиями генома (рекомбинация с отбором копий). 28 Существует две модели, предлагающие, почему РНК-транскриптаза переключает паттерны. Первая модель, модель принудительного отбора копий, предполагает, что обратная транскриптаза изменяет шаблон РНК, когда встречает зарубку, подразумевая, что рекомбинация обязательна для поддержания целостности вирусного генома. Вторая, модель динамического отбора, предполагает, что обратная транскриптаза меняет свой паттерн, когда функции РНКзы и полимеразы не синхронизированы, подразумевая, что рекомбинация случайна, а не является ответом на повреждение генома. Исследование Роусона и др. поддерживает обе модели рекомбинации. 28 В каждом цикле репликации на геном приходится от 5 до 14 событий рекомбинации. 29 Переключение паттерна (рекомбинация), по-видимому, необходимо для поддержания целостности генома и в качестве механизма восстановления поврежденных геномов. 30 28
Applications edit
Молекулярная структура зидовудина (AZT), препарата-ингибитора обратной транскриптазы.
Antiviral drugs edit
Поскольку ВИЧ использует обратную транскриптазу для копирования своего генетического материала и создания новых вирусов (часть цикла ретровирусной репликации), были разработаны специальные препараты, прерывающие этот процесс для подавления его роста. Эти препараты называются ингибиторами обратной транскриптазы и включают нуклеозидные и нуклеотидные аналоги зидовудина (торговое название Retrovir), ламивудина (Epivir) и тенофовира (Viread), а также ненуклеозидные ингибиторы, такие как невирапин (Viramune). citation needed.
Molecular biology edit
Обратная транскриптаза обычно используется в исследованиях для применения полимеразной цепной реакции к РНК в технике, называемой обратной транскрипцией-полимеразной цепной реакцией (RT-PCR). Классический метод ПЦР можно применять только к цепочкам ДНК, но обратная транскриптаза может быть использована для транскрипции РНК в ДНК, чтобы молекулы РНК можно было анализировать с помощью ПЦР. Обратная транскриптаза также используется для создания библиотек кДНК из мРНК. Коммерческая доступность обратной транскриптазы значительно расширила знания в области молекулярной биологии, поскольку она, наряду с другими ферментами, позволила ученым клонировать, упорядочивать и характеризовать РНК.
See also edit
- cDNA library
- DNA polymerase
- msDNA
- Reverse transcribing virus
- RNA polymerase
- Telomerase
- Retrotransposon marker
- ^ PDB: 3KLF ; Tu X, Das K, Han Q, Bauman JD, Clark AD, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E (October 2010). «Structural basis of HIV-1 resistance to AZT by excision». Nature Structural & Molecular Biology. 17 (10): 1202–9. doi:10.1038/nsmb.1908. PMC2987654. PMID20852643.
- ^
- Crick F (August 1970). «Central dogma of molecular biology». Nature. 227 (5258): 561–3. Bibcode:1970Natur.227..561C. doi:10.1038/227561a0. PMID4913914. S2CID4164029.
- ^
- Sarkar S (1996). The Philosophy and History of Molecular Biology: New Perspectives. Dordrecht: Kluwer Academic Publishers. pp. 187–232.
- ^
- Danchin É, Pocheville A, Rey O, Pujol B, Blanchet S (2019). «Epigenetically facilitated mutational assimilation: epigenetics as a hub within the inclusive evolutionary synthesis». Biological Reviews. 94 (1): 259–282. doi: 10.1111/brv.12453. PMC6378602. S2CID67861162.
- ^
- Temin HM, Mizutani S (June 1970). «RNA-dependent DNA polymerase in virions of Rous sarcoma virus». Nature. 226 (5252): 1211–3. doi:10.1038/2261211a0. PMID4316301. S2CID4187764.
- ^
- Baltimore D (June 1970). «RNA-dependent DNA polymerase in virions of RNA tumour viruses». Nature. 226 (5252): 1209–11. doi:10.1038/2261209a0. PMID4316300. S2CID4222378.
- ^
- Ferris AL, Hizi A, Showalter SD, Pichuantes S, Babe L, Craik CS, Hughes SH (April 1990). «Immunologic and proteolytic analysis of HIV-1 reverse transcriptase structure» (PDF). Virology. 175 (2): 456–64. doi:10.1016/0042-6822(90)90430-y. PMID1691562.
- ^ a b
- Konishi A, Yasukawa K, Inouye K (July 2012). «Improving the thermal stability of avian myeloblastosis virus reverse transcriptase α-subunit by site-directed mutagenesis» (PDF). Biotechnology Letters. 34 (7): 1209–15. doi:10.1007/s10529-012-0904-9. hdl: 2433/157247. PMID22426840. S2CID207096569.
- ^
- Autexier C, Lue NF (June 2006). «The structure and function of telomerase reverse transcriptase». Annual Review of Biochemistry. 75 (1): 493–517. doi:10.1146/annurev.biochem.75.103004.142412. PMID16756500.
- ^ Bio-Medicine.org — Retrovirus Retrieved on 17 Feb, 2009
- ^
- Telesnitsky A, Goff SP (1993). «Strong-stop strand transfer during reverse transcription». In Skalka MA, Goff SP (eds.). Reverse transcriptase (1st ed.). New York: Cold Spring Harbor. p. 49. ISBN978-0-87969-382-4 .
- ^
- Bernstein A, Weiss R, Tooze J (1985). «RNA tumor viruses». Molecular Biology of Tumor Viruses (2nd ed.). Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory.
- ^
- Moelling K, Broecker F (April 2015). «The reverse transcriptase-RNase H: from viruses to antiviral defense». Annals of the New York Academy of Sciences. 1341 (1): 126–35. Bibcode:2015NYASA1341..126M. doi:10.1111/nyas.12668. PMID25703292. S2CID42378727.
- ^
- Kaiser GE (January 2008). «The Life Cycle of HIV». Doc Kaiser’s Microbiology Home Page. Community College of Baltimore Count. Archived from the original on 2010-07-26.
- ^
- Krupkin M, Jackson LN, Ha B, Puglisi EV (Dec 2020). «Advances in understanding the initiation of HIV-1 reverse transcription». Curr Opin Struct Biol. 65 : 175–183. doi:10.1016/j.sbi.2020.07.005. PMID32916568. S2CID221636459.
- ^
- Krieger M, Scott MP, Matsudaira PT, Lodish HF, Darnell JE, Zipursky L, Kaiser C, Berk A (2004). Molecular cell biology. New York: W.H. Freeman and CO. ISBN978-0-7167-4366-8 .
- ^
- Romashchenko AG, et al. (1977). «Otdelenie ot preparatov DNK-polimeraz I RNK-zavisimoy DNK-polimeraz; oshistka i svoystva fermenta». Proceedings of the USSR Academy of Sciences. 233 : 734–737.
- ^
- Hurwitz J, Leis JP (January 1972). «RNA-dependent DNA polymerase activity of RNA tumor viruses. I. Directing influence of DNA in the reaction». Journal of Virology. 9 (1): 116–29. doi:10.1128/JVI.9.1.116-129.1972. PMC356270. PMID4333538.
- ^
- Arnold C (17 July 2014). «Could Giant Viruses Be the Origin of Life on Earth?». National Geographic. Retrieved 29 May 2016 .
- ^ a b
- Sarafianos SG, Marchand B, Das K, Himmel DM, Parniak MA, Hughes SH, Arnold E (January 2009). «Structure and function of HIV-1 reverse transcriptase: molecular mechanisms of polymerization and inhibition». Journal of Molecular Biology. 385 (3): 693–713. doi:10.1016/j.jmb.2008.10.071. PMC2881421. PMID19022262.
- ^
- Hansen JL, Long AM, Schultz SC (August 1997). «Structure of the RNA-dependent RNA polymerase of poliovirus». Structure. 5 (8): 1109–22. doi: 10.1016/S0969-2126(97)00261-X. PMID9309225.
- ^
- Schultz SJ, Champoux JJ (June 2008). «RNase H activity: structure, specificity, and function in reverse transcription». Virus Research. 134 (1–2): 86–103. doi:10.1016/j.virusres.2007.12.007. PMC2464458. PMID18261820.
- ^
- Bbenek K, Kunkel AT (1993). «The fidelity of retroviral reverse transcriptases». In Skalka MA, Goff PS (eds.). Reverse transcriptase. New York: Cold Spring Harbor Laboratory Press. p. 85. ISBN978-0-87969-382-4 .
- ^
- «Promega kit instruction manual» (PDF). 1999. Archived from the original (PDF) on 2006-11-21.
- ^
- Houseley J, Tollervey D (August 2010). «Apparent non-canonical trans-splicing is generated by reverse transcriptase in vitro». PLOS ONE. 5 (8): e12271. Bibcode:2010PLoSO. 512271H. doi: 10.1371/journal.pone.0012271. PMC2923612. PMID20805885.
- ^
- Zeng XC, Wang SX (June 2002). «Evidence that BmTXK beta-BmKCT cDNA from Chinese scorpion Buthus martensii Karsch is an artifact generated in the reverse transcription process». FEBS Letters. 520 (1–3): 183–4, author reply 185. doi: 10.1016/S0014-5793(02)02812-0. PMID12044895. S2CID24619868.
- ^
- van Bakel H, Nislow C, Blencowe BJ, Hughes TR (2011). «Response to «The Reality of Pervasive Transcription» «. PLOS Biology. 9 (7): e1001102. doi:10.1371/journal.pbio.1001102. PMC3134445 .
- ^ a b c d
- Rawson JM, Nikolaitchik OA, Keele BF, Pathak VK, Hu WS (November 2018). «Recombination is required for efficient HIV-1 replication and the maintenance of viral genome integrity». Nucleic Acids Research. 46 (20): 10535–10545. doi:10.1093/nar/gky910. PMC6237782. PMID30307534.
- ^
- Cromer D, Grimm AJ, Schlub TE, Mak J, Davenport MP (January 2016). «Estimating the in-vivo HIV template switching and recombination rate». AIDS. 30 (2): 185–92. doi:10.1097/QAD.0000000000000936. PMID26691546. S2CID20086739.
- ^
- Hu WS, Temin HM (November 1990). «Retroviral recombination and reverse transcription». Science. New York, N.Y. 250 (4985): 1227–33. Bibcode:1990Sci. 250.1227H. doi:10.1126/science.1700865. PMID1700865.
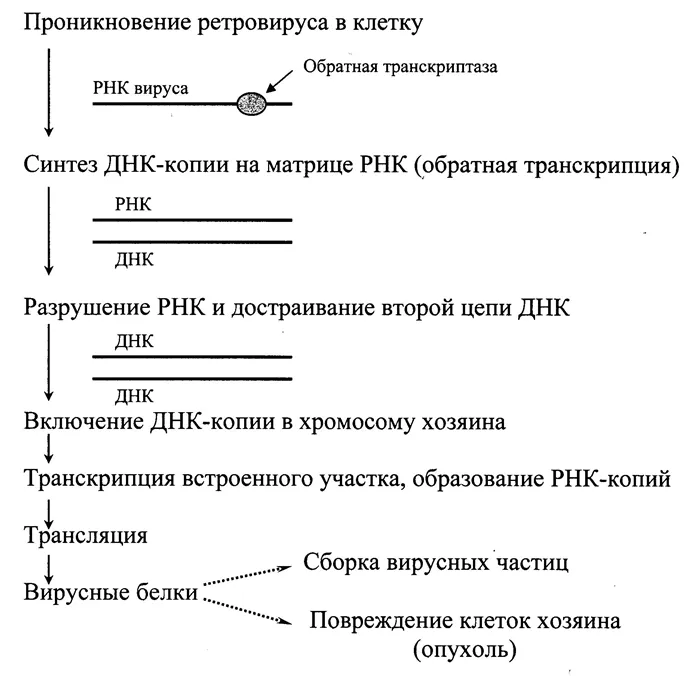
Механизм ОТ
Этапы обратной транскрипции могут варьироваться в зависимости от семейства вирусов, то есть в зависимости от типа их нуклеиновой кислоты.
Давайте сначала рассмотрим вирусы, использующие обратную транскрипцию. Здесь процесс ОТ разделен на 3 этапа:
Такой тип репликации вириона характерен для некоторых онкогенных вирусов и вируса иммунодефицита человека (ВИЧ).
Следует отметить, что для синтеза каждой нуклеиновой кислоты на РНК-матрице необходим праймер. Праймер — это короткая нуклеотидная последовательность, которая комплементарна 3′ концу молекулы РНК (матрицы) и играет важную роль в инициации синтеза.
Когда готовые двухцепочечные молекулы ДНК вирусного происхождения включаются в эукариотический геном, активируется обычный механизм синтеза вирусного белка. В результате клетка, в которую «вторгается» вирус, превращается в ионную фабрику, производящую большое количество необходимых молекул белка и РНК.
Повторение этих циклов приводит как к репликации вирусного генома, так и к образованию мРНК, которая способна к синтезу белка в условиях инфицированной эукариотической клетки.
Биологическое значение обратной транскрипции
Процесс ОТ имеет огромное значение в жизненном цикле многочисленных вирусов (особенно ретровирусов, таких как ВИЧ): РНК вируса, заразившего эукариотическую клетку, становится матрицей для синтеза первой цепи ДНК, на которой легко достраивается вторая цепь.
Образовавшаяся двухцепочечная вирусная ДНК встраивается в эукариотический геном, что приводит к активации процессов синтеза белка вируса и образованию большого количества вирусных копий в инфицированной клетке. Это основная функция ревертазы и ОТ в целом для вируса.
У эукариот обратная транскрипция может также происходить в контексте ретротранспозонов — мобильных генетических элементов, которые могут независимо переноситься из одной части генома в другую. Такие элементы, как считают ученые, послужили причиной эволюции живых организмов.
Ретротранспозон — это участок эукариотической ДНК, который кодирует различные белки. Одна из них, ревертаза, непосредственно участвует в расфокусировке такого ретротранспозона.
Использование ОТ в науке
С тех пор как стало возможным выделить ревертазу в чистом виде, биологи используют процесс обратной транскрипции. Исследование механизма ОТ до сих пор помогает читать последовательности наиболее важных человеческих белков.
Факт, что геном эукариот, включая наш собственный, содержит неинформативные области, называемые интронами. Когда последовательность нуклеотидов считывается с такой ДНК и образуется одноцепочечная РНК, в ней отсутствуют интроны, и она кодирует исключительно белки. Если ДНК синтезируется из шаблона РНК с помощью обратной транскриптазы, ее можно легко секвенировать для определения последовательности нуклеотидов.
Нуклеиновая кислота, полученная с помощью обратной транскриптазы, называется кДНК. Он часто используется в полимеразной цепной реакции (ПЦР) для искусственного увеличения числа копий получаемой копии кДНК. Этот метод используется не только в науке, но и в медицине: лаборанты определяют сходство этой ДНК с геномами различных бактерий или вирусов в общей библиотеке. Синтез векторов и внедрение их в бактерии — одна из самых перспективных областей биологии. Если ДНК человека и других организмов может быть сформирована с помощью ОТ без интронов, то такие молекулы могут быть легко вставлены в геном бактерий. Таким образом, они становятся фабриками по производству необходимых человеку веществ (например, ферментов).
Противовирусные препараты в общей практике

противовирусные препараты — соединения природного или синтетического происхождения, используемые для лечения или профилактики вирусных инфекций. Многие из них избирательно нацелены на различные стадии вирусной инфекции и жизненного цикла.
Противовирусные препараты — это соединения природного или синтетического происхождения, используемые для лечения или профилактики вирусных инфекций. Многие из них избирательно воздействуют на различные стадии вирусной инфекции и жизненного цикла вируса.
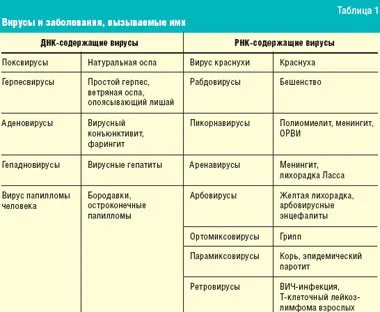
Сегодня известно более 500 вирусов, вызывающих заболевания человека. Вирусы содержат одно- или двухцепочечную рибонуклеиновую кислоту (РНК) или дезоксирибонуклеиновую кислоту (ДНК), заключенную в белковый капсид. Некоторые из них также имеют внешнюю мембрану из липопротеинов. Многие вирусы содержат ферменты или гены, которые обеспечивают репликацию в клетке-хозяине. В отличие от бактерий, вирусы не имеют собственного метаболизма: они используют метаболические пути клетки-хозяина.
РНК-содержащие вирусы либо синтезируют матричную РНК (мРНК), либо сама РНК функционирует как мРНК. На нем синтезируются вирусные белки, включая РНК-полимеразу, которая участвует в образовании вирусной мРНК. Транскрипция генома некоторых РНК-содержащих вирусов происходит в ядре клетки-хозяина. Обратная транскриптаза в ретровирусах синтезирует комплементарную ДНК (промотор) из вирусной РНК, которая встраивается в геном клетки-хозяина. В результате транскрипции образуется клеточная РНК и вирусная мРНК, из которых синтезируются вирусные белки для создания новых вирусов. Вирусы и заболевания, которые они вызывают, перечислены в таблице 1.
Основные механизмы действия противовирусных препаратов
Во время фазы заражения вирус адсорбируется на клеточной мембране и проникает внутрь клетки. В это время используются препараты, прерывающие этот процесс: растворимые псевдорецепторы, антитела против мембранных рецепторов, ингибиторы слияния вируса с клеточной мембраной.
Блокаторы ионных каналов и стабилизаторы капсида эффективны на этапе проникновения вируса, когда происходит депротеинизация вируса и «снятие» нуклеопротеина.
На следующем этапе начинается внутриклеточный синтез вирусных компонентов. На этой стадии эффективны ингибиторы вирусных ДНК-полимераз, РНК-полимераз, обратной транскриптазы, хеликаз, праймаз и интеграз. Интерфероны (IFN), антисептические олигонуклеотиды, рибозимы и ингибиторы регуляторных белков действуют на трансляцию вирусных белков. На протеолитическое расщепление влияют ингибиторы простазы.
ИФН и ингибиторы структурных белков активно влияют на сборку вируса.
Заключительный этап цикла репликации включает в себя выход дочерних ионов из клетки и гибель инфицированной клетки-хозяина. На этой стадии эффективны ингибиторы нейраминидазы, противовирусные антитела и цитотоксические лимфоциты.
Существует несколько классификаций противовирусных препаратов. В данной статье мы приводим классификацию в соответствии с воздействием на конкретный вирус (табл. 2).
Рассмотрим возбудителей гриппа и герпеса.
Классификация противовирусных препаратов, одобренных в России.
- руппа противогриппозных препаратов: – Амантадин; – Арбидол; – Осельтамивир; — Римантадин.
- Препараты, действующие на герпесвирусы: – Алпизарин; – Ацикловир; – Бонафтон; – Валацикловир; – Ганцикловир; – Глицирризиновая кислота; – Идоксуридин; – Пенцикловир; – Риодоксол; – Теброфен; – Тромантадин; – Фамцикловир; – Флореналь.
- Антиретровирусные препараты: – Абакавир; – Ампренавир; – Атазанавир; – Диданозин; – Залцитабин; – Зидовудин; – Индинавира сульфат; – Ламивудин; – Нелфинавир; – Ритонавир; – Саквинавир; – Ставудин; – Фосфазид; – Эфавиренз.
- Другие противовирусные препараты: – Инозин пранобекс; – Интерферон альфа; – Интерферон альфа-2; – Интерферон альфа-2b; – Интерферон бета-1а; – Интерферон бета-1b; – Йодантипирин; – Рибавирин; – Тетраоксо-тетрагидронафталин (Оксолин); – Тилорон; – Флакозид.
Прежде чем перейти к рассмотрению противовирусных препаратов для лечения герпеса, необходимо напомнить о различных вирусах герпеса и заболеваниях, которые они вызывают (табл. 4). К сожалению, в арсенале современных противовирусных средств нет препаратов, действующих одновременно на все вирусы герпеса (табл. 5).
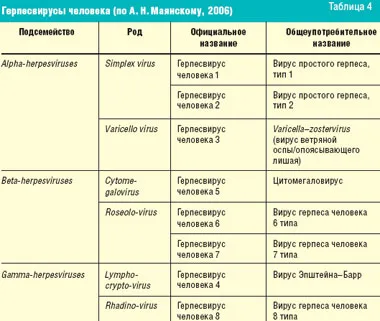
Вирус простого герпеса типа 1 вызывает поражение кожи, полости рта, пищевода и головного мозга, а вирус простого герпеса типа 2 — поражение наружных половых органов, прямой кишки, кожи и менингиса. Первым препаратом, одобренным для лечения герпеса, был видарабин (1977), но из-за его высокой токсичности он использовался только по жизненным показаниям для лечения заболеваний, вызванных вирусом простого герпеса и вирусом varicella zoster. С 1982 года ацикловир используется для лечения пациентов с менее тяжелым течением заболевания.
Ацикловир является ациклическим аналогом гуанозина, а валацикловир — L-валиновый эфир ацикловира. Ацикловир подавляет синтез вирусной ДНК после фосфорилирования вирусной тимидинкиназой в инфицированных клетках. Образующийся в клетке трифосфат ацикловира встраивается в цепь ДНК, синтезируемую в клетке-хозяине, прерывая рост цепи вирусной ДНК. Молекула ДНК, содержащая ацикловир, связывается с ДНК-полимеразой и необратимо инактивирует ее.
Устойчивость вируса может быть обусловлена снижением активности вирусной тимидинкиназы и изменением вирусной ДНК-полимеразы. Изменение активности фермента происходит в результате мутаций.
Биодоступность ацикловира при пероральном приеме составляет всего 10-30% и снижается с увеличением дозы. В отличие от ацикловира, биодоступность бацикловира при пероральном приеме составляет до 70 %. Препарат быстро и почти полностью преобразуется в ацикловир. Ацикловир проникает во многие жидкости организма, включая содержимое пузырьков при ветряной оспе, спинномозговую жидкость, накапливается в молоке, амниотической жидкости и плаценте. Его концентрация в содержимом влагалища сильно варьируется. Концентрация препарата в сыворотке крови матери и новорожденного примерно одинакова. Препарат практически не всасывается через кожу. Т1/2ацикловира в среднем составляет 2,5 часа у взрослых, 4 часа у новорожденных и может увеличиваться до 20 часов у пациентов с почечной недостаточностью. Препарат выводится почками практически в неизмененном виде. Фармакокинетика препарата не изменяется во время беременности.
В целом, ацикловир хорошо переносится. Мазь на основе полиэтиленгликоля может вызвать раздражение слизистой оболочки половых органов и чувство жжения. В редких случаях при приеме внутрь возникают головные боли, головокружение, кожная сыпь и диарея. Почечная недостаточность и нейротоксические эффекты встречаются еще реже. Валацикловир имеет схожие с ацикловиром побочные эффекты, такие как тошнота, диарея, головная боль; высокие дозы могут вызвать спутанность сознания, галлюцинации, повреждение почек и, очень редко, тромбоцитопению. При внутривенном введении высоких доз ацикловира может возникнуть почечная недостаточность и поражение ЦНС.
Сам фамцикловир неактивен, но быстро превращается в пеникловир при первом прохождении через печень. Пенцикловир является ациклическим аналогом гуанозина. Механизм действия аналогичен механизму действия ацикловира. Как и ацикловир, пенцикловир эффективен в основном против вирусов простого герпеса и вирусов опоясывающего лишая. Резистентность к пенцикловиру в клинике встречается редко.








